基于核磁-超声融合的前列腺靶向穿刺系统
2016-04-26吴海浪
倪 东,吴海浪
医学超声关键技术国家地方联合工程实验室, 广东省生物医学信息检测与超声成像重点实验室,
深圳大学医学部,广东深圳518060
基于核磁-超声融合的前列腺靶向穿刺系统
倪东,吴海浪
医学超声关键技术国家地方联合工程实验室, 广东省生物医学信息检测与超声成像重点实验室,
深圳大学医学部,广东深圳518060
摘要:利用高精度电磁定位器实时跟踪超声探头和穿刺针来引导前列腺穿刺.采用手动刚体配准方法实现三维(three dimensional, 3D)经直肠超声图像(transrectal ultrasound, TRUS)与核磁图像(magnetic resonance imaging, MRI)配准;通过二维(two dimensional, 2D)和3D探头校准,将手术前3D超声图像和手术中2D超声图像配准;结合穿刺针标定结果,实现实时二维超声和术前MRI图像融合引导下的前列腺靶向穿刺.在对前列腺体模的12次穿刺测试中,系统穿刺点全部在大小约为0.5 cm3的穿刺目标内,且实际穿刺位置与目标穿刺位置之间的程序定位误差为(2.89±0.81)mm.实验结果表明,该系统具有较高的穿刺精度,同时降低了操作的复杂度.
关键词:生物医学电子学;手术导航;前列腺活检;磁共振成像与经直肠超声融合;探头校准;前列腺靶向穿刺
前列腺癌是男性生殖系统常见的非皮肤癌,其致死率在男性癌症中排行第2[1].目前,经直肠超声(transrectal ultrasound, TRUS)引导的穿刺活检因实时性好、成本低、操作简单和成像无辐射等性能已成为检查诊断前列腺癌的金标准[2-4].然而,由于TRUS图像分辨率低及对早期前列腺癌的特异性较差,导致TRUS 引导下系统穿刺检测结果的假阴性率高达30%[5].与超声成像相比,磁共振成像(magnetic resonance imaging, MRI) 具有较高的图像对比度和分辨率,特别是高场强多参数成像方法对于前列腺癌诊断的特异性和敏感度高达90%[6].虽然,MRI多参数成像被认为是目前最有效的前列腺癌影像诊断方法,但其设备价格昂贵,高磁场成像耗时较长,且操作复杂,因此不适合作为术中引导的影像模式.
目前,通过多模态医学图像配准和融合技术,结合术前MRI图像的诊断优势与TRUS图像的实时引导优势来提供更高质量的靶向引导穿刺,被认为是前列腺穿刺活检技术发展的主要趋势之一[7].基于多模态医学影像融合的前列腺穿刺技术是当前国际研究的热点和前沿课题,其核心是对前列腺MRI-TRUS图像进行配准.由于前列腺MRI和超声图像差异较大、前列腺受探头挤压产生较大形变以及超声图像中可用于配准的特征较少等原因,前列腺MRI-TRUS图像的配准是当前医学图像配准领域极具挑战性的难题. Hu 等[8]提出结合形状统计模型和生物力学模型的前列腺MRI-TRUS图像非刚体配准方法,通过有限元模型边界条件和力学属性建立形状统计模型,将其作为先验知识约束形变过程.该方法首次将生物力学模型应用于前列腺MRI-TRUS图像的非刚体配准.另一经典方法是由Narayanan等[9]提出的自适应聚焦形变模型,通过手动分割重建MRI和超声图像中的前列腺表面,并基于表面配准和线性弹性模型将前列腺的形变信息加入到线性弹性配准方案中,从而实现MRI和三维经直肠超声图像(MRI-3D TRUS)的自动非刚体配准.Wang等[10]于2015年提出了结合有限元分析和生物力学参数构建个性化统计形变模型,使用模拟无关领域描述子(modality independent neighborhood descripor, MIND)建立可靠的面点对应关系,并通过个性化统计形变模型做进一步形变估计,从而实现前列腺MRI-TRUS图像的非刚体配准.以上方法对MRI-TRUS图像的配准都做出了前沿性工作,尽管有的方法能较好地解决MRI-TRUS配准误差以及个性化差异问题,但需要临床医生花费大量时间对MRI和TRUS数据做手动分割,且分割结果的不稳定对配准效果的影响较大。较具临床实用性的为Xu等[11]提出的基于电磁定位器的前列腺靶向穿刺系统,该系统先对术前MRI和3D TRUS图像进行手动刚体配准,然后在穿刺过程中利用电磁定位技术进行二维和三维经直肠超声图像(2D-3D TRUS)图像配准,最后根据术前刚体配准结果计算术中二维超声图像与术前MRI图像的空间转换关系.然而,该系统中使用的3D TRUS数据是基于附在超声探头上的电磁定位传感器和系列二维图像数据重建得到,此方法计算量大、扫描时间长,且重建扫描过程中探头易对前列腺造成不同程度的挤压,影响重建精度[12].
本研究基于多模态医学图像配准和融合技术,联合术前MRI图像的诊断优势和TRUS图像的实时引导优势,开发出质量更高的前列腺靶向穿刺引导系统.借助于电磁定位器准确的定位超声探头和穿刺针,通过MRI与3D TRUS手动刚体配准,利用MRI图像对早期前列腺癌的高特异性,准确选择定位穿刺区域,从而提高了前列腺癌的检出率.使用三维超声成像方法替代传统的基于定位器跟踪超声探头的图像重建方法,在三维成像过程中只需固定探头以及设置成像参数,解决了传统的图像重建方法计算量大、花费时间长以及重建扫描过程中由超声探头挤压前列腺引起的形变差异导致重建精度低等缺点,有效降低了操作的复杂度,提高三维数据的精准性.
1方法
本系统包含图像和定位器数据采集、探头校准、图像配准及穿刺引导等模块.将电磁跟踪定位传感器绑定在经直肠超声探头(型号为D310-3E, Mindray公司制造)前端,实时图像通过采集卡传输到工作站,利用定位器对每帧图像进行空间定位.由于前列腺MRI和超声图像差异较大、前列腺受探头挤压产生较大形变,以及超声图像中可用于配准的特征较少等原因,无法将2D TRUS直接与MRI图像进行配准.因此,系统利用3D TRUS分别与2D TRUS和MRI图像配准,实现2D TRUS和MRI图像配准.如图1,在2D和3D探头校准基础上,分别计算二维图像和三维图像坐标系与定位器坐标系的转换关系,实现2D-3D TRUS图像配准,然后根据术前MRI和3D TRUS图像手动刚体配准结果将术前MRI中的待穿刺区域信息融合到实时二维超声图像上[13],并结合穿刺针介入轨道进行穿刺引导.其中,2D TRUS、3D TRUS和MRI图像间的转换关系可表达为
TUS→MRI=T3DUS→MRITUS→3DUS
(1)
其中, T为转换矩阵; T3DUS→MRI是从3D TRUS到MRI图像坐标系的空间转换矩阵,可通过手动刚体配准计算得到; TUS→3DUS是从2D TRUS到3D TRUS图像坐标系的空间转换矩阵,可利用电磁定位器进行空间定位配准获取.
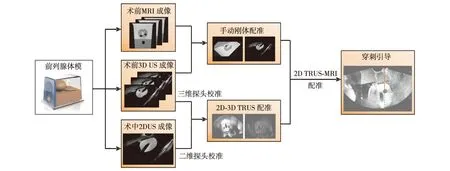
图1 系统框架示意图Fig.1 (Color online) Framework of the proposed system
1.13D TRUS-MRI配准
由于超声图像和MRI差异较大、前列腺因探头挤压及人体呼吸等产生较大变形、超声图像中可用于配准的特征较少以及前列腺在MRI和TRUS图像中边界不明显等原因,导致前列腺3D TRUS-MRI图像自动非刚体配准方法难度大、精度低,且需要临床医生花费大量时间对前列腺的MRI和TRUS图像进行手动分割,所以前列腺3D TRUS-MRI图像自动非刚体配准方法尚难以直接用于临床[11,14-15].
本系统采用基于标记点的手动刚体配准方法计算公式(1)中的 T3DUS→MRI, 实现3D TRUS-MRI配准.分别在前列腺体模的3D TRUS和MRI数据中的3个方向切面上,选择病变区的中心位置和最靠近尿道位置共6组一一对应的点作为配准基准点,并采用迭代最近点算法(iterative closest point,ICP)[16-18]计算两组点集间的转换矩阵.
1.22D-3D TRUS配准
由于前列腺超声图像中可用于配准的特征非常少、对噪声非常敏感,而且采用自由臂式穿刺,可在任意位置、方向转动探头,导致难以直接对2D-3D TRUS数据进行配准[11].因此,系统采用电磁定位器实时定位跟踪超声探头位置,分别将2D TRUS图像和3D TRUS图像坐标转换为定位器坐标,实现2D-3D TRUS图像空间定位配准,式(1)中的 TUS→3DUS, 其坐标转换公式为
TUS→3DUS=Ttracker→3DUSTUS→tracker
(2)
其中,Ttracker→3DUS是定位器到3D TRUS图像坐标系的转换矩阵; TUS→tracker是2D TRUS图像到定位器坐标系的转换矩阵.
为定位跟踪超声探头,在探头上固定1个6自由度(6-DOF)传感器,传感器与定位器间的转换矩阵 Ttrack可通过电磁定位器直接获取,但由于传感器在探头的位置不确定,无法直接计算图像与传感器之间的转换关系.因此,需要通过校准体模间接求取其转换矩阵.如图2,分别在探头和校准体模上绑定6-DOF传感器,首先通过探针校准和体模上已知几何位置的标记点,计算体模坐标系与定位器坐标系间的转换关系Treg, 然后对体模成像,获取图像和体模上两组相对应的点集,最后根据式(3)计算图像与探头坐标系间的转换矩阵Tcal. 分别计算2D US和3D US与探头坐标系间的转换矩阵 Tcal后,2D US或3D US与定位器坐标系之间的转换关系 Timage→tracker可根据式(4)计算得出.
P(x,yi,zi)=TregTtrackTcalP(ui,vi,wi)
(3)
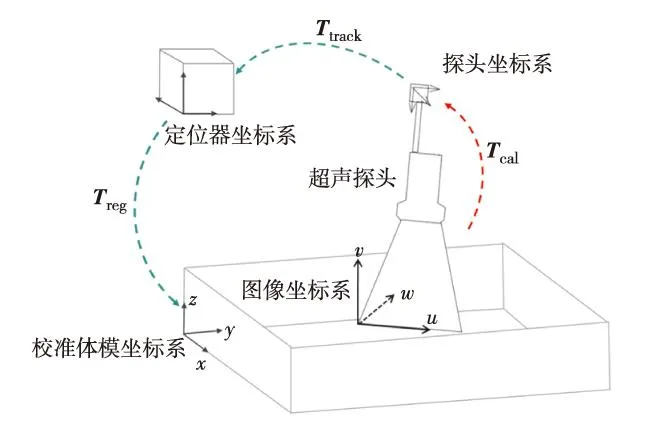
图2 探头校准坐标系间转换关系图Fig.2 (Color online) Relationship of coordinate transformation of probe calibration
其中, P(x,yi,zi), P(ui,vi,wi)分别为体模和图像上的对应点,在二维图像中wi为0; Ttrack和Treg为已知变量, Tcal为未知变量.
Timage→tracker=TtrackTcal
(4)
其中, Timage→tracker是图像坐标系到定位器坐标系的转换矩阵,表示T2DUS→tracker或T3DUS→tracker; Ttrack为已知变量, Tcal为探头校准结果.
针对成像方式的不同,探头校准可分为二维探头校准和三维探头校准.

图3 N-wire校准模型示意图Fig.3 (Color online) Illustration of N-wire calibration model

(5)
2) 三维探头校准.传统的三维探头校准方法是通过电磁定位器跟踪超声探头,将一系列二维超声图像结合每帧图像的位置信息进行三维重建,得到三维数据坐标系后,利用二维探头校准中的Treg计算三维数据坐标系与绑在探头上传感器坐标系的转换矩阵.与传统方法相比,直接使用3D探头成像获取三维数据坐标系,利用二维探头校准原理计算坐标系间的转换矩阵显得更加方便,且在传感器相对探头位置和超声成像参数都不变的前提下,不需要重复进行三维探头校准.
系统采用手动选点方法实现三维探头校准.首先,在N-wire体模上添加两条与N相交的线条,如图4(a),并计算6个交点在体模坐标系上的位置;然后,对体模做3D成像(超声成像深度为 7 cm,探头旋转角度为 90°)的同时记录探头坐标系与定位器间的转换矩阵 Ttrack, 手动在3D US图像中选取6个交点位置,如图4(b),得到图像和体模上相互对应的点集Pui,vi,wi和 Px,yi,zi. 最后,结合二维探头校准中计算得出的Treg, 根据式(3)计算三维图像与探头坐标系之间的转换矩阵Tcal, 操作时间约为2 min.

图4 3D探头校准体模示意图Fig.4 (Color online) Illustration of 3D probe calibration model
利用二维探头和三维探头校准结果,分别计算TUS→tracker和Ttracker→3DUS, 将2D TRUS图像和3D TRUS图像坐标系转到定位器坐标系下,实现2D-3D TRUS配准.
1.3穿刺引导
前列腺靶向穿刺系统基于PLUS[20]软件库进行开发,使用ITK、VTK和Qt工具包,并在Windows C++平台下实现,由计算机、采集卡(型号为MP710, UPMOS公司制造)、 超声设备(型号为DC-8, Mindray公司制造)、 电磁定位器(型号为Aurora, NDI公司制造)、 穿刺架、穿刺针(18号, 350 mm)以及前列腺体模7个部分组成.系统穿刺在二维、三维探头校准的基础上实现.穿刺引导前,采集前列腺体模3D US图像,然后通过手动刚体配准将3D US与MRI图像配准.穿刺过程中,实时2D US图像通过电磁定位器和二维、三维探头校准结果与3D US图像进行配准,然后利用穿刺前3D US与MRI配准结果,将MRI图像上待穿刺区域的轮廓信息融合到实时2D超声图像上,最后结合穿刺针的介入轨道进行引导介入穿刺,如图8(a).
2实验结果
在实验中,采用两种不同的商用前列腺体模053-MM和053 A-EF (CIRS,Norfolk,USA),两个体模均包含3个直径约为1 cm且随机分布的准球形病灶区.其中,体模053 A-EF中的3个病灶区同时在MRI和TRUS中可见,但型号为053-MM的前列腺体模中的病灶区仅在MRI图像中可见,在超声图像中不可见.
在如图5的穿刺实验中,将前列腺体模3个病灶区的中心位置作为计划穿刺核.每组穿刺实验完成后,利用电磁定位器提取穿刺针针尖所在位置,并将其作为实际穿刺位置.本系统将计划穿刺点与实际穿刺点之间的距离误差(procedural targeting error,PTE)作为系统穿刺误差,并分别对3D TRUS-MRI配准误差、2D-3D TRUS配准误差和系统穿刺误差进行评价.
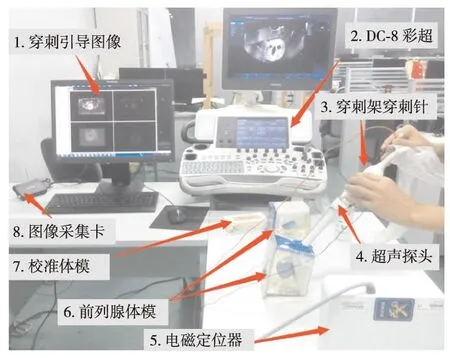
图5 系统穿刺实验Fig.5 (Color online) Prostate biopsy experiment
2.13D TRUS-MRI配准结果
采用目标配准误差(target registration error,TRE)指标对3D TRUS-MRI配准结果进行评价,具体定义为
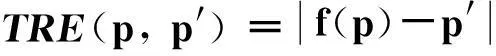
(6)
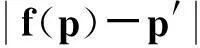


图6 3D TRUS-MRI配准效果Fig.6 Registration results between 3D TRUS and MRI data
为验证手动刚体配准的鲁棒性,采用3名不同的操作者分别对两套前列腺体模MRI-TRUS数据进行选点配准,计算其TRE误差及方差,结果如表1,3名操作者分别对两组数据进行刚体配准得到的平均目标配准误差为1.62和3.52 mm,其方差分别为0.92和1.29.
3D TRUS-MRI手动刚体配准的误差主要源自于三维成像时探头对前列腺产生的形变以及由手动选点导致的差异变化.由于前列腺MRI数据是在无外界压力下采集的,因此在采集3D TRUS数据时尽可能避免对前列腺产生挤压.

表1 三名操作者分别对两组前列腺体模MRI-TRUS
2.22D-3D TRUS配准结果
二维和三维探头校准误差是影响2D-3D TRUS配准结果的重要因素之一,其校准误差均是通过图像和体模上匹配点之间的距离计算TRE值得出.二维探头校准以300组匹配点计算转换矩阵,100组匹配点计算TRE值为(0.65±0.21) mm.三维探头校准以8组匹配点计算校准矩阵,1组匹配点计算TRE值,并通过多次实验计算其误差值为(0.83±0.11) mm.
2D-3D TRUS 配准结果采用手动在实时2D图像和3D数据切面选取标记点,且为了降低由手动选点造成的标记误差,使用N-wire校准体模替换前列腺体模进行实验计算,通过矩阵变换计算点与点之间的TRE值为(0.97±0.44) mm.
对于前列腺体模,2D-3D TRUS配准融合效果如图7,2D US图像和3D US切面上病灶区和尿道的大小、位置均基本一致,但融合图中出现部分区域错位现象,且由于二维、三维探头校准误差值较小,对2D-3D TRUS配准结果的影响不大,所以融合图上部分区域错位的原因是由数据采集过程中探头对前列腺体模的挤压程度不同引起.

图7 2D-3D US配准融合结果Fig.7 (Color online) Registration and fusion results between 2D-3D US
2.3系统穿刺结果

图8 系统穿刺引导示意图Fig.8 (Color online) Illustration of system biopsy guidance
系统结合穿刺针介入轨道和穿刺目标区域轮廓信息引导介入穿刺(如图8),并将MRI图像上选取的计划穿刺点和穿刺针实际位置之间的PTE值作为系统穿刺误差.穿刺结果如图9,在对两个体模共12次穿刺实验中,计划穿刺点和穿刺针实际位置之间的PTE值为(2.89±0.81) mm,最大值为4.27 mm.由于体模上病变区域直径在10 mm范围内,且系统穿刺的PTE值在5 mm以内,因而实际的系统穿刺点全部在计划穿刺病灶区域内.
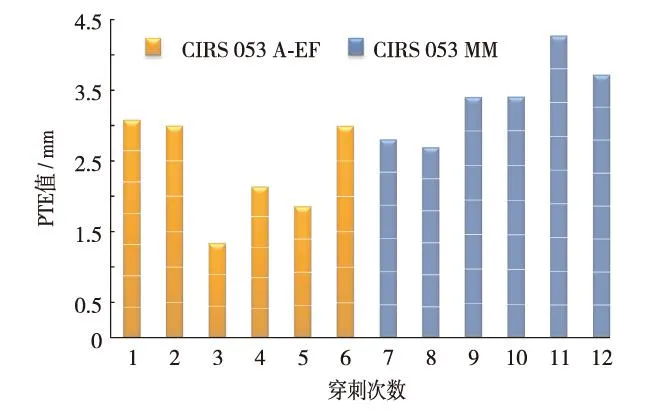
图9 系统穿刺误差Fig.9 (Color online) Error of proposed biopsy system
3讨论
本研究采用前列腺体模053 MM和053 A-EF对所开发的前列腺靶向穿刺系统进行实验测试,平均系统穿刺误差为2.89 mm,在临床可接受范围内.影响系统穿刺误差的因素有:2D TRUS-MRI配准误差、穿刺过程中探头的移动导致的错位、穿刺针受压弯曲、由穿刺针介入挤压引起前列腺形变等.而导致个别系统穿刺误差较大的主要原因为:① 3D TRUS-MRI配准精度很大程序依赖于3D TRUS数据采集时前列腺体模的形变程度以及手动选点产生的误差,导致其配准误差较大,从而影响2D TRUS-MRI融合精度;②自由臂式持取探头产生的抖动会使长为350 mm的穿刺针发生较大的形变,导致无法准确获取穿刺针针尖在电磁坐标系下的位置,直接影响误差计算结果.
Ukimura等[21]提出使用CIRS 053和CIRS 066作为测试体模的3D TRUS引导穿刺系统.该系统共进行了27次穿刺测试,但仅24次成功在0.5 cm3大小的病变区内采样,且该系统的目标配准误差为2.9 mm.Xu等[11]提出的使用MRI-TRUS融合方法进行前列腺穿刺引导系统中,其系统精度为(2.4±1.2) mm.同时,Singh等[15]使用同样的方法进行前列腺穿刺引导,其系统精度为3.3 mm.
与以上系统相比,本系统采用直接3D超声成像替代系列2D图像重建获取3D数据,并在2D TRUS引导下进行经直肠穿刺,保证穿刺准确性的同时降低了操作的复杂度.
结语
本研究基于MRI-TRUS融合方法实现了前列腺靶向穿刺系统,在MRI图像上标注待穿刺区域,然后在实时2D超声图像的引导下对前列腺体模进行穿刺,为前列腺癌的诊断提供了可靠的手段.相对于传统的穿刺方法,本研究提出使用3D超声成像替代系列2D图像重建获取3D数据,减少图像重建时间、提高图像精度以及降低操作复杂度,并在2D TRUS引导下进行经直肠穿刺,相对3D TRUS经会阴穿刺在临床应用上更加实用.未来我们将致力于2D-3D TRUS图像间配准,实现前列腺运动补偿,降低由病人呼吸、躯体运动等因素引起前列腺移动导致的配准误差.
引文:倪东,吴海浪. 基于核磁-超声融合的前列腺靶向穿刺系统[J]. 深圳大学学报理工版,2016,33(2):111-118.
参考文献/ References:
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA: a Cancer Journal for Clinicians, 2012, 62(1): 10-29.
[2] Natarajan S, Marks L S, Margolis D J, et al. Clinical application of a 3d ultrasound-guided prostate biopsy system[J]. Urologic Oncology: Seminars and Original Investigations, 2011, 29(3): 334-342.
[3] Wang Ting, Wu Junming, Huang Qinghua. Enhanced extended-field-of-view ultrasound for musculoskeletal tissues using parallel computing[J]. Current Medical Imaging Reviews, 2014, 10(4): 237-245.
[4] Zheng Shuohe, Huang Qinghua, Jin Lianwen, et al. Real-time extended-field-of-view ultrasound based on a standard PC[J]. Applied Acoustics, 2012, 73(4): 423-432.
[5] Guichard G, Larré S, Gallina A, et al. Extended 21-sample needle biopsy protocol for diagnosis of prostate cancer in 1 000 consecutive patients[J]. European Urology, 2007, 52: 430-435.
[6] Kurhanewicz J, Vigneron D, Carroll P, et al. Multiparametric magnetic resonance imaging in prostate cancer present and future[J]. Current Opinion in Urology, 2008, 18(1): 71-77.
[7] Ahmed H U, Kirkham A, Arya M, et al. Is it time to consider a role for MRI before prostate biopsy?[J]. Nature Reviews Clinical Oncology, 2009, 6(4): 197-206.
[8] Hu Y, Ahmed H U, Taylor Z, et al. MR to ultrasound registration for image-guided prostate interventions[J]. Medical Image Analysis, 2012. 16(3): 687-703.
[9] Narayanan R, Kurhanewicz J, Shinohara K, et al. MRI-ultrasound registration for targeted prostate biopsy[C]// Proceedings of the IEEE International Symposium on Biomedical Imaging: from Nano to Macro. Boston, USA: IEEE, 2009: 991-994.
[10] Wang Yi, Cheng Jiezhi, Ni Dong, et al. Towards personalized statistical deformable model and hybrid point matching for robust MR-TRUS registration[J]. IEEE Transactions on Medical Imaging, 2015, 35(2): 589-604.
[11] Xu S, Kruecker J, Turkbey B, et al. Real-time MRI-TRUS fusion for guidance of targeted prostate biopsies[J]. Computer Aided Surgery, 2008, 13(5):255-264.
[12] Fenster A, Dónal B, Neale H. Three-dimensional ultrasound imaging[J]. Physics in Medicine and Biology, 2001, 46: 67-99.
[13] 倪 东,陈思平,汪天富.基于曲光线跟踪算法的超声成像实时模拟研究[J].深圳大学学报理工版,2012,29(4):322-327.
Ni Dong, Chen Siping, Wang Tianfu. A beam width aware curvilinear ray tracing method for real-time ultrasound simulation[J]. Journal of Shenzhen University Science and Engineering, 2012, 29(4): 322-327.(in Chinese)
[14] Kaplan I, Oldenburg N E, Meskell P, et al. Real time MRI-ultrasound image guided stereotactic prostate biopsy[J]. Magnetic Resonance Imaging, 2002, 20(3): 295-299.
[15] Singh A K, Kruecker J, Xu S, et al. Initial clinical experience with real-time transrectal ultrasonography- magnetic resonance imaging fusion-guided prostate biopsy[J]. British Journal of Urology International, 2008, 101(7): 841-845.
[16] Besl P J, McKay N D. A method for registration of 3-D shapes[J]. IEEE transactions on Pattern Analysis and Machine Intelligence, 1992, 14(2): 239-256.
[17] Zhang Zhengyou. Iterative point matching for registration of free-form curves and surfaces[J]. International Journal of Computer Vision, 1994, 13(2):119-152.
[18] 贾富仓,李修往,陈思平.CT图像引导脊柱外科配准方法研究[J].深圳大学学报理工版,2007,24(4):406-409.
Jia Fucang, Li Xiuwang, Chen Siping. Registration for CT image guided spine surgery[J]. Journal of Shenzhen University Science and Engineering, 2007, 24(4): 406-409.(in Chinese)
[19] Mercier L, Lang T, Linkseth F, et al. A review of calibration techniques for freehand 3-D ultrasound systems[J]. Ultrasound in Medicine and Biology, 2005, 31(4): 449-471.
[20] Andras L, Tamas H,Adam R, et al. PLUS: open-source toolkit for ultrasound-guided intervention systems[J]. IEEE Transactions on Biomedical Engineering, 2014, 61(10): 2527-37.
[21] Ukimura O, Hirahara N, Fujihara A, et al. Technique for a hybrid system of real-time transrectal ultrasound with preoperative magnetic resonance imaging in the guidance of targeted prostate biopsy[J]. International Journal of Urology, 2010, 17(10):890-893.
【中文责编:英子;英文责编:雨辰】
MRI-TRUS multi-modality image fusion for targeted prostate biopsy
Ni Dong†and Wu Hailang
National-Regional Key Technology Engineering Laboratory for Medical Ultrasound, Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging, Division of Medicine, Shenzhen University,Shenzhen 518060, Guangdong Province, P.R.China
Abstract:The proposed system presents an approach to guide prostate biopsy by tracking the probe and needle under the high precision electromagnetic locator. Initially, manual rigid registration is explored for the three dimensional (3D) transrectal ultrasound (TRUS) and magnetic resonance imaging (MRI) images. Secondly, pre-interventional 3D ultrasound image is registered with real-time ultrasound image automatically through two dimensional (2D) and 3D probe calibration. Furthermore, the prostate targeting biopsy guidance is implemented by combining the result of needle calibration and the fused output of real-time ultrasound images and MRI images. The experiments were implemented on two commercial prostate phantoms to validate the performance of our system. All 12 biopsies can hit the randomly placed 0.5 cm3 lesion within the phantom. The procedural targeting error between planned and documented biopsy is (2.89±0.81) mm. The results have demonstrated that both the precision and operating complexity of our system are significantly improved in comparison with traditional methods.
Key words:biomedical electronics; surgical navigation; prostate biopsy; magnetic resonance imaging-transrectal ultrasound image fusion; probe calibration; prostate targeted puncture
作者简介:倪东(1977—),男,深圳大学教授.研究方向:医学图像分析与处理.E-mail: nidong@szu.edu.cn
基金项目:国家自然科学基金资助项目(6157010571);深港创新圈基金资助项目(JSE201109150013A)
中图分类号:R 318;TP 391.7
文献标志码:A
doi:10.3724/SP.J.1249.2016.02111
Received:2016-01-14;Accepted:2016-02-17
Foundation:National Natural Science Foundation of China (6157010571); Shenzhen-Hongkong Innovation Circle Fund (JSE201109150013A)
† Corresponding author:Professor Ni Dong. E-mail: nidong@szu.edu.cn
Citation:Wu Hailang,Ni Dong.MRI-TRUS multi-modality image fusion for targeted prostate biopsy[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(2): 111-118.(in Chinese)
【电子与信息科学 / Electronics and Information】
