ZrO2修饰的CuO/Fe2O3水煤气变换催化剂的性能测试与表征
2016-04-25范言语马骏驰林性贻
范言语,马骏驰,殷 玲,林性贻
(福州大学 化肥催化剂国家工程研究中心,福建 福州 350002)
ZrO2修饰的CuO/Fe2O3水煤气变换催化剂的性能测试与表征
范言语,马骏驰,殷玲,林性贻*
(福州大学 化肥催化剂国家工程研究中心,福建 福州 350002)
摘要:ZrO2是一种高熔点金属氧化物,同时具有弱酸性和弱碱性以及氧化性与还原性,具有p型半导体性质,易产生氧空穴,是理想的催化材料。通过添加不同质量分数的ZrO2(0~5%) 作为助剂,采用分步沉淀法制备系列CuO/Fe2O3-ZrO2催化剂,通过XRD、N2物理吸附-脱附、H2-TPR和CO2-TPD等表征技术,考察ZrO2助剂对CuO/Fe2O3水煤气变换催化剂催化性能的影响。结果表明,适量ZrO2(质量分数1%)的添加,削弱了CuFe2O4中铜铁物种之间的协同作用,增加了催化剂中可被还原的铜物种的数量,形成较多的弱碱性位点,有利于增加活性中心铜的数量,具有较好的水煤气变换反应活性和热稳定性。
关键词:催化化学;ZrO2改性;CuO/Fe2O3催化剂;水煤气变换反应;分步沉淀法
CLC number:O643.36;TQ426.94Document code: AArticle ID: 1008-1143(2016)01-0034-07
随着环境污染愈加严重和能源短缺问题日益突出,亟待开发出洁净和能储高的绿色新能源。H2是21世纪最为理想的清洁能源[1],不仅可用于石化和冶金等工业,还可应用于镍氢电池、燃料电池和氢能源汽车。燃料电池是近年兴起的一种高效、清洁和安全的能源。纯氢是燃料电池最为理想的燃料,虽然制氢方法多样,但工业化制氢主要依赖于化石燃料重整制氢[2],但通过重整制得的H2中含有的CO会大大降低燃料电池中Pt电极的使用寿命。水煤气变换反应不仅可以产生H2,还可以减少CO含量,通过水煤气变换反应和CO选择性氧化结合可以对CO进行深度脱除。由于燃料电池对水煤气变换反应催化剂的苛刻要求,使传统的变换催化剂无法满足燃料电池应用的需求,研究新型适合应用于燃料电池的变换反应催化剂成为焦点。
负载型贵金属催化剂因制备复杂和价格昂贵等缺点,限制了其大规模应用[3],负载型非贵金属催化剂的研究受到关注。而ZrO2是惟一同时具有弱酸性和弱碱性以及氧化和还原性的金属氧化物,而且又是p型半导体,易产生空穴,可与活性组分产生较强的相互作用,具有良好的结构稳定性[4]。Chen C Q等[5]采用几种不同的合成方法制备Cu/ZrO2催化剂,研究了氧空位对水煤气变换反应活性的影响,发现铜基催化剂中的氧空位有利于提高水煤气变换反应活性,而沉积-水热法制得的Cu/ZrO2催化剂具有更多数量的氧空位,因而具有更高的变换反应活性。郑云弟等[6]研究了ZrO2作为助剂对Cu/CeO2水煤气变换反应催化剂结构和性能的影响,结果表明,助剂ZrO2的添加,使催化剂的孔径向小孔集中,分布均匀,有利于反应的进行;适量ZrO2的添加提高了表面氧缺位的浓度,有效地分散活性组分,进而提高了水煤气变换反应活性。本文以ZrO2为助剂,掺杂改性CuO/Fe2O3催化剂为研究对象,研究ZrO2添加量对CuO/Fe2O3催化剂的结构和性能之间的关系以及对催化剂活性和稳定性的影响。
1实验部分
1.1催化剂制备
采用分步沉淀法制备不同ZrO2含量的系列CuO/Fe2O3催化剂。固定CuO的质量分数为20%,Fe2O3质量分数为(80-x)%,ZrO2为x%(x=0,1,3,5),制得的催化剂分别标记为Cu/Fe-Zr0、Cu/Fe-Zr1、Cu/Fe-Zr3和Cu/Fe-Zr5。
准确称量相应化学计量的Cu(NO3)2·3H2O、Fe(NO3)3·9H2O和Zr(NO3)4·5H2O分别配制成400 mL的混合盐溶液和25 mL的助剂溶液,称取一定量KOH配制成500 mL碱溶液;在一定速率持续搅拌下,将混合盐溶液和碱溶液通过蠕动泵同时滴加至三口烧瓶,合成过程中保持沉淀温度为80 ℃,同时通过KOH溶液调节溶液的pH=10±1。待混和盐溶液滴加完毕,开始滴加硝酸锆水溶液,滴加完成后,继续保持溶液在80 ℃恒温反应4 h,老化0.5 h,经过离心、洗涤至中性后,将得到的产物在烘箱110 ℃干燥12 h,马弗炉650 ℃焙烧4 h,经破碎和过筛,得到的(20~40)目颗粒即为制备的催化剂。
1.2催化剂性能评价
水煤气变换反应在固定床反应器进行,催化剂活性用CO转化率表示。
(20~40)目催化剂用量2 mL,空速7 500 h-1,干原料气体积组成:10%CO,12%CO2,60%H2,18%N2;H2O(水蒸汽与干原料气体积比1∶1),采用程序升温控制反应温度,活性测试温度(200~400) ℃,升温速率5 ℃·min-1,温度间隔为50 ℃,每个温度点保持2 h。
第一轮活性测试结束后,在原料气吹扫的条件下于400 ℃耐热10 h,随后自然降温至200 ℃,再进行第二轮的活性测试,测试条件与第一轮相同。
1.3催化剂表征
X射线粉末衍射采用荷兰Panalytic公司X′Pert Pro衍射仪,X′Celerator探测器,CoKα,工作电流40 mA,工作电压40 kV,λ=0.178 9 nm,步幅0.0167°, 每步10 s,扫描范围10°~80°。
低温N2物理吸附-脱附采用美国麦克仪器公司ASAP2020型气体吸附仪,催化剂于200 ℃抽真空处理3 h,-196 ℃进行实验,BET法计算比表面积,BJH法计算孔容和孔径分布。
H2程序升温还原采用美国麦克仪器公司Auto Chem2910全自动化学吸附仪,以10 ℃·min-1升温至250 ℃,用高纯He(30 mL·min-1)吹扫1 h降至室温,然后改用体积分数10%H2-Ar混合气(30 mL·min-1)吹扫,待基线平稳后,以10 ℃·min-1升温至800 ℃,TCD检测H2消耗量。
CO2程序升温脱附采用美国麦克仪器公司AutoChem 2910全自动化学吸附仪,以10 ℃·min-1升温至250 ℃,用高纯He(30 mL·min-1)吹扫1 h后,改用体积分数10%H2-Ar混合气(50 mL·min-1)于250 ℃还原1 h,再用高纯He吹扫至50 ℃,吸附CO2达到饱和后,用高纯He(50 mL·min-1)吹扫1 h,除去催化剂表面以物理吸附态存在的CO2,待基线平稳后,以10 ℃·min-1升温至450 ℃,TCD检测CO2的脱附量。
2结果与讨论
2.1XRD
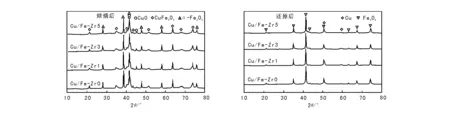
图 1 CuO/Fe2O3-ZrO2催化剂的XRD图Figure 1 XRD patterns of CuO/Fe2O3-ZrO2 catalysts
图1为CuO/Fe2O3-ZrO2催化剂焙烧与还原后的XRD图。由图1可见, 所有催化剂均出现归属为CuFe2O4(JCPDS file No.00-034-0425)和α-Fe2O3(JCPDS file No.01-089-0596)的衍射峰。添加ZrO2的催化剂还出现CuO(JCPDS file No.00-045-0937)的衍射峰。随着ZrO2添加量的增加,CuFe2O4和α-Fe2O3的峰强度有不同程度减弱,峰变得弥散宽化。由图1还可以看出,所有催化剂只有α-Fe3O4(JCPDS file No.00-019-0629)和Cu(JCPDS file No.00-004-0836)的衍射峰,表明催化剂中CuO最终被还原成Cu,α-Fe2O3被还原成Fe3O4,CuFe2O4被还原成Cu和Fe3O4。 表1列出CuO/Fe2O3-ZrO2催化剂的微观结构参数。由表1可见,随着ZrO2添加量增加,CuFe2O4的晶粒尺寸有减小的趋势,表明ZrO2阻止了CuFe2O4颗粒的团聚。α-Fe2O3和CuO的晶格应变值差别很小,可忽略不计;而CuFe2O4的晶格应变值随着ZrO2含量增加而增大,表明相对于α-Fe2O3和CuO,掺杂的ZrO2对CuFe2O4晶体的影响更大,而CuFe2O4的晶胞参数基本不变,表明ZrO2以无定形态的形式高度分散在CuFe2O4表面[7],与图1中未观察到ZrO2的特征衍射峰相符。

表 1 CuO/Fe2O3-ZrO2催化剂的微观结构参数
2.2N2物理吸附-脱附
CuO/Fe2O3-ZrO2催化剂的孔径分布和N2吸附-脱附曲线见图2。由图2可以看出,掺杂ZrO2的催化剂相比于未掺杂的催化剂,孔径分布更为集中,所有催化剂的吸附-脱附曲线均为Ⅳ型,具有明显的滞后环[8]。据文献[9]报道,介孔固体在吸附过程中经常会伴随吸附-脱附滞后现象,这种滞后现象可以归结为热力学或者是孔的空间网状作用或者是两者共同作用的结果。对于Cu/Fe-Zr0催化剂,滞后环的类型属于p型,其吸附-脱附曲线呈现三角形且有一个相对陡直的脱附支,这种孔被认为是相对均一的类槽状孔。掺杂ZrO2样品的滞后环均为H1型,吸附-脱附曲线几乎平行,被认为是近似球形的颗粒以相对均一的方式紧凑地排列在一起。同时,H1型滞后环说明催化剂的孔径分布高度均一性和灵活的孔连通性。
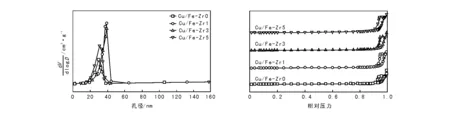
图 2 CuO/Fe2O3-ZrO2催化剂的孔径分布和N2吸附-脱附曲线Figure 2 Pore size distribution and N2 adsorption-desorption curves of CuO/Fe2O3-ZrO2 catalysts
CuO/Fe2O3-ZrO2催化剂的织构性质见表2。由表2可以看出,随着ZrO2添加量增加,催化剂的比表面积和孔容均有不同程度增大。Cu/Fe-Zr1与Cu/Fe-Zr0相比,平均孔径相同,孔容增大,表明Cu/Fe-Zr1具有较多的孔数量,因此提高了催化剂的比表面积[10],这有利于CO和水蒸汽的吸附,促进水煤气变换反应的进行。
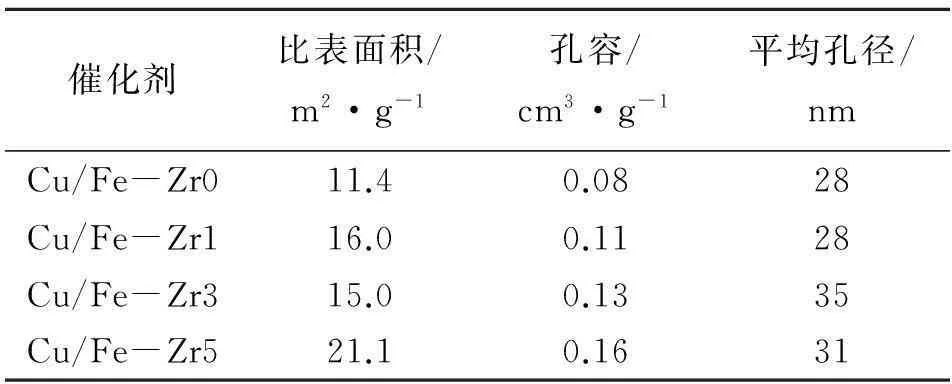
表 2 CuO/Fe2O3-ZrO2催化剂的织构性质
2.3H2-TPR
图3为CuO/Fe2O3-ZrO2催化剂的H2-TPR谱图。由图3可以看出,在(350~800) ℃,催化剂均具有对应于Fe3O4→FeO→Fe的还原过程的宽化还原峰[11-12];在低温(100~300) ℃,出现3个较为明显的还原峰,对应的还原温度分别为160 ℃、190 ℃和236 ℃。根据文献[11-13]对CuO/Fe2O3催化剂中铜物种的归属,α峰可归属为高度分散的CuO的还原,γ峰归属为α-Fe2O3的还原。Estrella M等[14]通过对CuFe2O4进行原位XRD表征,发现少量晶相的CuO在(175~250) ℃的衍射峰消失,Cu的特征衍射峰并未出现,而CuFe2O4晶格八面体位的占有率增加,表明晶相CuO中的Cu迁移进入CuFe2O4晶格中,在温度高于250 ℃时,Cu被还原出来,CuFe2O4中的CuO被还原成Cu,故β峰可归属为少量晶相的CuO和CuFe2O4的还原,为方便研究和分析,统称为CuFe2O4的还原。由图3还可以看出,掺杂了ZrO2的催化剂,β峰的还原温度向高温方向移动,说明ZrO2的加入削弱了催化剂中铜铁物种之间的协同作用,故当添加ZrO2的质量分数为5%时,部分CuFe2O4的还原峰与α-Fe2O3的还原峰重合。通过积分α和β峰的峰面积发现(见表3),随着ZrO2含量增多,CuFe2O4的H2消耗量减小,高度分散的CuO的H2消耗量增加,表明更多的铜可能是以高度分散的CuO存在于催化剂表面。添加ZrO2助剂的催化剂,其总H2消耗量呈先增后减的趋势,结合活性数据,总H2消耗量和所有催化剂活性顺序一致,为Cu/Fe-Zr1>Cu/Fe-Zr3>Cu/Fe-Zr0>Cu/Fe-Zr5,表明添加适量ZrO2,能增加催化剂中可被还原的铜物种数量,从而提高催化性能。
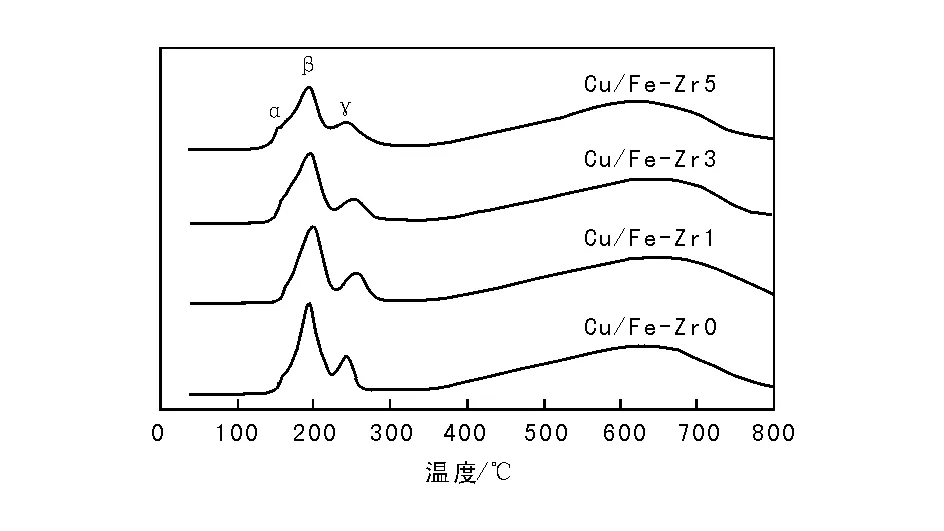
图 3 CuO/Fe2O3-ZrO2催化剂的H2-TPR谱图Figure 3 H2-TPR profiles of CuO/Fe2O3-ZrO2 catalysts
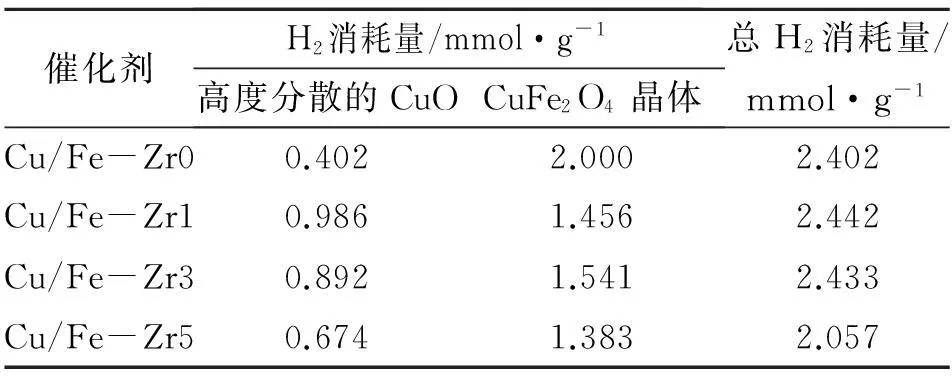
表 3 CuO/Fe2O3-ZrO2催化剂中铜物种的H2消耗量
2.4CO2-TPD
通过CO2-TPD探究CuO/Fe2O3-ZrO2催化剂的碱性位点,结果如图4所示。由图4可以看出, CuO/Fe2O3-ZrO2催化剂均在80 ℃出现一个低温脱附峰,在300 ℃出现一个高温脱附峰,分别对应于弱碱性位点上吸附的单齿型CO2和强碱性位点上吸附的二齿型的CO2[15-17]。据报道[17],在弱碱性位点上形成的单齿型碳酸盐能够在低温时分解释放出CO2和H2,产生新的活性位点,有利于H2O的解离吸附和CO活化氧化;而在强碱性位点上形成的二齿型碳酸盐,由于具有较高的热稳定性,不易分解,会覆盖催化剂的活性位点。
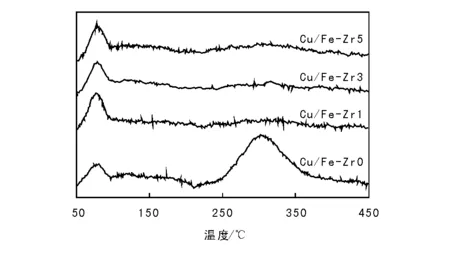
图 4 CuO/Fe2O3-ZrO2催化剂的CO2-TPD谱图Figure 4 CO2-TPD profiles of CuO/Fe2O3-ZrO2 catalysts
表4为CuO/Fe2O3-ZrO2催化剂的表面碱性位点数量。由表4可见,添加ZrO2的催化剂,强碱性位点数量明显减少,弱碱性位点数量随着ZrO2含量的增加呈先增后减的趋势,且催化剂弱碱性位点数量的变化规律与其活性顺序一致。催化剂Cu/Fe-Zr5与Cu/Fe-Zr0相比,弱碱性位点和强碱性位点的数量均减少,活性低,表明弱碱性位点比强碱性位点对催化剂的催化活性影响更大。催化剂Cu/Fe-Zr1具有最多的弱碱性位点和最少的强碱性位点,因而表现出最好的水煤气变换反应活性。
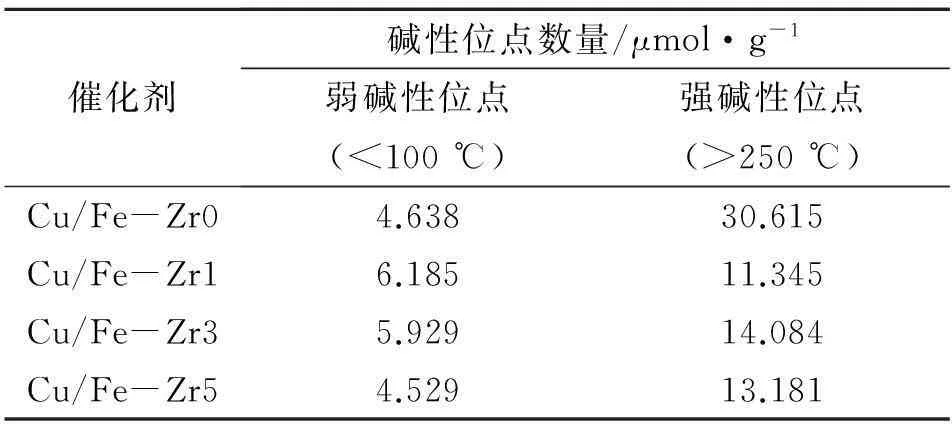
表 4 CuO/Fe2O3-ZrO2催化剂表面的碱性位点数量
2.5水煤气变换反应活性
CuO/Fe2O3-ZrO2催化剂的水煤气变换反应活性如图5所示。由图5可见,在(200 ~400) ℃,催化剂的整体活性变化规律一致,均为先升高后减弱。催化剂活性顺序依次为:Cu/Fe-Zr1>Cu/Fe-Zr3>Cu/Fe-Zr0>Cu/Fe-Zr5。Cu/Fe-Zr1呈现出最好的变换活性。可能是催化剂Cu/Fe-Zr1平均孔径小,比表面积较大,孔分布均匀且孔的数量多,有利于CO和水蒸汽的吸附,进而促进变换反应的进行。催化剂Cu/Fe-Zr1和Cu/Fe-Zr3的弱碱性位点的数量均高于Cu/Fe-Zr0,可以提供更多的活性位点,有利于提高变换反应活性。虽然ZrO2的引入减弱了催化剂中铜铁物种之间的协同作用,但通过积分H2消耗量发现,铜物种的H2消耗量顺序与催化剂活性顺序一致,表明提高可被还原的铜物种数量有利于增加活性铜的数量,提高水煤气变换催化剂活性。由图5还可以看出,相比第一轮测试,催化剂活性均有不同程度降低,这可能是催化剂在变换反应后得到的铜微晶聚集导致催化剂活性下降[18]。催化剂活性规律基本与第一轮测试一致,但不同ZrO2添加量的催化剂活性差异更加显著。相对其他ZrO2添加量的催化剂,添加1%ZrO2的Cu/Fe-Zr1催化剂具有较好的耐热稳定性。

图 5 CuO/Fe2O3-ZrO2催化剂的水煤气变换活性Figure 5 Activity of CuO/Fe2O3-ZrO2 catalysts in water gas shift reaction(A) 第一轮活性测试;(B) 在400 ℃保持10 h后降温至200 ℃进行第二轮活性测试
3结论
(1) 采用分步沉淀法合成不同ZrO2含量的系列CuO/Fe2O3-ZrO2催化剂,随着ZrO2含量增加,催化剂活性先升高后下降。当添加ZrO2的质量分数为1%时,催化剂呈现较好的水煤气变换反应活性和耐热稳定性。
(2) 随着添加的ZrO2含量增加,催化剂的孔容和比表面积增大,添加ZrO2质量分数1%的CuO/Fe2O3-ZrO2催化剂孔分布更均匀且孔的数量多。
(3) ZrO2的添加不利于催化剂中CuFe2O4的形成,削弱了CuFe2O4中铜铁物种之间的协同作用;添加质量分数1%的ZrO2,增加了催化剂中可被还原的铜物种数量,有利于增加活性中心的铜数量,提高水煤气变换反应活性。
(4) ZrO2的引入有利于减少强碱性位点的数量,减少活性位点被覆盖,添加ZrO2的质量分数为1%的CuO/Fe2O3-ZrO2催化剂具有较多的弱碱性位点和较少的强碱性位点,有利于催化剂中增加新的活性位点,同时抑制二齿型碳酸盐物种的形成,有利于H2O的解离吸附和CO的活化氧化,故具有较好的水煤气变换反应活性和稳定性。
参考文献:
[1]Veziroglu T N,ahin S.21st Century′s energy:hydrogen energy system[J].Energy Conversion and Management,2008,49(7):1820-1831.
[2]Spivey J J.Catalysis in the development of clean energy technologies[J].Catalysis Today,2005,100(1/2):171-180.
[3]周桂林,蒋毅,邱发礼.非贵金属催化剂用于CO选择性氧化脱除的研究[J].燃料化学学报,2011,39(4):293-299.
Zhou Guilin,Jiang Yi,Qiu Fali.Preferential oxidation of CO in H2-rich stream on non-noble metal catalyst[J].Journal of Fuel Chemistry and Technology,2011,39(4):293-299.
[4]Djerad S,Geiger B,Sehott F J P,et a.synthesis of nanosized ZrO2and its use as catalyst support in SCR[J].Catalysis Communications,2009,10(7):1103-1106.
[5]Chen C Q,Ruan C X,Zhan Y Y,et al.The significant role of oxygen vacancy in Cu/ZrO2catalyst for enhancing water-gas-shift performance[J].International Journal of Hydrogen Energy,2014,39(1):317-324.
[6]郑云弟,林性贻,郑起,等.ZrO2对Cu/CeO2-ZrO2水煤气变换催化剂结构、性能的影响[J].中国稀土学报,2005,23(6):679-683.
Zheng Yundi,Lin Xingyi,Zheng Qi,et al.Effects of ZrO2content on structure and properties of Cu/CeO2-ZrO2catalysts for water-gas shift reaction[J].Journal of the Chinese Rare Earth Society,2005,23(6):679-683.
[7]Li L,Zhan Y Y,Zheng Q,et al.Water-gas shift reaction over aluminum promoted Cu/CeO2nanocatalysts characterized by XRD,BET,TPR and cyclic voltammetry(CV)[J].Catalysis Letters,2007,118(1/2):91-97.
[8]Sing K S W,Everett D H,Haul R A W,et al.Reporting physisorption data for gas/solid system[J].Pure & Applied Chemistry,1985,57(4):603-619.
[9]Kruk M,Jaroniec M.Gas adsorption characterization of ordered organic-inorganic nanocomposite materials[J].Chemistry of Materials,2001,13(10):3169-3183.
[10]Ma L,Gong B,Tran T,et al.Cr2O3promoted skeletal Cu catalysts for the reactions of methanol steam reforming and water gas shift[J].Catalysis Today,2000,63:499-505.
[11]Lin X Y,Zhang Y,Yin L,et al.Characterization and catalytic performance of copper-based WGS catalysts derived from copper ferrite [J].International Journal of Hydrogen Energy,2014,39(12):6424-6432.
[12]Reddy G K,Gunasekera K,Boolchand P,et al.High temperature water gas shift reaction over nanocrystalline[J].The Journal of Physical Chemistry C,2011,115:7586-7595.
[13]Lin X Y,Li R L,Zhang Y,et al.The role of surface copper species in Cu-Fe composite oxide catalysts for the water gas shift reaction[J].International Journal of Hydrogen Energy,2015,40(4):1735-1741.
[14]Estrella M,Barrio L,Zhou G,et al.In situ characterization of CuFe2O4and Cu/Fe3O4water-gas shift catalysts[J].Journal of Physical Chemistry C,2009,113:14411-14417.
[15]Lin X Y,Chen C Q,Ma J T,et al.Promotion effect of Nb5+for Cu/CeO2water-gas shift reaction catalyst by generating mobile electronic carriers[J].International Journal of Hydrogen Energy,2013,38(27):11847-11852.
[16]Sagata K,Imazu N,Yahiro H.Study on factors controlling catalytic activity for low-temperature water-gas-shift reaction on Cu-based catalysts[J].Catalysis Today,2013,201:145-150.
[17]Li L,Song L,Wang H D,et al.Water-gas shift reaction over CuO/CeO2catalysts:effect of CeO2supports previously prepared by precipitation with different precipitants[J].International Journal of Hydrogen Energy,2011,36(15):8839-8849.
[18]TanakaY,Utaka T,Kikuchia R,et al.Water gas shift reaction over Cu-based mixed oxides for CO removal from the reformed fuels[J].Applied Catalysis A:General,2003,242(2):287-295.
Catalytic performance and characterization of ZrO2-modified CuO/Fe2O3catalysts in water-gas shift reaction
FanYanyu,MaJunchi,YinLing,LinXingyi*
(National Engineering Research Center of Chemical Fertilizer Catalyst,Fuzhou University, Fuzhou 350002, Fujian, China)
Abstract:ZrO2 is an ideal catalyst material owing to its peculiar characteristics,such as high melting point,weak acidity and basicity,redox properties,with p-type semiconductor properties and easy to produce oxygen hole.CuO/Fe2O3 catalysts modified with different loadings of ZrO2(0-5wt%) were prepared by the stepwise precipitation method.The as-prepared catalysts were characterized by X-ray diffraction,N2 physical adsorption-desorption,H2 temperature-programmed reduction,and CO2 temperature-programmed desorption.The effects of ZrO2 on the catalytic performance of CuO/Fe2O3 catalysts for water-gas shift reaction were investigated.The results showed that moderate ZrO2(1wt%) weakened a synergistic interaction between the copper and iron species in CuFe2O4,leading to the increase of reducible copper species of CuO/Fe2O3 catalysts,and the formation of more weak alkaline site that was beneficial to the increase of active sites of copper,so CuO/Fe2O3 catalyst with 1wt% ZrO2 possessed higher activity and better thermal stability in water gas shift reaction.
Key words:catalytic chemistry; ZrO2 modification; CuO/Fe2O3 catalyst; water-gas shift reaction; stepwise precipitation method
中图分类号:O643.36;TQ426.94
文献标识码:A
文章编号:1008-1143(2016)01-0034-07
doi:10.3969/j.issn.1008-1143.2016.01.006 10.3969/j.issn.1008-1143.2016.01.006
作者简介:范言语,1988年生,男,福建省三明市人,在读硕士研究生,研究方向为能源与环境催化。
收稿日期:2015-09-14基金项目:国家自然科学基金(21346007)资助项目
催化剂制备与研究
通讯联系人:林性贻,副研究员。
