TIGAR调节肺癌细胞的增殖和侵袭能力研究
2016-04-25杨玲麟
赵 明,冯 婧,刘 勇,杨玲麟
(泸州医学院附属医院肿瘤科,四川泸州 646000)
·论著·
TIGAR调节肺癌细胞的增殖和侵袭能力研究
赵明,冯婧,刘勇,杨玲麟△
(泸州医学院附属医院肿瘤科,四川泸州 646000)
摘要:目的探讨P53下游基因TIGAR在肺癌细胞A549增殖、迁移及侵袭中的作用。方法采用siRNA技术在A549细胞中干扰TIGAR的表达,细胞计数试剂盒 ( CCK-8)检测细胞增殖,小室法检测细胞迁移,肿瘤细胞侵袭实验检测细胞侵袭,免疫印迹杂交检测相关蛋白水平变化。结果在A549细胞中成功干扰TIGAR后,细胞增殖显著降低(P<0.05),细胞迁移和侵袭能力显著减弱,侵袭相关蛋白基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)的表达量均下调。结论TIGAR促进肺癌细胞A549的增殖,并促进细胞的迁移和侵袭能力。
关键词:TIGAR;A549;增殖;迁移;侵袭
TIGAR是 2006 年发现的p53下游的一个直接靶基因[1],在许多肿瘤中均呈现出异常表达。在乳腺癌细胞系(MCF-7)细胞中,TIGAR通过调控细胞周期相关蛋白RB的去磷酸化来影响RB-E2F1的结合能力,从而调节细胞增殖[2]。TIGAR 的表达在肠上皮再生,小肠及结肠肿瘤的发生和发展中也起着关键作用,在 TIGAR表达缺失的小鼠模型中肠上皮的增生能力明显降低,小肠腺瘤的增殖能力也明显下降[3]。因此,TIGAR 作为一个潜在的具有应用前景的肿瘤治疗靶点日益受到研究者的关注。本文选取肺癌细胞A549作为研究对象,探讨干扰TIGAR对肺癌细胞增殖的影响,以及细胞迁移和侵袭能力的变化。
1材料与方法
1.1细胞来源肺癌细胞A549,购买于中国科学院细胞库。
1.2仪器与试剂蛋白电泳及转膜装置购买于Bio-Rad(百乐公司);lipofectimine 2000(脂质体)阳离子脂质体购买于美国Invitrogen公司;CCK-8购买于碧云天公司;transwell小室、基质胶matrigel购买于美国BD Bioscience公司;抗体TIGAR购买于英国abcam公司,MMP-2抗体、MMP-9抗体购买于武汉三鹰公司,GAPDH抗体购买于美国Cell signaling technology公司。
1.3方法
1.3.1细胞培养与转染人肺癌细胞A549培养于含10%胎牛血清的RPMI1640,培养条件为5%CO2,37 ℃恒温培养箱。siRNA由上海GeneChem公司合成。Si-TIGAR序列为GCC AGC TTT ACT GGA GAA CTT,Si-Control序列为TTA CCG AGA CCG TAC GTA T。细胞分两组,按照说明书分别转染Si-TIGAR和Si-Control,5 h后换液继续培养。
1.3.2CCK-8接种细胞于96孔板,转染48 h后加入CCK-8 10 μL于每孔,37 ℃继续培养2 h后,酶标仪测定450 nm吸光值。
1.3.3小室法和肿瘤细胞侵袭实验对于小室法无血清培养基重悬细胞至3×105/mL,接种100 μL于transwell小室上室,下室加入600 μL完全培养基,培养20 h后,棉球擦去上室细胞,结晶紫染色,显微镜观察拍照。对于肿瘤细胞侵袭实验,上室需提前加入50 μL基质胶matrigel,48 h后棉球擦去上室细胞,结晶紫染色,显微镜观察拍照。
1.3.4免疫印迹杂交转染后72 h收集细胞,提取总蛋白,10%聚丙烯酰胺凝胶中电泳,蛋白转印至PVDF纤维素膜上后,3%脱脂牛奶封闭1 h后,加入一抗,4 ℃摇床过夜,TBST洗涤后,二抗孵育1 h,洗脱液TBST洗涤后显色试剂ECL化学发光检测。
1.4统计学处理采用SPSS10.0统计软件进行数据处理及统计分析,组间比较使用配对t检验,P<0.05为差异有统计学意义。
2结果
2.1干扰TIGAR效率检测转染Si-TIGAR和Si-Control 72 h后,免疫印迹杂交检测干扰组TIGAR表达量显著低于对照组,具有较高的干扰效率,见图1。

图1 TIGAR表达水平
2.2干扰TIGAR后细胞增殖检测转染48 h后,加入CCK-8检测增殖发现,干扰组细胞数量显著低于对照组,干扰TIGAR后,细胞增殖速率降低,见图2。

图2 细胞增殖检测
2.3干扰TIGAR后细胞迁移和侵袭检测接种后20 h,结晶紫染色迁移组细胞,观察到干扰组细胞比对照组显著减少,证明细胞迁移能力降低;接种后48 h,结晶紫染色侵袭组细胞,观察到干扰组细胞比对照组显著减少,证明细胞侵袭能力降低,见图3。

图3 细胞迁移、侵袭检测
2.4干扰TIGAR后侵袭相关蛋白检测免疫印迹杂交检测侵袭相关蛋白MMP-2,MMP-9表达,发现在干扰组中表达量显著低于对照组,见图4。
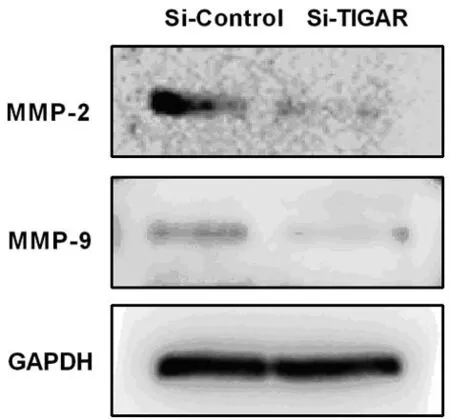
图4 MMP-2,MMP-9表达量
3讨论
肿瘤的转移是一个极其复杂的过程,首先需要突破细胞外基质(ECM)的屏障才能向周围组织侵袭,进入循环系统。基质金属蛋白酶(MMPs)是降解ECM最重要的蛋白酶。已有文献报道在食管癌、胃癌、结肠癌等肿瘤中MMPs均呈现出过表达。因此,研究MMPs在肺癌中的表达及其调控机制具有重要意义[4-9]。
TIGAR是P53下游的靶基因,在TIGAR表达缺失的小鼠结肠肿瘤模型中,结肠肿瘤细胞转移到肺等器官的能力降低[10-12],证明了TIGAR在肿瘤转移的过程中起到非常重要的作用[3]。通过此研究,发现通过siRNA技术干扰TIGAR可降低MMP-2、MMP-9的表达[13-14],从而减弱肺癌细胞的迁移和侵袭能力,加深了对于肺癌转移分子机制的认识,具有重要的指导意义。
参考文献
[1]Karim B,Atsushi T,Mary A,et al.TIGAR,a p53-Inducible Regulator of Glycolysis and Apoptosis[J].Cell,2006,14(126):107-120.
[2]Madan E,Gogna R,Kuppusamy P,et al.TIGAR induces p53-mediated cell-cycle arrest by regulation of RB-E2F1 complex[J].British J Cancer,2012,107(2):516-526.
[3]Cheung EC,Athineos D,Lee P,et al.TIGAR is required for efficient intestinal regeneration and tumorigenesis[J].Dev Cell,2013,25(5):463-477.
[4]薛洋,周清华,张尚福,等.MMP-2、MMP-9在肺癌中的表达及其与肺癌转移和预后关系的研究[J].华西医学,2008,23(2):225-227.
[5]曾益新.肿瘤学[M].北京:人民卫生出版社,1999.
[6]周清华.肺癌基础研究与临床治疗进展[M].北京:科学出版社,1999.
[7]Christina W,Steinbach JP,Johannes R,et al.Tp53-induced glycolysis and apoptosis regulator (TIGAR) protects glioma cells from starvation-induced cell death by up-regulating respiration and improving cellular redox homeostasis[J].J Biolog Chem,2012,287(40):33436-33446.
[8]Zhang M,Chai YD,Brumbaugh J,et al.Oral cancer cells may rewire alternative metabolic pathways to survive from siRNA silencing of metabolic enzymes[J].Bmc Cancer,2014,14(1):1736-1742.
[9]Zhang H,Gu C,Yu J,et al.Radiosensitization of glioma cells by TP53-induced glycolysis and apoptosis regulator knockdown is dependent on thioredoxin-1 nuclear translocation[J].Free Rad Bio Med,2014,69(7):239-248.
[10]Wong EY,Wong SC,Chan CM,et al.TP53-induced glycolysis and apoptosis regulator promotes proliferation and invasiveness of nasopharyngeal carcinoma cells[J].Oncology Letters,2015,9(2):569-574.
[11]Peia-Rico MA,Calvo-Vidal MN,Villalonga-Planells R,et al.TP53 induced glycolysis and apoptosis regulator (TIGAR) knockdown results in radiosensitization of glioma cells[J].Radioth Onc,2011,101(1):132-139.
[12]Sarachana T,Zhou R,Chen G,et al.Investigation of post-transcriptional gene regulatory networks associated with autism spectrum disorders by microRNA expression profiling of lymphoblastoid cell lines[J].Genome Medicine,2010,2(2):1-18.
[13]Li Y,Michio K,Donald K.Inhibition of the MUC1-C oncoprotein induces multiple myeloma cell death by down-regulating TIGAR expression and depleting NADPHs[J].Blood,2012,119(3):810-816.
[14]Hasegawa M,Sinha RK,Kumar M,et al.Intracellular Targeting of the Oncogenic MUC1-C Protein with a Novel GO-203 Nanoparticle Formulation[J].Clin Cancer Res,2015,21(10):2338-2347.
TIGAR promotes proliferation and invasiveness of lung cancer cells
ZhaoMing,FengJing,LiuYong,YangLinglin△
(DepartmentofOncology,theAffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
Abstract:ObjectiveTo study the role of P53 target gene TIGAR on proliferation,migration and invasion of lung cancer cells.MethodssiRNA was introduced to knock down TIGAR in A549 cells.Proliferation was detected by CCK-8.The ability of migration and invasion was measured by and,respectively.was used to evaluate the expression levels of related proteins.ResultsKnockdown of TIGAR reduced the proliferation rate(P<0.05),inhibited the ability of migration and invasion,decreased expression levels of MMP-2 and MMP-9.ConclusionTIGAR promotes proliferation,migration and invasiveness of lung cancer cells.
Key words:TIGAR;A549;proliferation;migration;invasion
(收稿日期:2015-11-26)
DOI:10.3969/j.issn.1673-4130.2016.06.014
文献标识码:A
文章编号:1673-4130(2016)06-0754-02
作者简介:赵明,男,检验技师,主要从事临床检验研究。(△)通讯作者,E-mail:yangllluyi@126.com。
