抑制性差减杂交技术分离白血病多药耐药基因
2016-04-25王楠,潘喆,袁宏
王 楠,潘 喆,袁 宏
(大连医科大学附属第一医院:1.检验科;2.病理科,辽宁大连 116023)
·论著·
抑制性差减杂交技术分离白血病多药耐药基因
王楠1,潘喆2△,袁宏1
(大连医科大学附属第一医院:1.检验科;2.病理科,辽宁大连 116023)
摘要:目的分离及鉴定与白血病多药耐药性相关的差异表达基因。方法采用抑制性差减杂交(SSH)技术分离非耐药细胞株K562与耐药细胞株K562/DOX差异表达基因。提取总RNA,逆转录合成cDNA,经限制性内切酶RsaⅠ酶切后,分别与不同的接头(adopter1和adopter2R)连接;连接产物插入pMD19-T载体后转入大肠埃希菌中,构建cDNA差减文库;挑取阳性克隆提取质粒进行测序及同源序列分析,确定差异表达基因。结果筛选获得220个差异表达基因,包括血红蛋白、核糖体和线粒体等相关基因,以及热休克因子结合蛋白(HSPB1)基因等其他基因。结论采用SSH技术及分子克隆技术可构建耐药及非耐药肿瘤细胞株差异表达基因的差减cDNA文库,能够为进一步筛选、克隆肿瘤细胞多药耐药性相关差异表达基因奠定基础。
关键词:白血病;多药耐药;抑制性差减杂交;差异表达基因
白血病细胞多药耐药是导致化疗效果减低或治疗无效的主要原因,而耐药基因过度表达是肿瘤细胞形成耐药性的基础。研究白血病耐药细胞基因表达的差异,可获知细胞出现表型差异的原因,提供复杂生命过程的基本信息[1]。本研究采用抑制性差减杂交(SSH)技术构建非耐药白血病细胞株K562与耐药细胞株K562/DOX差异表达基因的cDNA文库[2],为筛选白血病耐药基因,揭示白血病多药耐药的形成机制奠定基础。
1材料与方法
1.1细胞株白血病细胞株K562由大连医科大学血液检验研究所惠赠,耐药细胞株K562/DOX购自天津血液病研究所。所有细胞均按常规方法培养于含10%小牛血清的RPMI1640培养基中,5%CO2、37 ℃培养箱中传代培养,1~2 d换液1次使细胞维持对数生长。K562/DOX细胞株定期采用阿霉素冲击以维持其耐药性(阿霉素应用剂量为10 μg/mL,1小时/次,1次/周)。停药2周后进行后续实验。
1.2试剂SMARTer cDNA合成试剂盒(SMARTer cDNA Synthesis Kit,批号:634925)、SSH试剂盒(PCR-Select cDNA Subtraction试剂盒,批号:637401)、DNA片段纯化试剂盒(DNA Fragment Purification Kit Ver.2.0,批号:DV807)、DNA连接试剂盒(DNA Ligation Kit,批号:D6020A)、pMD19-T载体(pMD19-T Vector,批号:D102A)购自宝生物工程(大连)有限公司。
1.3方法
1.3.1cDNA合成及确认最佳PCR产物以2 μL细胞总RNA作为模板,逆转录合成cDNA,PCR反应条件:72 ℃ 3 min,42 ℃ 2 min。为获得较高浓度产物和确认最佳PCR产物,进行一系列PCR扩增,以电泳结果确认最佳产物。PCR反应条件:95 ℃ 1 min,95 ℃ 15 s,65 ℃ 30 s,68 ℃ 3 min,循环次数分别为15、18、21、24、27次。采用1%琼脂糖凝胶对PCR产物进行电泳,根据电泳结果确认最佳循环次数。对PCR产物进行纯化处理,电泳确认纯化效果。
1.3.2cDNA酶切及确认采用限制性内切酶RsaⅠ对K562细胞及K562/DOX细胞cDNA进行酶切,反应体系为最佳产物cDNA 300 μL,10×RsaⅠ酶切缓冲液36 μL,RsaⅠ 1.5 μL,反应条件为37 ℃ 3 h。采用1%琼脂糖凝胶对10 μL未酶切的cDNA和10 μL RsaⅠ酶切后的cDNA进行电泳,同时加入8 μL 乙二胺四乙酸/糖原混合物终止反应,2%琼脂糖凝胶电泳确认产物。
1.3.3连接反应以人骨骼肌细胞DNA作为对照组(Control组),将2 μL DNA加入38 μL dH2O中,DNA终浓度为150 ng/mL。以K562/DOX细胞DNA作为检测组(Tester组),取RsaⅠ酶切后的cDNA产物进行5倍稀释。根据接头(adaptor)的差异分为4个亚组,分别为K562/DOX Tester1-1组、K562/DOX Tester1-2组、Control Tester1-1组和Control Tester1-2组。为检测连接是否正常,加入1 μL 20 乙二胺四乙酸/糖原混合物终止反应,72 ℃预热5 min,反应体系为cDNA 2 μL,T4 DNA连接酶1 μL,adaptor1/adaptor2R 2 μL;反应条件为94 ℃ 30 s,65 ℃ 30 s,68 ℃ 2.5 min,共25个循环,电泳确认反应结果。
1.3.4差减杂交反应将RsaⅠ酶切处理的cDNA分别与连接产物进行第1轮杂交;反应条件:98 ℃ 90 s,68 ℃ 8 h。将第1轮杂交产物混合进行第2轮杂交;反应条件:98 ℃ 90 s,68 ℃过夜。
1.3.5PCR扩增反应第1次PCR扩增反应体系为杂交产物/未杂交产物/Control杂交产物/阴性对照品各1 μL,10×含Mg2+的AdvantageTMPCR缓冲液2.5 μL,50×dNTP混合物(每种dNTP浓度为10 mmol/L)0.5 μL,50×AdvantageTM聚合酶混合液(2.5 U/μL)0.5 μL,PCR引物1(10 μmol/L)1 μL;反应条件:75 ℃ 5 min,94 ℃ 30 s,66 ℃ 30 s,72 ℃ 90 s,共27个循环,电泳确认PCR产物。为富集PCR产物,取1 μL稀释后的第1次PCR反应产物进行第2次PCR反应。
1.3.6阳性克隆筛选与确认采用DNA片段纯化试剂盒精制第2次PCR反应产物,命名为CTD809 PCR,使用DNA连接试剂盒对CTD809 PCR与pMD19-T 载体进行连接;连接产物经热转化大肠埃希菌后涂布平板,37 ℃培养过夜;挑选单克隆菌落筛选阳性克隆;提取阳性克隆菌落质粒,由宝生物工程(大连)有限公司进行测序;采用Gene Bank数据库对测序结果进行比对分析,确认差减杂交文库是否构建成功。
2结果
2.1cDNA合成及确认最佳PCR产物对循环次数分别为15、18、21、24、27次的反应产物各5 μL进行1%琼脂糖凝胶电泳(见图1),确认最佳循环次数为15次。

M:1 Kb DNA Ladder分子标记物;1~5:K562细胞cDNA合成产物;6~10:K562/DOX细胞cDNA合成产物;11~15:小鼠cDNA合成产物。
图1PCR反应产物电泳结果
2.2cDNA酶切及确认采用限制性内切酶RsaⅠ对cDNA产物进行酶切,产生末端平头的片段。将未酶切和酶切的产物各10 μL进行2%琼脂糖凝胶电泳(见图2)。

M:1 Kb DNA Ladder分子标记物;1:K562细胞cDNA未酶切产物;2:K562细胞cDNA RsaⅠ酶切产物;3:K562/DOX细胞cDNA未酶切产物;4:K562/DOX细胞cDNA RsaⅠ酶切产物;5:小鼠cDNA未酶切产物;6:小鼠cDNA RsaⅠ酶切产物。
图2RsaⅠ酶切产物电泳结果
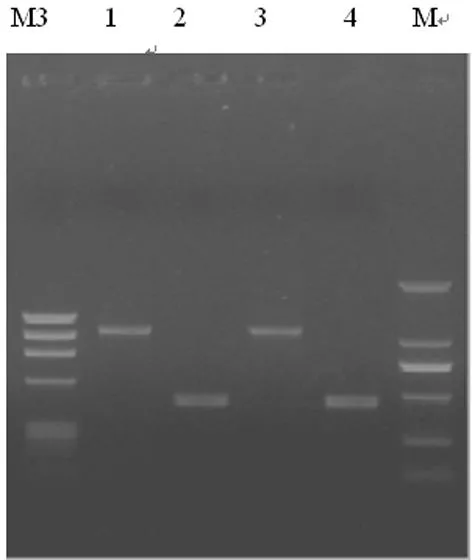
M3:ФX174 HaeⅢ酶切产物;1:Tester1-1 PCR产物(小鼠);2:G3PDH 3′Primer PCR产物(小鼠);3:Tester1-2 PCR产物(小鼠);4:G3PDH 5′Primer PCR产物(小鼠);M:DL2000 DNA分子标记物。
图3连接反应PCR产物电泳结果

M3:ФX174 HaeⅢ酶切产物;5:Tester1-1 PCR产物(K562/DOX细胞);6:G3PDH 3′Primer PCR产物(K562/DOX细胞);7:Tester1-2 PCR产物(K562/DOX细胞);8:G3PDH 5′Primer PCR产物(K562/DOX细胞);M:DL2000 DNA分子标记物。
图4检测反应PCR产物电泳结果
2.3连接反应Control组和检测组标本分别连接不同的cDNA adaptor(即adaptor1和adaptor2R)。adaptor的末端无磷酸基团,仅有adaptor的1条链与cDNA 5′末端相连,adaptor1和adaptor2R具有不同的序列,因此当残留末端被补平后,可同时与2个不同的PCR引物进行退火连接反应。为检测连接效率,将产物各5 μL进行1%琼脂糖凝胶电泳(见图3、4)。电泳结果表明连接效率大于25%,符合后续实验要求。
2.4PCR扩增在第1次PCR扩增中,两端连接有不同adaptor的差异表达序列能够进行指数扩增,仅有一端连接adaptor或两端连接同一adaptor形成发卡结构时,只能进行线性扩增,没有引物结合位点则不能进行扩增。第1次PCR产物琼脂糖凝胶电泳结果(见图5)显示,Control组与Tester组杂交PCR产物大小分别为720、900 bp。第1次PCR扩增产物丰度低,为了富集产物进行第2次PCR扩增产物,扩增产物电泳结果(见图6)显示产物丰度明显增加,阳性对照扩增产物条带明显,阴性对照无扩增产物。

M:ФX174 HaeⅢ酶切产物;1:Control组PCR产物(杂交);2:Control组PCR产物(未杂交);3:Control组PCR产物(阳性对照);4:Control组PCR产物(阴性对照);5:Tester组PCR产物(杂交);6:Tester组PCR产物(未杂交);7:Tester组PCR产物(阳性对照);8:Tester组PCR产物(阴性对照)。
图5第1次PCR产物电泳结果

M:ФX174 HaeⅢ酶切产物;1:Control组PCR产物(杂交);2:Control组PCR产物(未杂交);3:Control组PCR产物(阳性对照);4:Control组PCR产物(阴性对照);5:Tester组PCR产物(杂交);6:Tester组PCR产物(未杂交);7:Tester组PCR产物(阳性对照);8:Tester组PCR产物(阴性对照)。
图6第2次PCR产物电泳结果
2.5阳性克隆筛选及确认挑选24个单克隆菌落进行阳性克隆筛选,质粒测序结果显示,在15个具有插入片段的阳性克隆中共有220个差异基因。经Gene Bank数据库比对分析,选出覆盖率90%和相似度98%以上的差异基因122个,舍去98个覆盖率和相似度较小的差异基因。在选出的122个差异基因中,包括34个线粒体相关基因、10个甘油三磷酸脱氢酶基因、4个核糖体基因、3个支原体基因、7个血红蛋白(HBE1)基因、1个凝血因子Ⅷ基因、1个热休克因子结合蛋白1(HSBP1)基因和62个未知基因。
3讨论
肿瘤细胞耐药基因的存在不但影响化疗效果,也影响患者预后。耐药基因的表达是肿瘤细胞产生多药耐药性的分子基础。因此,鉴定耐药细胞和非耐药细胞间的差异基因是阐明耐药性发生机制的重要手段。本研究选用遗传背景相同的非耐药K562细胞与K562/DOX耐药细胞,经SSH筛选得到相关差异基因,部分差异基因具有生物学功能,在肿瘤细胞产生耐药性方面具有更大的作用。
较高浓度水平的cDNA是顺利完成SSH实验的必备条件,而本研究中的限制性酶切产物电泳结果显示,逆转录合成的K562/DOX和K562细胞cDNA水平无法满足SSH实验的要求。因此,本研究采用PCR扩增富集的方法使cDNA水平达到300 ng/μL。此外,本研究将cDNA合成条件分别设定为15、18、21、24、27次循环,合成产物电泳结果显示15次循环得到的cDNA产物浓度水平最高,为最佳循环次数。而在选择阳性对照时,最初选择了可应用于SSH实验的小鼠总RNA,但PCRC产物电泳图显示实验结果不理想,推测原因可能是受到种系同源性因素的影响。因此,本研究选用人骨骼肌细胞cDNA作为阳性对照。
在应用SSH技术后,本研究选择24个单克隆菌落进行质粒测序,在15个有插入片段的阳性克隆中共获得220个差异基因。经Gene Bank比对分析,选出覆盖率为90%和相似度为98%以上差异基因122个,其中线粒体相关基因共34个,包括22个线粒体基因、11个人类离子细胞内通道蛋白(CLIC2)基因、1个电位依赖性离子通道3(VDAC3)基因。线粒体基因在多药耐药肿瘤细胞和非耐药肿瘤细胞间呈明显的差异表达,提示线粒体基因的表达可能与肿瘤细胞产生多药耐药性密切相关。
电位依赖性离子通道(VDAC)也称线粒体穿孔蛋白,在线粒体外膜中表达水平较高,VDAC3是VDAC的3种异构体之一。线粒体可感受细胞能量代谢水平的变化,进而影响核基因的表达[3]。有研究证实,离子通道尤其是VDAC参与了肿瘤细胞的演化,在调节细胞周期方面具有重要作用[4]。因此,VDAC是近年来外源化学物所致细胞凋亡机制研究领域的热点之一。VDAC基因表达水平增高或降低均影响线粒体功能,与细胞生存及凋亡密切相关[5]。肿瘤细胞膜上也分布着不同类型的离子通道,并与肿瘤的发生、发展密切相关,其中VDAC基因的表达与肿瘤的形成有关,但与白血病细胞多药耐药性的相关性研究未见报道。本研究证实VDAC3基因可能在白血病细胞产生多药耐药性方面具有一定的作用,但具体作用机制有待进一步研究证实。
核糖体蛋白S4-X基因亦为耐药与非耐药白血病细胞差异基因之一。核糖体参与基因的复制、转录,具有调控机体发育等功能,与正常细胞的恶性转化及肿瘤细胞产生耐药性密切相关。本研究也筛选出具有差异表达的3个支原体基因,分别是支原体基因JER、M64、PG18。支原体基因的高表达可能引起肿瘤细胞生物学行为的改变,提示支原体基因的异常表达与肿瘤的发生有潜在的相关性。
此外,10个甘油三磷酸脱氢酶基因、1个凝血因子Ⅷ基因、7个HBE1基因、1个HSBP1基因和62个未知基因也是差异表达基因,可能在白血病细胞产生耐药性方面具有一定的作用。HSBP1可结合热休克蛋白70(HSP70)基因启动子,减弱或阻止HSP70基因的转录。HSBP1是线粒体的“分子伴侣”之一,但与白血病细胞多药耐药性的相关性研究未见报道。本研究结果显示,HSBP1基因与VDAC3基因都可能参与了白血病多药耐药的形成,具体作用机制有待进一步研究证实。笔者推测,HSBP1基因的差异表达可能是调控VDAC基因参与肿瘤细胞产生耐药性的关键因素。VDAC3基因启动子区可能含有热休克元件(HSE),HSBP1通过与HSE的结合调控VDAC基因的表达([6-7])。
综上所述,本研究采用SSH技术成功构建了K562/DOX细胞与K562细胞的差异表达基因,且多数差异表达基因为线粒体相关基因,提示线粒体基因的表达在白血病细胞产生耐药性方面具有关键作用。本研究也筛选出一些罕见报道的基因,如HSBP1基因。这些具有调控作用的基因在白血病细胞产生耐药性中的作用更应值得注意,其与线粒体相关基因的关系值得深入研究和分析。
参考文献
[1]Luzi C,Brisdelli F,Cinque B,et al.Differential sensitivity to resveratrol induced apoptosis of human chronic myeloid(K562) and acute lymphoblastic(HSB2)leukemia cells[J].Biochem Pharmacol,2004,68(16):2021-2030.
[2]Zheng GH,Fu JR,Xu YH,et al.Screening and cloning of multi-drug resistant genes in HL-60/MDR cells[J].Leuk Res,2009,33(8):1120-1123.
[3]Shoshan-Barmatz V,De Pinto V,Zweckstetter M,et al.VDAC,a multi-functional mitochondrial protein regulating cell life and death[J].Mol Aspects Med,2010,31(3):227-285.
[4]Shoshan-Barmatz V,Israelson A,Brdiczka D,et al.The voltage-dependent anion channel(VDAC):function in intracellular signaling,cell life and cell death[J].Curr Pharm Des,2006,12(18):2249-2270.
[5]Yuan S,Fu Y,Wang X,et al.Voltage-dependent anion channel 1 is involved in endostatin-induced endothelial cell apoptosis[J].FASEB J,2008,22(8):2809-2820.
[6]Dong XY,Pang XW,Yu ST,et al.Identification of genes differentially expressed in human hepatocellular carcinoma by a modified suppression subtractive hybridization method[J].Int J Cancer,2004,112(2):239-248.
[7]Huang Y,Cai X,Zou Z,et al.Molecular cloning,characterization and expression analysis of three heat shock responsive genes from Haliotis diversicolor[J].Fish Shellfish Immunol,2014,36(2):590-599.
Multidrug resistance associated genes of leukemia separated by suppression subtractive hybridization
WangNan1,PanZhe2△,YuanHong1
(1.DepartmentofClinicalLaboratory;2.DepartmentofPathology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian,Liaoning116023,China)
Abstract:ObjectiveTo isolate and identify differential expression genes associated with multidrug resistance of leukemia.MethodsDifferential expression genes between leukemia cell line K562 and resistant cell lines K562/DOX were isolated by using suppression subtractive hybridization(SSH) technique.Total RNA were extracted.cDNA were synthesized and digested by restriction enzyme RsaⅠ,then connected with adopter1 and adopter2R,and linked with pMD19-T vector.Constructed vectors were transferred into E.coli.Subtracted cDNA library was constructed,and the positive clones were screened according to base sequences and homologous sequences.The differential expression genes were indentified by comparison analysis of Gene Bank database.ResultsA total of 220 differential expression genes were sequenced,including hemoglobin,ribosomes and mitochondria related genes,and heat shock factor binding protein 1 (HSPB1) gene and other genes.ConclusionSSH method and molecular cloning technique could be used to construct subtracted cDNA library of differential expression genes between drug resistant and not-resistant leukemia cells,which might be useful for further screening and cloning of differential expression genes of multidrug resistant tumor cells.
Key words:leukemia;multidrug resistance;suppressive subtractive hybridization;differential expression genes
(收稿日期:2015-11-13)
DOI:10.3969/j.issn.1673-4130.2016.06.010
文献标识码:A
文章编号:1673-4130(2016)06-0743-04
作者简介:王楠,女,主管技师,主要从事恶性血液病的实验室研究。(△)通讯作者,E-mail:494701814@qq.com。
