恶性脑胶质瘤术后替莫唑胺同步放化疗的疗效观察
2016-04-22夏璐周强刘黎
夏 璐 周 强 刘 黎
四川遂宁市中心医院肿瘤科 遂宁 629000
恶性脑胶质瘤术后替莫唑胺同步放化疗的疗效观察
夏璐周强刘黎
四川遂宁市中心医院肿瘤科遂宁629000
【摘要】目的探讨恶性脑胶质瘤术后替莫唑胺同步放化疗的疗效。方法选取2009-02—2010-08于我院就诊并住院的脑胶质瘤术后患者98例,分为单纯放疗组和同步放化疗组各49例,单纯放疗组接受单纯放疗(DT 60 Gy),同步放化疗组在此基础上加服替莫唑胺75 mg/(m2·d)同步化学治疗,放疗后口服替莫唑胺150~200 mg/(m2·d),连续服用5 d,每个疗程28 d,服用6个疗程。2组治疗过程中均给予甘露醇和地塞米松等药物以降低颅内压。比较2组1、3、5 a生存率。结果单纯放疗组1、3、5 a生存率分别为61.22%、24.49%、14.29%,同步放化疗组分别为79.59%、51.02%、32.65%,同步放疗组疗效优于单纯放疗组(P<0.05)。结论替莫唑胺同步放化疗在恶性脑胶质瘤术后的疗效优于术后单纯放疗。
【关键词】替莫唑胺;放射治疗;化学治疗;脑胶质瘤
【Key word】Temozolomide; Radiotherapy; Chemotherapy; Cerebral gliomas
恶性脑胶质瘤作为人类社会中较为常见的一种颅内肿瘤,尤其是恶性胶质母细胞瘤以及恶性星形胶质细胞瘤,由于恶性程度高,其复发率以及病死率均较高[1]。临床上,对恶性脑胶质瘤的治疗一般以手术切除为主,以放射治疗和化学治疗为辅,然而这并不能有效提高患者的无瘤生存期[2]。替莫唑胺(temozolomide,TMZ)已在临床上用于高分级脑胶质瘤术后辅助治疗,将放射治疗联合TMZ化学治疗用于恶性脑胶质瘤也已取得明显成效,其耐受性也较高[3]。本研究通过比较恶性脑胶质瘤术后放疗联用TMZ与单纯放疗1、3、5 a的生存率,探讨替莫唑胺同步放化疗在恶性脑胶质瘤术后的疗效。
1资料与方法
1.1一般资料选取于2014-01—2015-01在我院住院的脑胶质瘤术后患者98例,术后病理诊断确诊其恶性级别为Ⅱ、Ⅲ、Ⅳ级,手术治疗皆为镜下近全切或全切,对所有患者进行24个月的随访。将患者分为单纯放疗组和同步放化疗组,每组49例。单纯放疗组仅采用单纯三维适形放疗,而同步放化疗组则在此基础上联用替莫唑胺进行同步化疗。2组基本资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
1.2方法
1.2.1治疗方法:单纯放疗组仅接受单纯放射治疗,同步放化疗组给予三维适形放疗联用替莫唑胺同步化疗。放射治疗需采用CMSTPS软件以及医科达SYNGER直线加速器进行放射治疗计划设计。首先通过头架、头枕、头部热塑膜固定头部,再通过CT对全脑进行连续增强扫描(扫描层厚3 mm),获取影像资料后传入TPS以勾画肿瘤靶区。根据患者术前水肿区域和肿瘤病灶,设定脑肿瘤靶区(GTV),把水肿区缘或者整个肿瘤手术切缘外放2~3 cm设为临床靶区(CTV)肿瘤。通过TPS进行照射野设计以及剂量评估后,给予4~5个照射野,以保证95%以上的处方剂量可以将GTV包全。1次/d,2.0 Gy/次, 5 d/周;CTV的照射剂量达到50 Gy/25f后,调整照射野,将其缩小至GTV外放0.5~1 cm,再增加照射剂量,至GTV照射总剂量达到60 Gy/32~35f后停止,共计治疗6~7周。同步放疗组放疗期间采用替莫唑胺进行同步化学治疗,剂量75 mg/(m2·d),放射治疗结束后连续5 d口服替莫唑胺进行辅助化学治疗,剂量为150~200 mg/(m2·d),1个疗程28 d,共用6个周期。2组治疗过程中均根据个人情况给予甘露醇或地塞米松以降低颅内压。
1.2.2观察指标:比较2组的生存率和生存时间以评价疗效。统计2组术后的无瘤生存时间以及生存时间,并绘制生存曲线,比较2组1、3、5 a的总生存率;从患者手术日期开始计算,到其死亡日期或者最后一次随访的日期为止作为患者的生存时间,计算2组的平均生存时间并比较。

表1 2组基本资料比较
2结果
2.12组生存率和平均生存时间比较2组生存率、平均生存时间比较差异均有统计学意义(P<0.05)。见表2、图1。
2.2不良反应2组主要发生恶心、呕吐等非血液毒性不良反应,给予止吐类药物对症治疗后症状有所缓解。部分患者发生Ⅰ度白细胞下降等血液学毒性反应,给予粒细胞集落刺激因子(G-CSF)对症治疗后症状有所缓解。未发生Ⅱ~Ⅳ度骨髓抑制、肝肾功能异常及血小板减少等现象,无死亡。

表2 2组生存情况比较
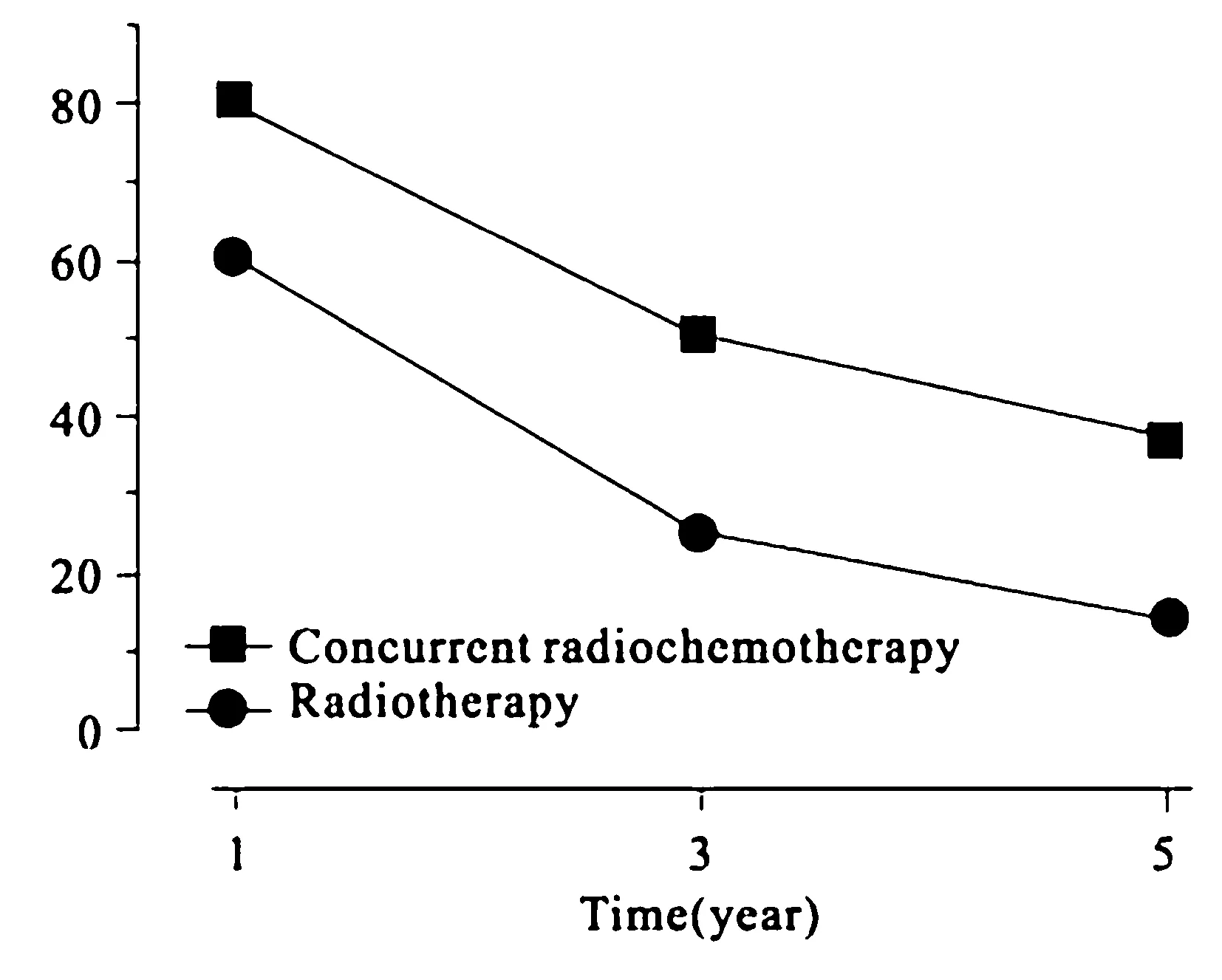
图1 2组生存曲线
3讨论
外科手术作为脑胶质瘤的一种重要的治疗手段,应在保证脑功能的基础下尽量切除肿瘤[4]。目前,在恶性脑胶质瘤的治疗方法上,达成了综合治疗的共识,一般认为手术切除是首选方法,手术难度较大时,若无法将肿瘤全部切除,也应尽量获取肿瘤组织进行活检,在获得组织学诊断后,采取术后放射治疗和化学治疗进行辅助治疗[5-6]。尽管手术切除在恶性脑胶质瘤的治疗上具有重大的作用,如果术后不进行放疗和化疗,也不能延长患者的生存时间,据统计,单纯手术治疗患者的平均生存时间约为3个月,其1 a生存率也低于5%[7]。因此,学者们一致认为,放疗和化疗对于恶性脑胶质瘤患者的术后辅助治疗极其必要[8]。术后高级别胶质瘤一般首选放射治疗作为其辅助手段[9]。由于高级别脑胶质瘤恶性程度高,手术无法完全将其切除,导致高复发率和手术失败,从而降低患者的生存率和生存时间,而术后放射治疗的应用,可进一步杀灭残留的肿瘤组织,进而降低肿瘤的复发率,提高患者的生存率和生存时间[10]。调强放射治疗(IMRT)以及术后三维适形放射治疗(3D-CRT)的应用,可有效提高恶性脑胶质瘤的治疗效果。3D-CRT适形剂量分布较佳,适合应用到颅脑肿瘤的治疗,不但可以控制局部肿瘤组织进一步发展,也可防止肿瘤周围的正常脑组织发生严重放射性损伤。因此,临床上普遍使用3D-CRT作为恶性脑胶质瘤的辅助治疗手段。国外有一项研究发现,恶性脑胶质瘤术后患者进行3D-CRT 2 a生存率比常规放疗提高了27.0%。尽管术后放疗可提高恶性脑胶质瘤的疗效,其5 a生存率一般也低于10%,长期生存率仍较低。替莫唑胺作为新一代的烷化剂,因其亲脂性强,分子质量小,较易通过血脑屏障,在脑脊液中达到有效的作用浓度,从而发挥作用,研究发现,替莫唑胺在脑脊液中的浓度可达到血浆浓度的30%~40%。RT联用TMZ对恶性脑胶质瘤的治疗具有协同作用,除放疗本身对肿瘤细胞具有杀伤作用外,TMZ代谢产物产生的细胞毒性及TMZ本身的放疗增敏性可进一步杀灭肿瘤细胞,因此,通过其协同作用,不仅可以减少TMZ的使用量,也提高了患者的耐受性。国外通过大型临床试验证明,TMZ的使用可有效减少肿瘤体积,延长胶质瘤患者的平均生存时间,增加患者的KPS评分,提高患者的生活质量。TMZ的不良反应较少,常见骨髓抑制毒性。本研究通过比较单纯放疗和放疗联用TMZ化疗,发现同步放化疗组的生存率和平均生存时间均优于单纯放疗组(P<0.05),与许多国内外研究的结果基本相同。
综上所述,手术是治疗恶性脑胶质瘤的首选方案,但术后进行同步放化疗和辅助化疗,可提高患者的生存率和平均生存时间,值得临床推广使用。
4参考文献
[1]Wick W,Platten M,Meisner C,et al.Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly:the NOA-08 randomised,phase 3 trial[J].Lancet Oncol,2012,13(7):707-715.
[2]Stummer W,Meinel T,Ewelt C,et al.Prospective cohort study of radiotherapy with concomitant and adjuvant temozolomide chemotherapy for glioblastoma patients with no or minimal residual enhancing tumor load after surgery[J].J Neuro-oncol,2012,108(1):89-97.
[3]康勋,李珊,谢铮铮,等.恶性脑胶质瘤同步放化疗中替莫唑胺化疗的不良反应及对策[J].首都医科大学学报,2012,33(5):589-593.
[4]Malmström A,Grnberg BH,Marosi C,et al.Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma:the Nordic randomised,phase 3 trial[J].Lancet Oncol,2012,13(9):916-926.
[5]赵东利,刘锐,邓怀慈,等.恶性脑胶质瘤术后替莫唑胺同步放化疗与单纯放疗的疗效对比[J].西部医学,2014,26(9):1 141-1 143.
[6]Shaw EG,Wang M,Coons SW,et al.Randomized trial of radiation therapy plus procarbazine,lomustine,and vincristine chemotherapy for supratentorial adult low-grade glioma:initial results of RTOG 9802[J].Clin Oncol,2012,30(25):3 065-3 070.
[7]Johnson DR,O’Neill BP.Glioblastoma survival in the United States before and during the temozolomide era[J].J Neurooncol,2012,107(2):359-364.
[8]王茂明.脑胶质瘤的治疗现状[J].医学综述,2012,18(21):3 583-3 586.
[9]Chinot OL,Wick W,Mason W,et al.Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma[J].N Engl J Med,2014,370(8):709-722.
[10]王立威,孙玉学,张博,等.胶质瘤源性Exosome的研究进展[J].中国实验诊断学,2012,16(5):945-948.
(收稿2015-08-20修回2015-12-27)
Observation of the effect of postoperative radiochemotherapy with temozolomide on malignant cerebral gliomas
XiaLu,ZhouQiang,LiuLi
DepartmentofOncology,theCentralHospitalofSuining,Suining629000,China
【Abstract】Objective To study the effect of postoperative radiochemotherapy with temozolomide on malignant cerebral gliomas. Methods A total of 98 postoperative patient with cerebral gliomas in our hospital from February 2009 to August 2010 were divided into simple radiotherapy group (control group) and concurrent chemoradiotherapy group (study group), each group had 49 cases. Patients in control group was irradiated with DT60Gy merely, while the study group received the additional chemotherapy (Temozolomide 75 mg/(m2·d)) in the radiotherapy period similar to control group, after terminal of the radiotherapy patients in study group continuously took Temozolomide (150~200 mg/(m2·d) orally) for 5 days and then remained chemotherapy for 6 courses (28 days in each course). In the same time, two groups were treated with mannite and dexamethasone to decrease intracranial pressure. Finally, we comparatively analyzed the survival rate of two groups at 1-, 3-,5-year visit. Results The 1-,3-,5-year survival rate of control group was 61.22%, 24.49%, 14.29% respectively, while that of study group was 79.59%, 51.02%, 32.65% respectively. We could indicate that the clinical efficacy of study group was higher than that of control group (P<0.05). Conclusion Concurrent radiochemotherapy with temozolomide can take an advantage over simple radiotherapy in postoperative patients with malignant cerebral gliomas.
【中图分类号】R739.41
【文献标识码】A
【文章编号】1673-5110(2016)04-0003-03
