Bacillus subtilis脂肽Bacillomycin D抗黄曲霉毒素研究进展
2016-04-20马芳芬殷海成
马芳芬+殷海成
摘 要:枯草芽孢杆菌(Bacillus subtills)被认为是一种有效抑制黄曲霉并降解其毒素的菌种。己从不同的枯草芽孢杆菌菌株中分离得到具有抑制黄曲霉毒素的脂肽抗生素Bacillomycin D。Bacillomycin D属于Iturin家族,是枯草芽孢杆菌抑制黄曲霉毒素最强抗生素,也是目前唯一从枯草芽孢杆菌菌株中得到并且已经鉴定的具有抗黄曲霉活性的物质。该文对枯草芽孢杆菌及其抗菌脂肽Bacillomycin D的结构、性质、抑制黄曲霉机制进行了综述,为其进一步应用提供参考。
关键词:枯草芽孢杆菌;抗菌脂肽;Bacillomycin D;黄曲霉;毒素
中图分类号 5816.7 文献标识码 A 文章编号 1007-7731(2016)06-22-03
Research Progress on the Inhibition Effect of Antimicrobial Lipopeptide Bacillomycin D from Bacillus subtilis on Aspergillus flavus
Ma Fangfen et al.
(College of Biological Engineering,Henan University of Technology,Zhengzhou 450001,China)
Abstract:Bacillus subtilis is considered to be a probiotics,which can suppress the growth of Aspergillus flavus and degrade aflatoxin of the strain. So far,the lipopeptide complex like Bacillomycin D produced by the strain has been found have antifungal activities. Bacillomycin D belongs to the iturin family,which is the most powerful antibiotic for B.subtilis,and is currently the only material that has been identified from the strain.In this paper,the research advances in chemical structure,physicochemical characters and antifungal properties of B. subtilis and/or bacillomycin D were reviewed to provide technical reference for the further research and application.
Key words:Bacillus subtilis;Antimicrobial lipopeptides;Bacillomycin D;Aspergillus flavus;Aflatoxin
黄曲霉毒素(Aflatoxin,AFT)是一类由黄曲霉(Aspergillus flavus)、特曲霉(Aspergillus nomius)、寄生曲霉(Aspergillus parasiticus)等霉菌分泌的含有一个双呋喃环和一个香豆素的次级代谢物,分为B族和G族2类,共20余种,是目前发现的自然界中毒性最强、危害最大的霉菌毒素[1];它具有强烈的致癌、致畸、致突变性等;广泛存在于粮食及食品中,如花生、玉米和奶制品、饲料等[2]。据联合国粮农组织(FAO)估计,每年由黄曲霉毒素污染造成的损失多达数千亿美元[3],已成为国内外食品安全组织和科研院所等有关部门高度关注的问题。因此,采取有效措施抑制黄曲霉或去除黄曲霉毒素污染十分必要。
目前预防AFT主要采取阻止黄曲霉污染和对已经造成污染的食品或饲料原料进行脱毒以及降低人和动物对AFT的吸收等[4]。脱毒最常采用的方法有物理法、化学法和生物法。而生物方法反应条件温和,去毒效率高成为目前研究热点。大量研究也证实:很多霉菌、细菌、放线菌、酵母以及藻类等都可以用来降解黄曲霉毒素。其中芽孢杆菌由于分布广泛,容易培养,且培养物中含有多种抗菌脂肽,是一类比较理想的生防微生物,以枯草芽孢杆菌(Bacillus subtills)抗黄曲霉效果好而备受青睐。枯草芽孢杆菌合成、分泌的抗菌物质是具有表面活性一类抗菌脂肽[5,6](antimierobial peptides,AMPs),此类脂肽目前已知有3大类:包括Surfactin家族、Iturin家族和Fengycin家族[7]。这些抗真菌肤有许多共同的特征:分子量较小,约l 000D左右,含有D-构型氨基酸和β-脂肪酸等一些特殊结构,由于氨基酸呈环状排列,因此称为环脂抗菌肽。Bacillomycin D属于Iturin家族中的一种,是抑制黄曲霉最强且唯一的一种抗生素,并与其它脂肽类抗生素无交叉耐药性,毒性小,抗菌谱广等特点[8-9]备受关注。本文主要概述了枯草芽孢杆菌及其抗菌脂肽Bacillomycin D的结构、性质及拮抗黄曲霉毒素的作用机制。
1 Bacillomycin D结构及性质
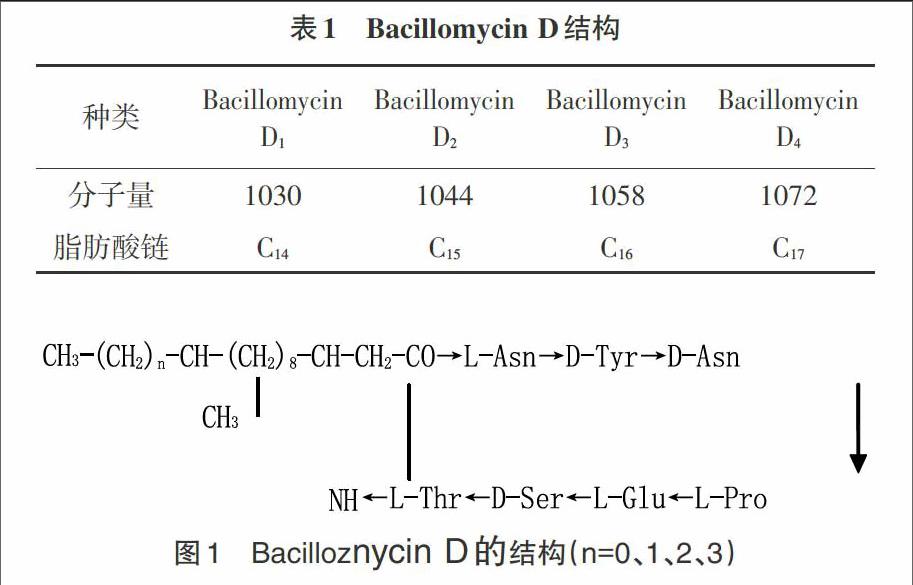
Bacillomycin D抗菌脂肽首次由Landy等[10]于1948年从枯草芽孢杆菌中分离得到。随后研究发现很多枯草芽孢杆菌均可产生。Moyne和Thomas[11]证实Bacillomycin D的合成是由枯草芽孢杆菌胞内的多酶复合体经非核糖体途径合成;Moyne等[12]进一步研究该多酶复合体由4个开放阅读框共同编码并组成Bacillomycin D的操纵子。Bacillomycin D属于Iturin家族的一个成员,也是由亲水性环状短肽与疏水性长链脂肪酸组成的具有表面活性的双亲性化合物。后经Maget-Dana、Peypoux[13]进一步分离、纯化发现有4种同系物,C原子分别为C14-C17(表1)。其中7个氨基酸手性顺序为L-Asn-D-Tyr-D-Asn-L-Pro-L-Glu-D-Ser-L-Thr即L-D-D-L-L-D-L,见图1。
表1 Bacillomycin D结构
[种类\&Bacillomycin
D1\&Bacillomycin
D2\&Bacillomycin
D3\&Bacillomycin
D4\&分子量\&1030\&1044\&1058\&1072\&脂肪酸链\&C14\&C15\&C16\&C17\&]
<\\Pc10\工作盘 (E)\姜秀红\杂志\安徽农学通报杂志\2016-6农学通报内文\s96-1.eps>
图1 Bacilloznycin D的结构(n=0、1、2、3)
Bacillomycin D所具有的亲水基和疏水基赋予其既易溶于水,又能溶于部分有机溶剂,因此是一种生物表面活性剂,但其活性弱于Surfactin脂肽。因此,对于Bacillomycin D提取常采用物理吸附和化学化合方法,提取率近100%。Bacillomycin D的理化性质稳定,有较好的热稳定性,121℃、30min保持95%抗菌活性,pH=7.6活性最强,对有机溶剂有较强的耐受性(乙睛TFA,甲醇等),对蛋白酶类不敏感;25w紫外灯下,距离约5cm,照射8h不影响活性,这与Iturins家族理化特性一致[14]。然而,戴晓燕和关桂兰[15]认为枯草芽孢杆菌多种抗菌蛋白偏酸性,对高温稳定,在酸性和中性条件下相对稳定,在碱性条件下不稳定,这可能是归于枯草芽孢杆菌来源不同或纯化状态有关。
2 枯草芽孢杆菌及其Bacillomycin D抗黄曲霉毒素机制
20世纪40年代至今,从不同枯草芽孢杆菌株分离、纯化的抗菌物质有很多种,但对黄曲霉有抑制作用只有Bacillomycin D,也是目前唯一从枯草芽孢杆菌菌株中得到并且已经鉴定的具有抗黄曲霉活性的活性物质[12]。Bottone和Peluso[16]的研究表明:Bacillus subtilis可分泌一种显著抑制黄曲霉孢子萌发和菌丝延长的活性物质,分子量500~3 000Da,但没有进一步纯化、鉴定;Moyne[12]在此基础上进一步研究,从中分离得到抗黄曲霉活性物质为Bacillomycin D,该物质对黄曲霉最低抑制量为3μg/g;中国农业科学院的张盼[17]等从可食用的纳豆中筛选出一株枯草芽抱杆菌Natto 3,能够高效降解黄曲霉毒素B,降解率达到91.4%。
Bacillomycin D与iturin家族其他脂肽的结构类似,但氨基酸组成的差异(图1)导致其生物活性的不同。Iturin对真菌、酵母的抑制作用强但对部分细菌抑制作用较弱,对黄曲霉几乎没有作用,兼有表面活性作用和溶血作用;而Bacillomycin D不仅对真菌有抑制作用,而且对黄曲霉菌也有很强的抑制作用[12]。目前,对其对于iturin家族抗真菌机制研究主要集中在细胞膜上,例如,Aranda等[18]认为:Iturins与真菌细胞膜的磷脂双分子层相互作用,可形成Iturins聚合物或形成脂肽-磷脂、脂肽-磷脂-甾醇聚合物,使细胞膜离子通道通透性增加,导致细胞内容物的释放,从而引起真菌细胞的生长抑制或者死亡;侯红漫[19]等认为:Iturins通过小囊泡的形成和内膜颗粒聚集来干扰真菌细胞质膜功能,促进释放电解质,大分子物质以及降解磷脂,导致细胞死亡,作用机制基本一致。对于Bacillomycin D是否能抑制黄曲霉某种蛋白活性,引起黄曲霉生长抑制或毒素分泌减少研究很少。Broaden[20]认为,抗菌脂肽能与病原菌染色体DNA发生相互作用,抑制DNA的复制、转录、表达功能,使菌体蛋白质的合成受阻,进而抑致其生长和繁殖;抗菌脂肽还能抑制点青霉菌丝细胞内琥珀酸脱氢酶和苹果酸脱氢酶活性,并且随着脂肽浓度的增加对这2种酶的抑制作用增强[21]。龚庆伟[22]在对Bacillomycin D抑制黄曲霉作用机制研究后认为,该抗菌脂肽除了破坏细胞膜,它还能够使黄曲霉生长过程中产生的前体物Norsolorinin acid(NA)减少以及菌丝的细胞壁溶解,使之发生严重变形甚至破裂,加速黄曲霉死亡。总之,枯草芽孢杆菌拮抗黄曲霉机理目前尚无明确定论,还有待进一步深入研究。
3 枯草芽孢杆菌抑制黄曲霉及其毒素效果
枯草芽孢杆菌是在自然界中广泛存在一类嗜温、好氧且产芽饱的革兰氏阳性杆状细菌。该菌对人畜无毒、无害而且不污染环境,具有广谱拮抗病菌的活性以及抗逆能力,已广泛运用于农作物及其产品的真菌污染防治。美国已有4株枯草芽孢杆菌生防菌被国家环保局(EPA)商品化或有限商品化生产许可。Johnson[23]1945年首次报道枯草芽抱杆菌抗菌物质。随后针对黄曲霉抑制作用开展大量研究。Landy等[10]通过枯草芽孢杆菌发酵,发现发酵液中含有抑制黄曲霉的活性物质;Kirnura[24]、Moyne[11]等采用同样方法筛选到的枯草芽孢杆菌(NK330和AU 195)能很好的抑制黄曲霉的生长及产毒。Moyne等研究的最低抑制浓度为3μg/g,抑制效果达85%;Reddy[25]将枯草芽孢杆菌发酵液,按照200mg/kg比例添加到大米中,可抑制93%的黄曲霉生长和83.7%黄曲霉毒素B1的产生;Farzaneh[26]使用该菌对污染黄曲霉开心果进行实验也发现,黄曲霉毒素降解率达95%;不同的是,Ono[27]在对枯草芽孢杆菌发酵后,发现发酵液中iturin A能抑制黄曲霉毒素,并申请了专利,但随后被证实对黄曲霉毒素无效[28]。国内朱新贵[29]等对几种食品微生物去除黄曲霉毒素研究也发现,其中以枯草芽孢杆菌的抑制效果最好,为88%,若向培养基中添加钙或镁离子可以促进枯草杆菌对黄曲霉毒素的降解;张盼[17]等从可食用的纳豆中筛选出一株枯草芽孢杆菌Natto3,能够高效降解黄曲霉毒素B1,在浓度为43μg/kg时,降解率达到91.4%。此外,关于枯草芽孢杆菌降解黄曲霉毒素还有产品上市,如雷元培[30]等从动物肠道分离的枯草芽抱杆菌能降解黄曲霉毒素,降解率为81%,并命名为霉立解060。除此之外,有关枯草芽孢杆菌抑制黄曲霉的生物农药未见登记。
利用枯草芽孢杆菌防治黄曲霉取得一定成就,也从该菌发酵底物中筛选到多种抗黄曲霉的脂肽复合物,但是真正能够运用到实践中的却很少。其原因可能是抗菌脂肽分离、纯化比较困难,难以产业化生产;其次是抗菌脂肽的作用机制还尚未完全掌握。因此,对抗菌脂肽类抗生素还需要进行更深入、更广泛的研究。
参考文献
[1]谢光洪,陈承祯,徐闯,等.黄曲霉毒素检测方法的研究[J].饲料工业,2007,28(6):53-56.
[2]计成.饲料中霉菌毒素生物降解的研究进展[J].中国农业科学,2012,45(1):153-158.
[3]Zjalic S,Reverberi M,Ricelli A,et al.Trametes versicolor:A possible tool for aflatoxin control[J].International Journal of Food Microbiology,2006,107(3):243-249.
[4]Bata ?,Lásztity R.Detoxication of mycotoxin-contaminated food and feed by microorganisms[J].Trends in Food Science & Technology,1999,10(6-7):223-228.
[5]Hassan M,Kjos M,Nes I F,et al.Natural antimicrobial peptides from bacteria:characteristics and potential applications to fight against antibiotic resistance[J].Journal of Applied Microbiology,2012,113(4):723-736.
[6]Leclère V,Bechét M,Adam A,et al.Mycosubtilin overproduction by Bacillus subtilis BBC100 enchances the Organisms antagonistic and biocontrol activites.Applied and Environmental Microbiology,2005,71(8):4577-4584.
[7]Etchegaray A,Bueno C C,de Melo I S,et al.Effect of a highly concentrated lipopeptide extract of Bacillus subtilis on fungal and bacterial cells[J].Archives of Microbiology,2008,190(6):611-622.
[8]Yuan J,Li B,Zhang N,et al.Production of bacillomycin-and macrolactin-type antibiotics by Bacillus amyloliquefaciens NJN-6 for suppressing soilborne plant pathogens[J].Journal of Agricultural and Food Chemistry,2012,60(12):2976-2981.
[9]Zhao Z,Wang Q,Wang K,et al.Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J].Bioresource Technology,2010,101(1):292-297.
[10]Landy M,Warren G H,Roseman S B,et al.Bacillomycin anantibiotic from Bacillus subtilis active against pathogenic fungi[J].Proceedings of Society Express Biology Medical,1948,67:539-541
[11]Moyne A L,Thomas E.Molecular characterization and analysis of the operon encoding the antiflingal lipopeptide bacillomycin D[J].FEMS Microbiology Letters,2004,234:43-49.
[12]Moyne A L,Shelby R,Cleveland T E,et al.Bacillomycin D:an iturin with antifungal activity against Aspergillus flavus[J].Journal of Applied Microbiology,2001,90(4):622-629.
[13]Maget-Dana R,Peypoux F.Iturins,a Special Class of Poreforming Lipopeptides:Biological and Physicochemical Properties[J].Toxicology,1994,87:151-174.
[14]何红,蔡学清,关雄,等.内生菌BS-2菌株的抗菌蛋白及其防病作用[J].植物病理学报,2003,33(4):373-378.
[15]戴晓燕,关桂兰.两株对辣椒疫霉菌有拮抗作用的拮抗菌分泌蛋白的研究[J].中国生物防治,1999,15(2):81-84.
[16]Bottone E J,Peluso R W.Production by Bacillus Pumilus of an Antifungal Compound that is Active Against Mucoraceae and Aspergillus Species:Preliminary Report.Antimicrobial agents and chemotherapy,2002
[17]张盼,李培武,万霞,等.枯草芽抱杆菌Natto3的筛选及其降解黄曲霉毒素B1的初步研究[J].中国油料作物学报,2015,37(2):234-239.
[18]Aranda F J,Teruel J A,Ortiz A.Further aspects on the hemolytic activity of the antibiotic lipopeptide iturin A[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2005,1713(1):51-56.
[19]侯红漫,靳艳,金美芳,等.环脂肤类生物表面活性剂结构!功能及生物合成[J].微生物学通报,2006,33(5):122-128.
[20]Rottem S.Membrane lipids of mycoplasmas[J].Biochimica et Biophysics Acta(BBA):Biomembranes,1980,604(1):65-90.
[21]Huang X Q,Wang Y F,Cui Y H,et al.Optimization of antifungal effect of surfactin and iturin to penicillium notatum in syrup of peach by RSM[J].International Journal of Peptide Research and Therapeutics,2010,16(2):63-69.
[22]龚庆伟.芽孢杆菌抗菌脂肽的分离纯化及Badllomycin D抑制黄曲霉作用的研究[D].南京农业大学,2012.
[23]Johnson B A,Anker H,Meleney F L.Bacitracin:a new antibiotic produced by a member of the B.subtilis group[J].Science,1945,102:376-377.
[24]Kimura N,Hirano S.Inhibitory strains of Bacillus subtilis for growth and aflatoxin-production of aflatoxienic fungi[J].Agricultural and Biological Chemistry,1988,52:1173-1179.
[25]Reddy K R N,Reddy C S,Muralidharan K.Potential of botanicals and biocontrol agents on growth and aflatoxion production by Aspergillus flavus infecting rice grains[J].Food Control,2009,20(2):173-178.
[26]Farzaneh M,Shi Z Q,Ghassempour A,et al.Aflatoxin B1 degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J].Food Control,2012,(23):100-106.
[27]Ono M,Kimura N.Antifungal peptides produced by Bacillus subtilis for the biological control of aflatoxin contamination[J].Proceedings of the Japanese Association of Mycotoxicology,1991,34:23-28.
[28]Klich M A,Lay A R,Bland J M,et al.Influence of iturin A on mycelial weight and aflatoxin production by Aspergillass flavus and Aspergillus parasiticus in shake culture[J].Mycopathologia,1993,123:35-38.
[29]朱新贵,林捷.几种食品微生物降解黄曲霉毒素作用的研究[J].食品科学,2001,22(10):65-68.
[30]雷元培,赵丽红,马秋刚,等.降解黄曲霉毒素枯草芽抱杆菌的解毒性抗菌性及抗逆性研究[J].饲料工业,2011,32(4):23-27.
(责编:徐焕斗)
