盲肠结扎穿孔败血症小鼠模型的手术方式优化*
2016-04-19郭佳南刘文钰周东田林郁
郭佳南 刘文钰 周东 田林郁
(四川大学华西医院神经内科,四川 成都 610041)
盲肠结扎穿孔败血症小鼠模型的手术方式优化*
郭佳南刘文钰周东田林郁△
(四川大学华西医院神经内科,四川 成都610041)
摘要目的:探究如何对传统盲肠穿孔结扎(Cecal ligation-and-perforation,CLP)败血症模型手术方式进行优化。方法:选取雄性昆明小鼠103只按是否给予亚胺培南/西司他丁分为:抗生素组、无抗生素组和假手术组。在传统CLP手术方式的基础上缩小手术切口,调整切口位置和术后抗生素用量来观察接受手术小鼠术后存活率及不同批次间小鼠存活率一致性等指标,并与既往文献报道的同类模型进行比较。结果:在本次实验103只小鼠手术中,抗生素组、无抗生素组和假手术组三组小鼠存活时间的分布总体有差异(P=0.026)。组间两两比较发现:抗生素组与无抗生素组7天生存率明显高于无抗生素组(P<0.001),假手术组生存率明显高于无抗生素组生存率(P<0.001),而抗生素组与假手术组存活率差异无统计学意义(P=0.331)。抗生素组10个批次小鼠存活率的Cronbach’s α系数为0.954。结论:优化后的CLP小鼠模型存活率与传统模型相似,具更亦操作的标准化的手术流程,切口更小,组间生存率一致性高,可重复性好。
关键词:败血症;动物模型;手术方式;盲肠结扎穿孔;生存率
败血症是ICU患者高发的疾病,也是ICU患者常见的死因。在中国大陆的一项多中心的队列研究显示,ICU患者被诊断重度败血症或感染性休克的比例为37.3%,在ICU住院期间死亡率高达28.7%[1],而在世界范围内的败血症总死亡率在30%到70%不等,平均死亡率约在50%[2]。而因创伤入院的患者中有近一半的患者合并败血症[3]。即使救治及时使患者度过危险期,仍然有许多远期并发症,如免疫抑制状态和肺部损伤[3]等。另外,败血症也是很多发展中国家的儿童的主要死亡原因之一[4]。因此,对败血症的基础研究至关重要。
盲肠结扎穿孔动物模型(Cecal ligation and puncture,CLP)被认为是目前多种败血症动物模型的金标准。因为它破环了生物的自然屏障从而诱发败血症,因此可较准确地从自然病程和病因上模拟人类的败血症[3]。另外,CLP败血症模型建立后的血流动力学也与人类败血症的血流动力学十分相似[5]。目前的CLP败血症动物模型可在小鼠、大鼠等多种动物上建立。本实验以小鼠为模型动物对传统CLP败血症小鼠的手术方式稍作优化后观察术后小鼠在不同时段的存活率并据此推测模型的稳定性。
1材料与方法
1.1材料
选取103只体重为20-25 g清洁级昆明雄性小鼠(成都达硕生物有限公司提供)。饲养环境:10只/笼,24℃恒温、恒湿饲养;采用12 h光-暗周期、饲料及饮水均经紫外光照灭菌后供应,术前及术后均充足供应食物及水。为了更好拟合天然屏障被破坏后感染引起败血症的真实情况,小鼠术前不禁食;并据传统CLP小鼠模型[5]的手术方法并进行一定改造后手术,改造部分详见表1。
1.2方法
1.2.1手术
手术分组:103只小鼠共分10批完成手术:第一至七批每批10只,第八至十批每批11只。每批次手术小鼠中,随机选取1只作为假手术组,即麻醉后仅开腹后寻找盲肠后还纳,关腹。剩余小鼠术后随机分为抗生素组和无抗生素组2组。2组均接受CLP手术。本次实验共取103只小鼠手术,分10个批次手术,每批10或11只小鼠,全部手术均由相同的2名操作者协作完成,不同批次的手术均在手术当天的同一时间段内完成。其中抗生素组72只,无抗生素组22只,假手术组9只(最后1批次手术未设假手术组)。

表1 CLP动物模型改造之处
1.2.2手术步骤
麻醉:用胶带将小鼠四肢及尾部固定于无菌手术台上,使用新鲜配置的3.5%水合氯醛溶液0.1 ml·10g-1体重进行腹腔注射麻醉。为避免干扰手术,腹腔注射麻醉均选择小鼠右下腹进针。注射后约10 min用镊子夹小鼠足趾,验证小鼠疼痛反应下降满意后开始手术。
开腹:备皮后使用5%聚维酮碘溶液消毒整个腹部皮肤,用剪刀在剑突下中线偏左3-5 mm开已平行于中线的长约0.5-1.0 cm纵行切口,逐层剪开至打开腹膜暴露肠管。
结扎:用小号平镊轻轻提起盲肠,找到盲肠游离末端轻提使之与其余肠管分离。用4-0丝线在距盲肠末端约1 cm处结扎盲肠,注意避免结扎或损伤肠系膜血管。
穿孔:使用22G针头在被结扎的盲肠中点处穿孔,针头需穿通全层肠壁并由另一侧穿出。使用平镊轻夹肠管至挤压出少量肠内容物,约与穿刺针孔大小相当,后还纳肠管至腹腔。消毒局部切口切缘后使用4-0丝线逐层关腹。
关腹后再次使用5%聚维酮碘溶液消毒切口处,并以右下腹为进针点腹腔注射0.5ml无菌生理盐水补液,见图1。
将术后小鼠放回已灭菌的鼠笼,并随机分为2组:抗生素组和无抗生素组。抗生素组术后3 h后给第一剂抗生素,抗生素采用亚胺培南/西司他丁(Imipenem/cilastatin,Tienam; Merck Sharp & Dohme Ltda)333.33 mg·kg-1。无抗生素组同时接受等量无菌生理盐水腹腔注射。以后每12 h按组别给抗生素或生理盐水一次,至小鼠死亡或给药满3天。假手术组小鼠术后立即腹腔注射一剂亚胺培南/西司他丁,333.33 mg·kg-1预防切口感染。随后3天与无抗生素组小鼠同等处理。
1.2.3观察指标
观察各组小鼠术后的活动、进食进水状况、切口生长情况,记录小鼠术后24 h至术后7 d每天的存活率。
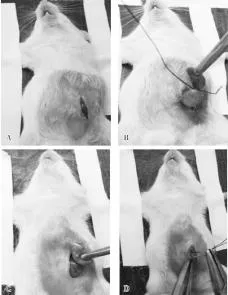
图1 手术方法示意图A手术切口;B找到盲肠后据盲端约1 cm处结扎;C用平镊轻挤出少量肠内容物;D将盲肠还纳腹腔,逐层关腹
1.3统计学分析
利用软件SPSS13.0进行统计分析,采用寿命表法(Life-table method)进行生存分析,使用Wilcoxon法来对三组小鼠的生存时间的分布进行整体比较。绘制生存曲线并对接受标准手术及抗生素治疗的不同批次的小鼠生存率采用Cronbach’s α系数法进行信度评价。P<0.05被认为是结果具有统计学差异。Cronbach’s α系数>0.7被认为信度较高。
2结果
在完成手术后观察并记录术后24 h、48 h、72 h、及术后7 d小鼠的切口情况、活动状况及存活率。
本次实验接受手术的小鼠在术后麻醉苏醒后活动较多,仅较术前稍减少。但术后第6-24 h明显有进食、饮水及活动的减少。切口在1 cm内,在术后7 d的观察期内包括无抗生素组小鼠的所有观察对象在死亡前或观察期结束前均不合并局部切口感染。
截止随访的时点,各组不同时间点的存活率详见表2。

表2 各组不同时间点的存活率(%)
注:与假手术组相比,*P<0.001。
使用采用寿命表法(Life-table method)进行生存分析后生存曲线如图2,使用wilcoxon法来对三组小鼠的生存时间的分布进行整体比较后发现,三组小鼠存活时间的分布总体有差异(P=0.026)。经组间两两比较后发现,抗生素组生存率高于无抗生素组(P<0.001),假手术组生存率高于无抗生素组生存率(P<0.001),而抗生素组与假手术组存活率差异无统计学意义(P=0.331)。
在第一、二批接受手术的21只小鼠中,观察至术后第8周。至术后第8周,抗生素组存活10只,存活率为76.9%(10/13),而无抗生素组存活率:12.5%(1/8)。8周后总存活率为52.3%(11/21)。
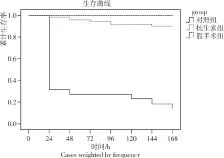
图2 三组小鼠生存曲线
在10个批次接受标准化手术及抗生素治疗的72只小鼠中,分别统计术后1-7天的存活率,得到Cronbach’s α系数为0.954。
3讨论
败血症是ICU中发病率高,死亡率高的疾病。当下医学对败血症的治疗仍然与三十年前的治疗方式相同[7]。因此,虽然败血症是一种古老的疾病,但对它的发病机理与治疗的研究却并不过时。目前仍有多种败血症动物模型用于败血症的基础研究,包括三种机制:1、外源性毒素入血,如:内毒素模型(Endotoxin model);2、外源性病原体入血,如:活菌模型(Live bacteria model);3、天然屏障破坏,如盲肠结扎穿孔模型(Cecal ligation-and-perforation model)等[7]。
良好的败血症小鼠模型应具备以下特性:标准化(Standardization),可重复性(Reproducibility), 以及多用途(Versatility)等特性[8]。盲肠结扎穿孔(CLP)模型因其发病机制与人类败血症的自然发病机制相似而被认为是各类败血症动物模型中的“金标准”。CLP之所以被广泛应用主要由于其多功能性:可以合并创伤、失血等因素进行研究,亦可在其他疾病动物模型的基础上进行建立。但因CLP手术方式难以标准化、死亡率受穿孔针大小影响较大而被认为稳定性较差。因此,基于现状优化CLP动物模型的标准化流程及可重复性十分重要。本实验旨在探究如何优化CLP败血症模型的手术方式及术后支持治疗使模型具有更易标准化且可重复性好的建立流程。
3.1手术方式的标准化
本项实验采取了传统CLP手术步骤,对于针孔大小、穿孔数及穿孔位置这三项已被证实决定最终死亡率的指标进行了标准化[9]。在Toscano M等人的报道中采用了22号针头在据盲肠末端1 cm处结扎,并于结扎部位中点穿孔2次[5]。本项实验通过改变切口位置至剑突下中线偏左3-5 mm使手术视野更于对盲肠进行操作,从而缩小了手术切口。本次实验接受手术的小鼠切口在1 cm内,在术后7 d的观察期内包括无抗生素组小鼠的所有观察对象在死亡前或观察期结束前均不合并局部切口感染。
3.1.1手术切口的缩小
传统小鼠的CLP手术往往采用1-2 cm[5,6]甚至超过2 cm的剑突下中线切口来完成手术,对于体重较小或月龄较小的小鼠是一个较大的打击,而且切口大,术后局部切口感染的风险较高,不利于败血症小鼠的长期观察。Katharina Sommer等人曾对CLP小鼠模型的切口愈合状况进行了研究,发现在败血症状态下,伤口愈合能力下降,不仅使CLP手术术后伤口愈合时间延长,而且会影响远处伤口的愈合[10]。因此,在败血症的动物模型中缩小手术切口可能会降低术后切口局部的感染风险,避免切口感染给动物败血症的观测带来干扰。本次实验接受手术的小鼠切口在1 cm内,在术后7 d的观察期内包括无抗生素组小鼠的所有观察对象在死亡前或观察期结束前均不合并局部切口感染。因此,适当减小手术切口是必要的,尤其对于观察期长,因免疫功能不全等因素而切口感染风险高的实验十分重要。
3.1.2抗生素的运用
本实验选择广谱抗生素亚胺培南/西司他丁,并加大剂量进行治疗可以使发病后的实验小鼠长期存活,但并不会降低革兰阴性菌产生的内毒素对机体的打击,利于长期观察和对重症感染后遗的免疫功能抑制、认知功能障碍等等疾病进行探究。早在1997年,Wickel DJ等人通过对连续105例因腹膜炎继发败血症的患者研究发现,临床中因腹膜炎继发败血症的患者死亡率直接与快速进展的多器官衰竭相关,而非直接与腹膜炎的感染复发相关[11]。Gonnert FA等人研究发现,在腹膜炎继发败血症的动物模型中,虽然抗生素可以提高实验动物的存活率,但存活动物的血清学炎症反应指标及肝脏、肾脏的活检均提示炎症反应持续存在[12]。因此,抗生素的运用并不会掩盖感染所致的炎症反应打击,但抗生素可使实验动物长期存活以便观察,而持续存在的炎症反应损伤又可供探究败血症患者痊愈后认知功能障碍、免疫抑制的原因等等。同时,广谱抗生素也是目前重症感染的常用治疗药物,这对模拟人类败血症的治疗后的临床情境相符合。
3.2模型可重复性的评价
在10个不同批次接受标准化手术方案并辅以抗生素治疗的72只小鼠中,以Cronbach’s α系数法进行信度评价,比较不同批次间小鼠存活率的可重复性,得到Cronbach’s α系数为0.954,大于0.7,说明不同批次间小鼠在不同术后时点生存率的可重复性较高,模型在生存率上的内部一致性较好。
3.3局限性分析
优化后的CLP败血症模型也存在一些缺点:首先,评价模型是否成功建立的指标比较局限。虽然CLP败血症模型可在多种动物中建立,其中啮齿动物模型因其建立成本较其他动物低,在基础研究中应用十分广泛。但啮齿动物血量少,在模型建立初期取血往往对动物存活是致命的,会对模型的最终死亡率产生干扰,因此通过血培养或检测急性期炎症因子水平去验证模型成功率往往难以实现[3],这一点难以拟合临床败血症的诊断流程。所以,通过统计未用药物或手术干预状态下CLP术后动物的最终死亡率来提示模型感染和炎症反应严重度[13]。另外,术后3 h用抗生素,这一时间间隔往往不同于临床真实患者从发病到接受治疗的时间,因此抗生素辅助治疗的效果难以拟合真实的临床环境。
优化后的CLP小鼠模型在无抗生素治疗情况下一周的死亡率达86.36%,感染属于中至重度,辅以广谱抗生素单药治疗后可长期存活,切口小,术后局部感染率大大降低。该模型在大样本量的小鼠中可重复性好,可用于对败血症后长期预后的研究与观察。
参考文献
1Zhou J, Qian C, Zhao M, et al. Epidemiology and outcome of severe sepsis and septic shock in intensive care units in mainland china[J]. PLoS One, 2014, 9(9): e107181.
2Rittirsch D, Hoesel LM, Ward PA. The disconnect between animal models of sepsis and human sepsis[J]. J Leukoc Biol, 2007, 81(1): 137-143.
3Hubbard WJ, Choudhry M, Schwacha MG, et al. Cecal ligation and puncture[J]. Shock, 2005, 24Suppl 1:52-57.
4Launay E, Gras-Le Guen C, Martinot A, et al. Why children with severe bacterial infection die: a population-based study of determinants and consequences of suboptimal care with a special emphasis on methodological issues[J]. PLoS One, 2014, 9(9): e107286.
5Toscano MG, Ganea D, Gamero AM. Cecal ligation puncture procedure[J]. J Vis Exp, 2011, (51).pii:2860.
6Vianna RC, Gomes RN, Bozza FA, et al. Antibiotic treatment in a murine model of sepsis: impact on cytokines and endotoxin release[J]. Shock, 2004, 21(2): 115-120.
7Dejager L, Pinheiro I, Dejonckheere E, et al. Cecal ligation and puncture: the gold standard model for polymicrobial sepsis[J]. Trends Microbiol, 2011, 19(4): 198-208.
8Wichterman KA, Baue AE, Chaudry IH. Sepsis and septic shock-a review of laboratory models and a proposal[J]. J Surg Res, 1980, 29(2): 189-201.
9Singleton KD, Wischmeyer PE. Distance of cecum ligated influences mortality, tumor necrosis factor-alpha and interleukin-6 expression following cecal ligation and puncture in the rat[J]. Eur Surg Res, 2003, 35(6): 486-491.
10Sommer K, Sander AL, Albig M, et al. Delayed wound repair in sepsis is associated with reduced local pro-inflammatory cytokine expression[J]. PLoS One, 2013, 8(9): e73992.
11Wickel DJ, Cheadle WG, Mercer-Jones MA, et al. Poor outcome from peritonitis is caused by disease acuity and organ failure, not recurrent peritoneal infection[J]. Ann Surg, 1997, 225(6): 744-753; discussion 753-756.
12Gonnert FA, Recknagel P, Seidel M, et al. Characteristics of clinical sepsis reflected in a reliable and reproducible rodent sepsis model[J]. J Surg Res, 2011, 170(1): e123-34.
13Mattick JS, Yang Q, Orman MA, et al. Long-term gene expression profile dynamics following cecal ligation and puncture in the rat[J]. J Surg Res, 2012, 178(1): 431-442.
An improved mice model of cecal ligation and perforation for sepsis*
Guo Jia-nan, Liu Wen-yu, Zhou Dong, Tian Lin-yu△
(Department of Neurology, West China Hospital of Sichuan University, Sichuan Chengdu 610041)
AbstractObjective:To explore how to improve traditional Cecal-ligation and puncture(CLP) procedure. Methods: A total of 103 KM male mice were randomly divided into three groups: antibiotic group, no antibiotic group and sham group. Antibiotic group were treated with imipenem and cilastatin; for sham group, we only open the peritoneum and then closed without therapeutic use of antibiotics. We designed a shorter incision in a new site below xiphoid, changing the dose of antibiotics after surgery and observe the survival rate after surgery. Results: Generally, among all 103 mice accepted the surgery, the survival rate of antibiotic group, no antibiotic group and sham group were with statistically difference(P=0.026). Comparison between each groups showed that: the seven days postoperative survival rate was higher in antibiotic group and no antibiotic group(P<0.001); survival rate in sham group was higher than that in no antibiotic group(P<0.001). However, the survival rate between antibiotic group and sham group has no difference(P=0.331). Cronbach’s α coefficient among 10 batches’s survival rate in antibiotic group is 0.954. Conclusion: Compared with traditional CLP one, improved model has a similar survival rate and a easy standard surgical procedure with smaller incision and a reliable result.
Key Words:Sepsis; Animal model; Surgery procedure; Cecal ligation-and-perforation; Survival rate
(收稿日期:2015-12-22)
作者简介:郭佳南,女,八年制博士在读,主要从事神经病学研究工作,Email:875641285@qq.com。△通讯作者:田林郁,女,副教授,主要从事神经重症医学临床研究工作,Email:tianlinyu@sina.com。
*基金项目:国家自然科学基金青年科学基金项目(编号:81301659)
