猪硒蛋白P基因克隆、鉴定及组织mRNA相对表达量分析
2016-04-19汤加勇何爱华周继昌刘光芒陈小玲蔡景义四川农业大学动物营养研究所成都630深圳市慢性病防治中心分子生物学实验室深圳5800
汤加勇 赵 华∗ 何爱华 周继昌 贾 刚 刘光芒 陈小玲 蔡景义(.四川农业大学动物营养研究所,成都630;.深圳市慢性病防治中心分子生物学实验室,深圳5800)
猪硒蛋白P基因克隆、鉴定及组织mRNA相对表达量分析
汤加勇1赵华1∗何爱华1周继昌2贾刚1刘光芒1陈小玲1蔡景义1
(1.四川农业大学动物营养研究所,成都611130;2.深圳市慢性病防治中心分子生物学实验室,深圳518020)
摘要:本试验旨在克隆、鉴定猪硒蛋白P基因(Sepp1),并探明其在猪不同组织中的mRNA相对表达量,为以猪为模型研究硒蛋白P(SelP)的功能奠定基础。根据表达序列标签(EST)序列设计引物,利用cDNA末端快速克隆(3′-RACE)技术从猪肝脏总RNA中扩增出含开放阅读框(ORF)至polyA片段,然后与EST序列进行拼接;采用荧光定量PCR技术考察Sepp1在猪9个组织中的mRNA相对表达量。结果显示:1)扩增出共1 707 bp的片段,测序后与EST拼接获得了2 109 bp的猪Sepp1序列,并提交至NCBI GenBank数据库,序列号为EF113596.2;该基因1 170 bp的ORF编码区和对应的氨基酸残基与人相应序列分别有83.72%和75.64%序列同源性,其编码390个氨基酸,含有14个硒代半胱氨酸(Sec)残基,分别位于第59、267、286、309、311、327、339、352、354、361、376、378、385和387位。2)Sepp1 mRNA在猪组织中广泛分布,在肝脏中具有最高分布,依次为甲状腺>肾脏>睾丸>下丘脑>脾脏>垂体>心脏>肌肉。本试验成功克隆、鉴定了猪Sepp1,检测了其在猪不同组织中表达分布情况,为其进一步以猪为模型探讨其功能奠定了基础。
关键词:猪;Sepp1;克隆;荧光定量PCR
硒(Se)是哺乳动物新陈代谢所必需的基本微量元素,其在动物的健康生长、繁殖等方面起着重要作用。Se在动物体内主要以硒蛋白的形式来发挥其多种生理功能,而硒蛋白又是一种特殊的蛋白质,它是Se以硒代半胱氨酸(selenocysteine,Sec)形式结合到蛋白质上的形成存在。Sec是第21种氨基酸,它由密码子UGA编码,而UGA在生物系统中是一终止密码子,其识别需要特殊的机制。将UGA识别为指导Sec合成的密码子,需要特殊因子的参与,如硒蛋白mRNA自身3′-非编码区(3′-UTR)的Sec插入稳定的茎-环结构硒代半胱氨酸插入序列(seleno cysteine insertion sequence,SECIS)[1-2]。在人体中分离得到了25种硒蛋白[3],它们很多是作为细胞重要的抗氧化防御系统,起着清除氧自由基的作用,具有保护生物膜完整、解毒和增强机体免疫等功能[4]。硒蛋白P (SelP)是其中一种较为特殊的硒蛋白,它主要是由肝脏分泌到血浆中的一种含硒分泌性糖蛋白,人体血浆中约50%的Se是以SelP的形式存在[5]。高等哺乳动物中硒蛋白一般只有一个Sec残基,而SelP是目前在高等生物中发现的唯一含多个Sec残基的硒蛋白[6-7]。SelP被认为在生物体内起转运和储存硒的作用[8]。
目前,虽然在人和鼠中已经通过试验探索了部分SelP的功能,但对SelP而言,在以人为模型的研究中由于不易获得有效的研究材料,使得其功能及其在代谢中的作用机理尚没有精确的科学阐明,其生物学功能也还有待于进一步的深入研究;猪与人类在营养代谢、生理结构和功能、基因同源性等方面具有较高的相似性,它已成为研究人类医学问题的一种理想模型。因此,以猪为模型研究SelP的生物学功能具有重要意义,然而猪中完整的硒蛋白P基因(Sepp1)序列还未见报道。本试验拟克隆猪Sepp1,对其基因序列进行生物信息学分析,并对其mRNA在猪不同组织中的分布情况进行分析,为进一步以猪为模型研究SelP的生物学功能奠定基础。
1 材料与方法
1.1主要仪器设备
Tetrad 2梯度PCR仪(Bio-Rad)、5804R台式高速冷冻离心机(Eppendorf)、Milli Q Plus超级纯水仪(Millipore)、凝胶成像系统GelDoc XR(Bio-Rad)、电泳仪及水平电泳槽(Bio-Rad)、Nanodrop2000微量核酸分析仪(Thermo)、7900HT荧光定量PCR仪(ABI),文中提及的其他设备、器械均为国产。
1.2主要试剂、克隆菌株及质粒
主要试剂:TRIzol Reagent购自Invitrogen公司;PrimeScriptTM逆转录试剂盒、TaqDNA聚合酶、DNA分子量标准均购自大连宝生物工程有限公司;One-step SYBR Green荧光定量试剂盒购自QIAGEN公司;引物由上海生工生物公司合成;DNA凝胶回收试剂盒、快速质粒小量提取试剂盒均购自OMEGA Bio-Tek公司。
克隆菌株及质粒:大肠杆菌(Escherichia coli)TOP10为本实验室保存,克隆载体pMD19-T购自大连宝生物工程有限公司。
1.3Sepp1的克隆与分析
通过NCBI GenBank数据库查询猪表达序列标签(expressed sequence tag,EST),获得1段疑似Sepp1的序列片段(GenBank登录号:CX065456.1),根据该片段设计Sepp1快速克隆的上游引物F1:ATCAACAAGAAGAAAACCAAACAGA,下游引物:3′-site adapter primer,采用cDNA末端快速克隆(3′-RACE)技术扩增含完整3′-端全长的Sepp1。采集新鲜“杜×长×大”(DLY)猪肝脏组织,采用TRIzol法提取总RNA,通过琼脂糖凝胶电泳和核酸测定仪检测其质量。以质量合格的总RNA为模板,以Oligo(dT)- 3′-site primer为引物,按逆转录试剂盒说明书操作合成第1链cDNA。然后以cDNA为模板,以F1和3′-site adapter primer引物对扩增获得含完整开放阅读框(ORF)至polyA的Sepp1序列。PCR反应条件为94℃变性5 min,35个循环(94℃30 s,57℃30 s,72℃2 min),然后72℃延伸10 min,4℃保存。对PCR产物进行1.5%的琼脂糖凝胶电泳,对目的片段进行胶回收(具体步骤按胶回收试剂盒说明书操作),然后将回收片段连接到pMD19-T载体上(具体步骤按克隆试剂盒说明书操作),转入TOP10感受态细胞,然后涂布含Amp 的LB平板,37℃倒置培养过夜。通过PCR对转化子进行阳性鉴定,对阳性转化子进行划线纯化并摇菌,再送上海英骏生物技术有限公司测序。利用NCBI Blast、SCEISearch 2.18等在线分析软件对克隆的基因序列进行分析并与EST序列进行拼接,确认后提交NCBI GenBank。
1.4Sepp1在猪不同组织中的相对表达量分析
DLY公猪(体重约60 kg)6只,屠宰后新鲜收集肝脏、肾脏、肌肉、甲状腺、垂体、下丘脑、心脏、睾丸、脾脏等组织,切割成1 g左右大小,装入1.5 mL离心管中(无RNA酶,Axygen,USA),液氮中保存待测。采用TRIzol法提取总RNA,用于定量分析。采用ABI Primer Express 3.0软件设计定量引物对,Sepp1定量引物对为:AACCAGAAGCGCCAGACACT和TGCTGGCATATCTCAGTTCTCAGA,看家基因Actb定量引物对为:CCCAAAGCCAACCGTGAGAA和CCACGTACATGGCTGGGGTG。引物送上海生工生物公司合成。
采用QIAGENT公司One-step SYBR Green RT-PCR Kit进行一步法实时荧光定量分析(ABI 7900HT),荧光定量PCR反应体系为10 μL,包含5.0 μL 2×SYBR Green Mix(含RT-mix)、总RNA 100 ng、上及下游引物混合液各1 μL(2 μmol/ L),每个样重复2次。RT-PCR反应条件为95℃变性30 s,48℃反转录40 min,40个循环(95℃5 s,60℃34 s),溶解曲线(95℃15 s,60℃60 s,95℃15 s)。本试验采用ΔCt相对定量方法来对不同组织基因表达量进行分析,具体方法为:以看家基因Actb作为参比基因,每一个样品中,ΔCt值是目标基因和参比基因Ct值的差值(ΔCt=Cttarget-Ctreference),以肾脏组织中目标基因表达量为标准,假定其表达量为1,其ΔCt值定为ΔCtR,其他组织样品中目标基因ΔCt值减去ΔCtR值的差值即为ΔΔCt(ΔCt-ΔCtR),根据基因PCR扩增是2n扩增的原理,则目标基因在其组织样品中的相对表达量为2-ΔΔCt。数据以平均值±标准误表示。
2 结果与分析
2.1Sepp1的克隆与分子生物学分析
以猪肝脏总RNA为模板,反转录合成第1链cDNA,利用F1和3′-RACE的方法扩增获得了1 条1 700 bp左右的目的条带(图1-A)。该片段经TA克隆到pMD19-T载体后,送上海英俊公司测序确定,然后与EST序列进行拼接,获得一段2 109 bp的cDNA序列,其含有完整的ORF和polyA结构,经分析确定其为猪Sepp1,然后提交NCBI GenBank数据库,序列号为:EF113596. 2。Sepp1经SECISearch 2.18软件分析,具有典型的硒蛋白特有的3′-UTR SECIS发夹结构(图1-B)。经NCBI Blast比对分析该基因的ORF区长1 170 bp,编码390个氨基酸,含有14个Sec残基,分别位于第59、267、286、309、311、327、339、352、354、361、376、378、385和387位,其中大部分位于C端。人SelP(NP-005401)含10个Sec,小鼠SelP(AAA42129. 2)含10个Sec,牛SelP (BAA84781.1)含12个Sec,这几个物种SelP的Sec大部分(90%以上)都分布在C-端[3,6-7]。采用SingalP 3.0 server在线软件(www.cbs.dtu.dk/ services/ singalP/)对猪SelP进行信号肽预测,结果显示其在21和22位氨基酸有可能的信号肽切割位点(图1-C)。猪Sepp1的ORF编码区与人、小鼠、牛Sepp1的ORF区的同源性分别为:83.72%、76.31%、87.02%。猪SelP的氨基酸序列与人、小鼠、牛SelP的氨基酸序列的同源性分别为:76.15%、68.70%、82.14%,序列比对见图2。

图1 猪Sepp1的克隆及基因序列分析Fig.1 Cloning and gene sequence analysis of porcine Sepp1
2.2Sepp1在猪不同组织中的相对表达量分析
采用RT-PCR对猪肝脏、肾脏、肌肉、甲状腺、垂体、下丘脑、心脏、睾丸、脾脏共9个组织进行了Sepp1的相对表达量分析,以肾脏组织的表达量为1,其他组织相对肾脏组织的相对表达量分析结果见图3。Sepp1在猪9个组织中均有mRNA表达,在肝脏中相对表达量最高,其次是甲状腺;在肝脏和甲状腺中的相对表达量均高于肾脏组织,分别是肾脏组织的6.8倍和1.7倍;在其余几个组织中的相对表达量均低于肾脏组织,在肌肉中的相对表达量最低,只有肾脏组织中相对表达量的0.01。Sepp1在猪9个组织中的相对表达量依次是肝脏>甲状腺>肾脏>睾丸>下丘脑>脾脏>垂体>心脏>肌肉。

图2 猪、牛、人、小鼠SelP氨基酸序列比对Fig.2 Alignment of the amino acid sequence of SelP among cattle,human,mouse and pig
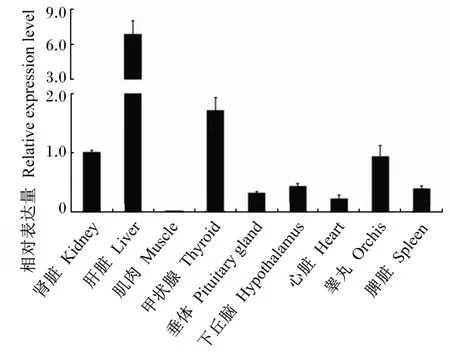
图3 猪Sepp1在猪不同组织中的相对表达量Fig.3 The relative expression level of Sepp1 in various tissues of pigs
3 讨 论
未知序列基因的克隆可根据其在不同物种间序列同源性比较,选择同源性较高的序列片段设计兼并引物,PCR扩增获得部分片段并测序分析,然后根据获得的部分基因片段信息,设计引物,采用5′-RACE和3′-RACE等方法,获得基因的完整序列。随着猪表达序列标签数据库等生物信息数据库的急剧丰富,利用在线生物信息学软件查询获得目标基因EST序列片段,特别是5′-EST序列信息,在此基础上设计引物,采用传统5′-RACE和3′-RACE等方法克隆获得基因片段并进行序列鉴定和分析,成为克隆猪硒蛋白基因的强有力手段。本试验采用传统PCR方法结合EST生物信息学分析等技术手段克隆并鉴定猪中的Sepp1,并将其提交NCBI GenBank数据库,序列号为:EF113596.2。分析猪Sepp1 CDS编码区和人Sepp1 CDS区有83.72%的同源性。经SECISearch 2.18软件分析,猪Sepp1具有硒蛋白基因特有的典型3′-UTR SECIS茎-环发夹结构。
硒蛋白是一种特殊蛋白质,是Sec以编码密码子UGA的形式掺入到合成的蛋白质中,即Sec合成进入蛋白质则是由密码子UGA介导的翻译行为,在没有特殊识别因子存在时,UGA是一个终止信号;而在有特殊识别因子时,该密码子则指导Sec合成掺入到蛋白质分子中,故Sec被认为是第21种氨基酸[9]。SelP的氨基酸序列中含有10~17 个Sec残基[6-7],人和小鼠的SelP含有10个Sec残基,牛的含12个Sec残基。本研究中对猪Sepp1编码的氨基酸序列进行分析,发现其含14 个Sec残基。SelP是一种胞外糖蛋白,是血浆硒最主要的存在形式,占血浆总硒含量的50%(人)或60%(鼠)[5-6]。采用SingalP 3.0 server在线软件(www. cbs. dtu. dk/ services/ singalP/)对猪SelP进行信号肽预测,发现其在21和22位氨基酸之间有可能的信号肽切割位点,说明该蛋白质为分泌性胞外蛋白。
硒蛋白的Sec是由UGA编码的,UGA有双重功能,既可以编码Sec,同时也可以起到终止密码子的作用,使蛋白质翻译终止,2种作用相互竞争[10]。猪SelP存在14个UGA编码的Sec,故理论上应该在任意一个Sec/ UGA处翻译终止,产生多个亚型。已有报告发现大鼠SelP有至少4个亚型,蛋白质翻译在第2个、第4个、第7个和第10 个Sec/ UGA处终止产生的N端相同,C端不同的亚型[11]。人SelP至少也有2种亚型,分别是在第2个Sec处终止只含有1个Sec的小亚型和含有10个Sec的全长SelP[12]。Takahashi等[13]的研究发现,SelP不同亚型之间的功能不一样,仅含1个Sec的小亚型有还原氧化型的低密度脂蛋白,起抗动脉硬化的作用,而位于C端的9个Sec则起转运和储存硒的作用。猪SelP是否也具有多个亚型尚不清楚。
SelP是一种富Se蛋白,它能够结合肝素并通过肝素结合于细胞膜,被广泛认为有运输硒、抗氧化、结合重金属等功能[8,14]。硒蛋白P主要表达部位是肝脏,但在其他组织部位也有表达[7],由肝脏产生的SelP分泌到血浆中,而由其他组织细胞产生的SelP则分泌到细胞间隙[15]。本研究也发现猪Sepp1的mRNA在肝脏中具有最高丰度,其次为甲状腺和肾脏。
4 结 论
①本试验成功克隆了猪Sepp1,并提交NCBI GenBank数据库,序列号为EF113596.2。
②猪硒蛋白P为分泌性蛋白,其氨基酸序列中含有14个Sec残基,在21和22位氨基酸位点具有可能的信号肽切割位点。
③RT-PCR结果显示,Sepp1在猪各种组织中均有表达,其中在肝脏中具有最高的mRNA分布,随后依次是甲状腺>肾脏>睾丸>下丘脑>脾脏>垂体>心脏>肌肉。
参考文献:
[1] LOW S C,BERRY M J.Knowing when not to stop:selenocysteine incorporation in eukaryotes[J].Trends in Biochenmical Sciences,1996,21(6):203-208.
[2] BEHNE D,KYRIAKOPOULOS A.Mammalian selenium-containing proteins[J].Annual Review of Nutrition,2001,21:453-473
[3] KRYUKOV G V,CASTELLANO S,NOVOSELOV S V,et al. Characterization of mammalian selenoproteomes[J].Science,2003,300(5624):1439-1443.
[4] MOGHADASZADEH B,BEGGS A H.Selenoproteins and their impact on human health through diverse physiological pathways[J]. Physiology(Bethesda),2006,21(5):307-315.
[5] SCHOMBURG L,SCHWEIZER U,HOLTMANN B,et al.Gene disruption discloses role of selenoprotein P in selenium delivery to target tissues[J]. The Biochemical Journal,2003,370(2):397-402.
[6] READ R,BELLEW T,YANG J G,et al. Selenium and amino acid composition of selenoprotein P,the major selenoprotein in rat serum[J].Journal of Biological Chemistry,1990,265(29):17899-17905.
[7] SAIJOH K,SAITO N,LEE M J,et al.Molecular cloning of cDNA encoding a bovine selenoprotein P-like protein containing 12 selenocysteines and a(His-Pro)rich domain insertion,and its regional expression[J]. Molecular Brain Research,1995,30(2):301-311.
[8] FAIRWEATHER-TAIT S J,COLLINGS R,HURST R.Selenium bioavailability:current knowledge and future research requirements[J]. American Journal of Clinical Nutrition,2010,91(5):1484S-1491S.
[9] KVICALA J.Selenium and the organism[J].Casopis Lekaru Ceskych,1999,138(4):99-106.
[10] GRUNDNER-CULEMANN E,MARTIN G W,TUJEBAJEVA R,et al.Interplay between termination and translation machinery in eukaryotic selenoprotein synthesis[J]. Journal of Molecular Biology,2001,310 (4):699-707.
[11] MA S G,HILL K E,CAPRIOLI R M,et al. Mass spectrometric characterization of full-length rat selenoprotein P and three isoforms shortened at the C terminus[J]. Journal of Biological Chemistry,2002,277 (15):12749-12754.
[12] ÅKESSON B,BELLEW T,BURK R F.Purification of selenoprotein P from human plasma[J].Biochimica et Biophysica Acta:Protein Structure and Molecular Enzymology,1994,1204(2):243-249.
(责任编辑武海龙)
[13] TAKAHASHI K,SAITO Y.Structure and function of human selenoprotein P[J].Seikagaku,2001,73(4):261-264
[14] HILL K E,WU S,MOTLEY A K,et al.Production of selenoprotein P(Sepp1)by hepatocytes is central to selenium homeostasis[J].Journal of Biological Chemistry,2012,287(48):40414-40424.
[15] KUROKAWA S,HILL K E,MCDONALD W H,et al.Long isoform mouse selenoprotein P(Sepp1)supplies rat myoblast L8 cells with selenium via endocy-tosis mediated by heparin binding properties and apolipoprotein E receptor-2(apoER2)[J].Journal of Biological Chemistry,2012,287(34):28717-28726.
Cloning,Identification and Tissue mRNA Relative Expression Level Analysis of Porcine Selenoprotein P Gene
TANG Jiayong1ZHAO Hua1∗HE Aihua1ZHOU Jichang2JIA Gang1LIU Guangmang1CHEN Xiaoling1CAI Jingyi1
(1. Animal Nutrition Institute,Sichuan Agricultural University,Chengdu 611130,China;2. Molecular Biology Lab,Shenzhen Center for chronic Disease Control,Shenzhen 518020,China)
Abstract:The objective of this experiment was to clone and identify porcine selenoprotein P gene(Sepp1),and investigate its mRNA relative expression level in porcine tissues for further study of its roles using pig models. Total RNA was extracted from pig liver for 3′-RACE with primer designed according to a Sepp1-like EST sequence,and assembled with the EST sequence. We further investigated the mRNA relative expression level in 9 tissues of pigs by the qPCR technology. The results showed as follows:1)1 707 bp cDNA fragment of the Sepp1 containing the open reading frame(ORF)till to its poly(A)tail was isolated,and a 2 109 bp full length cDNA was acquired. The sequence of porcine Sepp1 was submitted to NCBI GenBank with accession number of EF113596.2. The 1 170 bp ORF share an 83.72%identity to that of human,while their amino acid sequences had 75.64%identity. The ORF of porcine Sepp1 encode 390 amino acids,which has 14 selenocysteine(Sec)encoded by TGA codon,the Sec residues located at positions of 59,267,286,309,311,327,339,352,354,361,376,378,385 and 387 from N- to C-terminal of the mature SelP. 2)The Sepp1 mRNA was wildly expressed in various tissues and exhibited the highest mRNA distribution in liver,followed by thyroid,kidney,testis,hypothalamus,spleen,pituitary,heart and muscle. In conclusion,the porcine Sepp1 is cloned and identified;also its mRNA distribution in porcine tissues is investigated in present study,which offers an effective alternative to further study its biology roles using pig models.[Chinese Journal of Animal Nutrition,2016,28(3):858-863]
Key words:pig;Sepp1;clone;RT-qPCR
Corresponding author∗,associate professor,E-mail:zhua666@126.com
通信作者:∗赵 华,副研究员,硕士生导师,E-mail:zhua666@126.com
作者简介:汤加勇(1981—),男,四川乐山人,实验师,硕士,研究领域为营养与分子生物学。E-mail:410699653@qq.com
基金项目:国家自然科学基金面上项目(30871844,31272468);四川隆达畜牧科技有限公司项目(2015SCLD001)
收稿日期:2015-09-20
doi:10.3969/ j.issn.1006-267x.2016.03.027
中图分类号:S828
文献标识码:A
文章编号:1006-267X(2016)03-0858-06
