硫酸吲哚酚对内皮祖细胞增殖的影响*
2016-04-19孟华,陈岩
孟 华,陈 岩
郑州大学人民医院心血管内科 郑州 450003
硫酸吲哚酚对内皮祖细胞增殖的影响*
孟华,陈岩#
郑州大学人民医院心血管内科 郑州 450003
关键词内皮祖细胞;硫酸吲哚酚;细胞增殖;活性氧簇
摘要目的:观察肾毒性物质硫酸吲哚酚对人内皮祖细胞(EPC)增殖的影响。方法:体外培养EPC,分别用0(对照)、25、50、100和200 mg/L硫酸吲哚酚刺激24、72、120 h后,MTT法测定细胞活性;分别用0(对照)、200 mg/L硫酸吲哚酚刺激24 h后,BrdU法测定细胞增殖率,流式细胞术测定活性氧(ROS)。结果:硫酸吲哚酚体外可呈剂量和时间依赖性地抑制EPC细胞活性。200 mg/L硫酸吲哚酚作用24 h, EPC增殖受抑(P<0.05),同时细胞内ROS大量累积(P<0.05)。结论:硫酸吲哚酚可通过增加EPC细胞内ROS累积,抑制EPC增殖。
Effect of indoxyl sulfate on proliferation of endothelial progenitor cells
MENGHua,CHENYan
DepartmentofCardiology,People'sHospital,ZhengzhouUniversity,Zhengzhou450003
Key wordsendothelial progenitor cell;indoxyl sulfate;cell proliferation;reactive oxygen species
AbstractAim: To investigate the effects of uremic solute indoxyl sulfate(IS) on the proliferation of endothelial progenitor cells(EPC).Methods: EPC were isolated from healthy donors, then cultured by 0(the control),25,50,100 and 200 mg/L IS for 24,72,and 120 h, and the viability was measured by MTT method. EPC were cultured by 0(the control) and 200 mg/L IS for 24 h, then the proliferation was detected by BrdU assay, and the reactive oxygen species(ROS) accumulation was examined by flow cytometry.Results: The viability of EPC was dose- and time-dependently inhibited by IS(P<0.05). The proliferation of EPC cultured by 200 mg/L IS for 24 h was inhibited with more ROS accumulation(P<0.05).Conclusion: IS could inhibit the proliferation of EPC via ROS.
心血管疾病是尿毒症患者的首要致死因素[1],尿毒症溶质、不对称精氨酸、活性氧簇(creactive oxygen species,ROS)等循环病理物质都可能在心血管病致病过程中起到重要作用[2]。很多尿毒症患者体内存在恶化的血管内皮功能性障碍[3],然而,有关尿毒症溶质的病理学影响和致内皮功能障碍的机制仍不清楚。肾毒性物质导致细胞损伤的机制主要包括炎症反应加剧、细胞凋亡和纤维化等。内皮祖细胞(endothelial progenitor cells,EPC)是血管内皮细胞前体干细胞,在促进血管新生,促进受损血管恢复和缺血组织再血管化方面发挥了重要作用[4]。相关研究[5]结果显示,循环EPC数量和功能随着慢性肾功能不全的进展而下降,其可能受到肾毒性物质的影响。因此,作者对肾毒性物质硫酸吲哚酚对EPC增殖活性的影响及可能的分子机制进行了探讨。
1材料与方法
1.1EPC的分离、培养和鉴定收集门诊健康自愿捐献者外周血20 mL,符合医学伦理委员会要求,均签署知情同意书。密度梯度离心法分离单个核细胞,按1×106mL-1接种于预包被人纤维粘连蛋白的6孔板中,细胞培养液为M199培养液[含有体积分数10%胎牛血清,EGM SingleQuot(Clonetics, Walkersville, USA),青霉素100 U/mL,链霉素100 mg/L]。培养48 h后,更换培养液,去除未贴壁细胞。每2 d更换培养液。7~20 d后可见铺路石样细胞集落出现,采用细胞免疫荧光法进行鉴定:细胞培养至90%密度时,加入2.4 mg/L Dil标记的乙酰化低密度脂蛋白(Dil-ac-LDL,Invitrogen公司),37 ℃孵育1 h;多聚甲醛固定30 min, PBS漂洗3次; 加入10 mg/L FITC标记的荆豆凝集-1(FITC-UEA-1,Sigma公司),37 ℃孵育1 h, PBS漂洗3次,荧光显微镜下观察。
1.2硫酸吲哚酚对EPC活性影响的观察收集对数生长期细胞,按照1×104mL-1接种于96孔板。参考慢性肾病患者血浆硫酸吲哚酚水平[6], 分别用0(对照)、25、50、100和200 mg/L硫酸吲哚酚刺激24、72、120 h后,MTT法测细胞活性,酶联免疫检测仪测定490 nm波长处的吸光度(A),每组设定3个复孔。细胞活性=(实验组A-本底A)/(对照A-本底A)×100%。
1.3硫酸吲哚酚对EPC增殖能力影响的观察收集对数生长期细胞,按1×104mL-1接种于96孔板中,细胞贴壁6 h, 用200 mg/L硫酸吲哚酚刺激24 h后去除上清;每孔加200 μL固定液室温孵育30 min,去上清;加入100 μL BrdU抗体(Invitrogen)室温孵育1 h,漂洗3次;加入100 μL二抗室温孵育30 min,漂洗3次;加入底物100 μL,室温孵育15 min;加入100 μL终止反应液孵育15 min;在酶联免疫检测仪450~540 nm波长处测量A,以测定值表示细胞增殖率。
1.4硫酸吲哚酚对ROS影响的观察细胞培养至第3代,按1×105mL-1接种于6孔板中,加入200 mg/L硫酸吲哚酚刺激24 h,去除细胞培养液,使用温浴(37 ℃)的HBSS轻轻冲洗细胞2遍,加入25 μmol/L的carboxy-H2DCFDA(Invitrogen)37 ℃避光孵育60 min,孵育结束前10 min加入Hoechst33342(1.0 μmol/L),用温浴(37 ℃)的HBSS冲洗细胞2遍,荧光显微镜下观察,消化细胞,使用流式细胞术检测细胞荧光强度,以此定量ROS的表达。
1.5统计学处理采用SPSS 16.0进行分析,EPC活性的比较采用4×3析因设计的方差分析,细胞增殖率和ROS含量的比较采用两独立样本t检验,检验水准α=0.05。
2结果
2.1EPC的分离及鉴定单个核细胞培养15~20 d后,可见铺路石状细胞集落形成并具有内皮细胞特征。荧光显微镜下可见,Dil-ac-LDL阳性(红色荧光)及FITC-UEA-1阳性(绿色荧光)细胞,即为EPC(图1)。
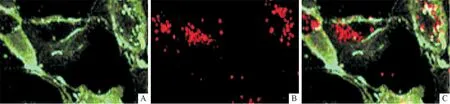
A:FITGUEA-1;B:Dil-ac-LDL;C:双染。图1 EPC荧光染色鉴定
2.2硫酸吲哚酚对EPC细胞活性的影响见表1。不同质量浓度硫酸吲哚酚刺激EPC相同时间后,细胞活性逐渐下降(P<0.05);相同质量浓度硫酸吲哚酚刺激EPC 24、72、120 h后,细胞活性亦逐渐降低(P<0.05)。
2.3硫酸吲哚酚对EPC增殖和ROS含量的影响
见图2、表2。200 mg/L硫酸吲哚酚刺激EPC 24 h后,细胞增殖率降低,ROS大量累积。

表1 各组EPC活性测定结果 %
F时间=11.341,F浓度=8.624,P均<0.001;F交互=0.766,P=0.404。

图2 荧光显微镜下0(上排)和200(下排) mg/L硫酸吲哚酚组EPC中ROS的累积情况

组别n增殖率ROS含量0mg/L硫酸吲哚酚组33.35±0.1088±3200mg/L硫酸吲哚酚组31.83±0.04108±8t26.7314.054P<0.0010.015
3讨论
心血管疾病是慢性肾功能不全患者的首要死因[7-8]。慢性肾病患者血管内皮功能紊乱,修复能力降低,与其循环EPC数量减少、功能减弱有着密切的关系[9],并且循环EPC数量随着肾毒性物质的蓄积而减少[10-11]。慢性肾病的许多毒性物质可能参与抑制EPC,对血管内皮功能造成损害,但是仍缺乏直接证据。硫酸吲哚酚是肠菌类异化色氨酸的代谢产物,其血清水平在慢性肾功能衰竭患者体内显著增加,并且经血液透析去除量较少。已有研究[12]表明硫酸吲哚酚能够抑制内皮增殖和体外伤口的恢复。硫酸吲哚酚可使人近端肾小管上皮细胞(HK-2细胞)发生氧化应激, 产生大量氧自由基产物,导致HK-2细胞损伤,加速细胞凋亡,加速肾功能减退[13]。肾小球系膜细胞的氧化还原状态与有丝分裂原激活蛋白酶及细胞增生有关。硫酸吲哚酚的肾毒性还表现在破坏肾脏的抗氧化能力,它可促进肾小球系膜细胞内ROS的产生和降低超氧化物歧化酶(SOD)的表达,致使超氧化物清除能力降低,加速肾小球系膜细胞凋亡, 从而损伤肾小球[14]。该研究结果显示硫酸吲哚酚体外可剂量和时间依赖性抑制EPC活性和增殖能力,增加EPC中ROS的累积,而ROS累积可能是硫酸吲哚酚影响EPC细胞活性的重要因素。
硫酸吲哚酚是透析后未能有效去除的蛋白结合尿毒症溶剂,血液透析治疗仅可去除30%,因此需要采用其他方案来去除这些尿毒症溶剂。研究[15]显示,口服吸附剂AST-120能够降低患者体内硫酸吲哚水平。其他如缩减蛋白质消耗等方法也可以降低硫酸吲哚的血清水平。然而这些方案对尿毒症患者的影响仍旧未知。该研究结果显示,ROS累积可能是硫酸吲哚酚影响EPC细胞活性的重要因素,这必将为慢性肾功能不全并心血管疾病的治疗提供新的思路。
参考文献
[1]KUWAHARA M,TAKEHARA E,SASAKI Y,et al. Effects of cardiovascular events on end stage renal disease and mortality in patients with chronic kidney disease before dialysis[J/OL].Ther Apher Dial,2015[2015-12-17].DOI:10.1111/1744-9987-12332.
[2]ROBERTS MA, HARE DL, RATNAIKE S, et al. Cardiovascular biomarkers in CKD:pathophysiology and implications for clinical management of cardiac disease [J].Am J Kidney Dis,2006,48(3):341
[3]JABLONSKI KL,DECKER E,PERRENOUD L,et al.Assessment of vascular function in patients with chronic kidney disease[J].J Vis Exp,2014,3(88):1296
[4]SIEVEKING DP,BUCKLE A,CELERMAJER DS, et al. Strikingly different angiogenic properties of endothelial progenitor cell subpopulations[J].J Am Coil Cardiol,2008,51(6):660
[5]CHEN YT,CHENG BC,KO S,et al.Value and level of circulating endothelial progenitor cells, angiogenesis factors and mononuclear cell apoptosis in patients with chronic kidney disease[J]. Clin Exp Nephrol, 2013,17(1):83
[6]DOU L,BERTRAND E,CERINI C,et al.The uremic solutes p-cresol and indoxyl sulfate inhibit endothelial proliferation and wound repair[J].Kidney Int,2004,65(2):442
[7]GO AS,CHERTOW GM,FAN Dongjie,et al.Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization[J].N Engl J Med,2004,351(13):1296
[8]SUMMARIA F,MANCA DI VILLAHERMOSA S,TEDESCO M,et al.Cardiovascular outcome in asymptomatic hemodialysis patients submitted to aggressive medical therapy: results of a four-year follow-up[J].Minerva Cardigangiol,2011,59(2):121
[9]KRENNING G,DANKERS PY,DROUVEN JW,et al.Endothelial progenitor cell dysfunction in patients with progressive chronic kidney disease[J].Am J Physiol Renal Physiol,2009,296(6):F1314
[10]HERBRIG K,PISTROSCH F,FOERSTER S,et al.Endothelial progenitor cells in chronic renal insufficiency[J].Kidney Blood Press Res,2006,29(1):24
[11]JOURDE-CHICHE N,DOU L,SABATIER F,et al.Levels of circulating endothelial progenitor cells are related to uremic toxins and vascular injury in hemodialysis patients[J].J Thromb Haemost,2009,7(9):1576
[12]YU M, KIM YJ, KANG DH. Indoxyl sulfate-induced endothelial dysfunction in patients with chronic kidney disease via an induction of oxidative stress[J].Clin J Am Soc Nephrol,2011,6(1):30
[13]Motojima M,Hosokawa A,Yamato H,et al. Uraemic toxins induce proximal tubular injury via organic anion transporter 1-mediated uptake[J].Br J Pharmacol,2002,135(2):555
[14]OWADA S,GOTO S,BANNAI K,et al.Indoxyl sulfate reduces superoxide scavenging activity in the kidneys of normal and uremic rats[J].Am J Nephrol,2008,28(3):446
[15]NIWA T,ISE M,MIYAZAKI T,et al.Suppressive effect of an oral sorbent on the accumulation of p-cresol in the serum of experimental uremic rats[J].Nephron,1993,65(1):82
中图分类号R543.2
#通信作者,男,1964年9月生,本科,主任医师,研究方向:冠心病的诊断及治疗,E-mail:hnsrmyycy@163.com
doi:10.13705/j.issn.1671-6825.2016.02.029
*河南省科技厅基础与前沿技术研究计划项目142300410264
