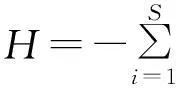8种豆科灌木栽培种丛枝菌根真菌种类及分布
2016-04-18姚红艳莫本田龙忠富
吴 涛,姚红艳,莫本田,龙忠富,罗 充
(1.贵州师范大学生命科学学院,贵州 贵阳 550001; 2.贵州大学动物科学学院,贵州 贵阳 550025;
3.贵州省草业研究所,贵州 贵阳 550006)
8种豆科灌木栽培种丛枝菌根真菌种类及分布
吴 涛1,姚红艳2,莫本田3,龙忠富3,罗 充1
(1.贵州师范大学生命科学学院,贵州 贵阳 550001; 2.贵州大学动物科学学院,贵州 贵阳 550025;
3.贵州省草业研究所,贵州 贵阳 550006)
摘要:采集人工栽培决明(Cassia tora)、假木豆(Dendrolobium triangulare)、紫穗槐(Amorpha fruticosa)、白刺花(Sophora davidii)、猪屎豆(Crotalaria pallida)、多花木蓝(Indigofera amblyantha)、木豆(Cajanus cajan)和银合欢(Leucaena leucocephala)8种豆科灌木植物根际5-10、10-20和20-30 cm 3个土层的土样,研究其根际丛枝菌根(AM)真菌的侵染率、孢子密度、种类及多样性。结果表明,8种豆科灌木植物AM真菌侵染率普遍较高,最高的为猪屎豆,80.8%;土壤速效磷含量与侵染率呈显著负相关(r=-0.733,P=0.039);根际土壤中的AM真菌孢子主要分布于5-20 cm土层,5-10 cm土层猪屎豆孢子密度最大,为115.33个·10 g(-1)土壤;宿主植物种类与土壤层位对孢子密度交互效应影响显著(F=100.497,P<0.001);AM真菌优势种枫香球囊霉(Glomus liquidambaris)、脆无梗囊霉(Acaulospora delicate)在8种豆科灌木植物的土壤中均有分布。本研究表明,喀斯特地区适生豆科灌木植物具有丰富的AM真菌资源,今后可以在喀斯特地区开展豆科灌木植物接种优势AM真菌和根瘤菌等相关研究,这将对农牧业生产和退化生态系统修复效应的影响具有重要意义。
关键词:豆科灌木植物;丛枝菌根真菌;侵染率;多样性
丛枝菌根(Arbuscular Mycorrhiza,AM)真菌能与绝大多数陆生高等植物根系形成共生体系[1],该共生体系能够促进宿主植物生长发育、改善土壤理化性状、促进生态系统养分循环,提高植物对病害、贫瘠、盐胁迫、铝毒及重金属污染的抗性[2-5]。研究发现,豆科植物根际土壤中存在大量的AM真菌资源,在它们的长期进化过程中与豆科植物形成了“AM真菌-豆科植物-根瘤菌”的共生关系[6-7]。因此,通过利用菌根系统独特的生理生态功能,豆科植物与菌根技术相结合被广泛应用于植树造林、矿区植被的恢复和退化生态系统的植被重建等方面[8-11]。
在喀斯特地区,随着石漠化现象日趋严重,对植物的生长发育影响严重,同时给石漠化治理带来很大困难,石漠化已成为喀斯特地区最严重的地质灾害和生态灾害[12]。在喀斯特地区石漠化生态修复过程中,豆科灌木利用其植株的高大,耐贫瘠,营养丰富,抗逆性和适应性强的特点,成为了在该地区农林牧业生产和生态治理的宝贵植物资源,在该地区畜牧业生产和生态恢复方面被广泛的推广应用。豆科植物可以同时与根瘤菌及AM真菌良好共生,接种AM真菌和根瘤菌能在一定程度上促进宿主植物的生长,提高植物抗逆性和抗病性[13-17],对豆科植物的生存竞争十分有利。目前国内外针对豆科灌木的AM真菌研究,主要集中于资源分布以及宿主植物接种效应和矿区修复等方面[6-17],而针对喀斯特地区适生豆科灌木的AM真菌资源方面的研究较少。因此,本研究选择在喀斯特地区推广利用价值较高的人工栽培决明(Cassiatora)、假木豆(Dendrolobiumtriangulare)、紫穗槐(Amorphafruticosa)、白刺花(Sophoradavidii)、猪屎豆(Crotalariapallida)、多花木蓝(Indigoferaamblyantha)、木豆(Cajanuscajan)、银合欢(Leucaenaleucocephala)8种豆科灌木植物,调查其AM真菌资源,希望对该8种豆科灌木植物在喀斯特地区农林牧业生产和生态治理方面具有积极作用,对辅助喀斯特地区石漠化治理有重要价值。
1材料与方法
1.1材料
2013年9月在贵州省草业研究所金竹试验基地(26°30′36.38″ N、106°39′20.14″ E,海拔1 148.7 m)采样,土壤类型为黄壤,该区域属于高原季风湿润气候,雨量充沛,湿度较大,年平均气温为12~15 ℃,年降水量1 000~1 200 mm。8种豆科植物根际土壤及毛细根按照“五点采样法”进行采集,选取长势良好的植株,首先去除土壤5 cm的表层杂物,按5-10、10-20和20-30 cm分层收集根际土壤1~2 kg,分别装入采集袋并标注标签,土壤样品风干后经0.5 mm筛保存,从每层土样中各取200 g土壤混匀保存进行理化分析备用。同时收集各种豆科植物的根样,放入装有标准固定液(FAA固定液)密封袋并标注标签,放入自制冰盒中带回实验室置于4 ℃条件下保存备用。
1.2试验方法及相关计算
1.2.1AM真菌侵染率统计方法取出根样,将其剪成1 cm长的小段。采用碱解离酸性品红染色法观测菌根侵染情况,步骤采用Komanik等[18]的方法:净化、清洗、酸化、染色、脱色、制片、镜检。根段染色之后,在显微镜下观察每条根段的侵染情况和菌丝体形态,根据每条被侵染形成菌根的根段长度占根段总长度的百分比,按照0、10%、20%、……、100%估算每条根段的侵染率,共统计100根,重复3次。镜检统计侵染程度并按以下公式计算侵染率:
菌根侵染率=[∑(0×根段数+10%×根段数+20%×根段数+30%×根段数+……+100%×根段数)/观察总根段数]×100%。
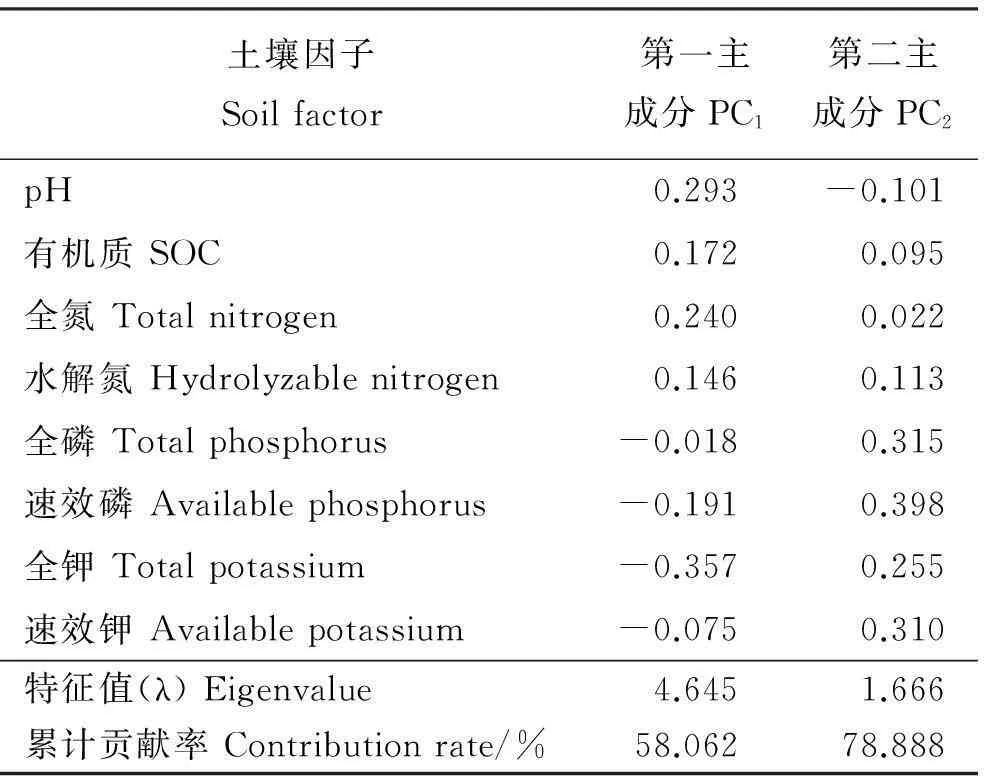
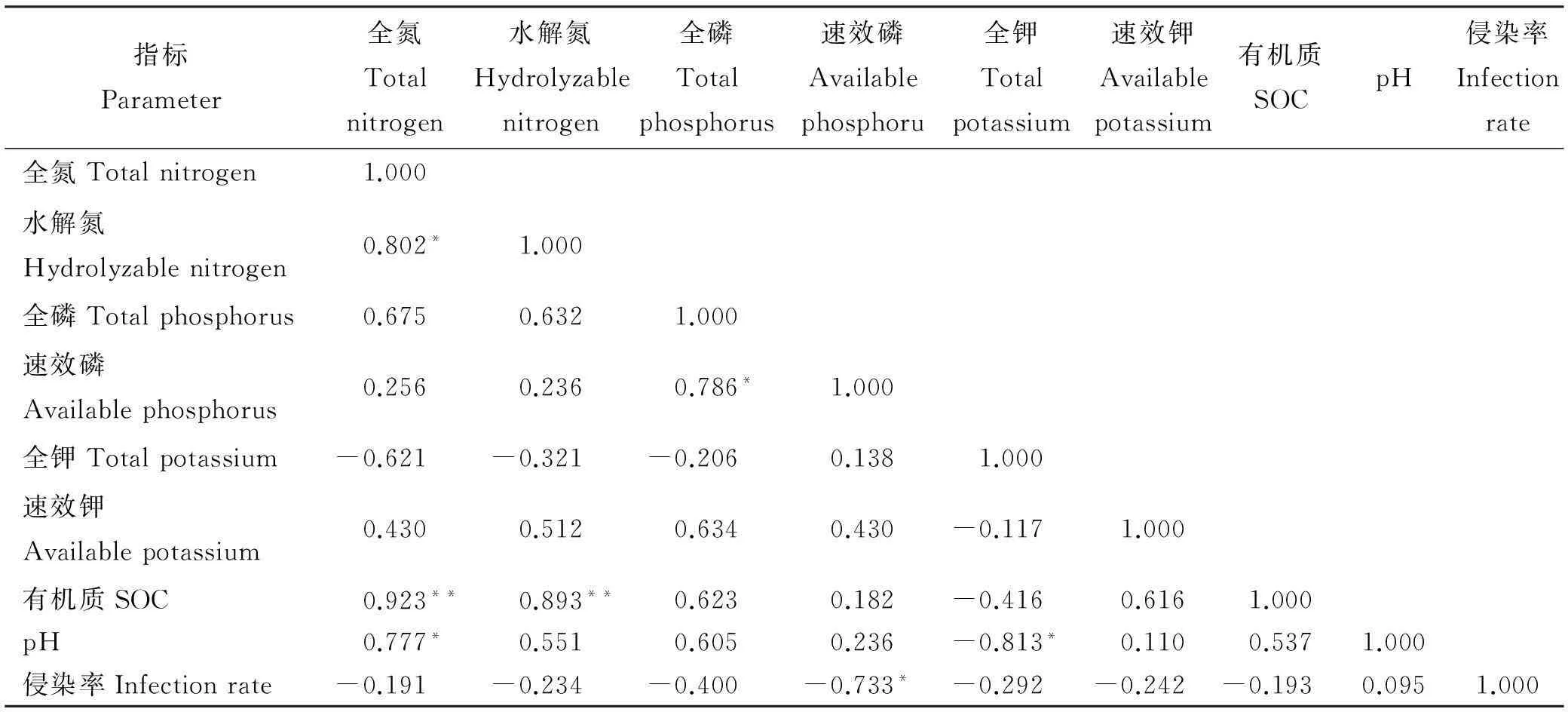
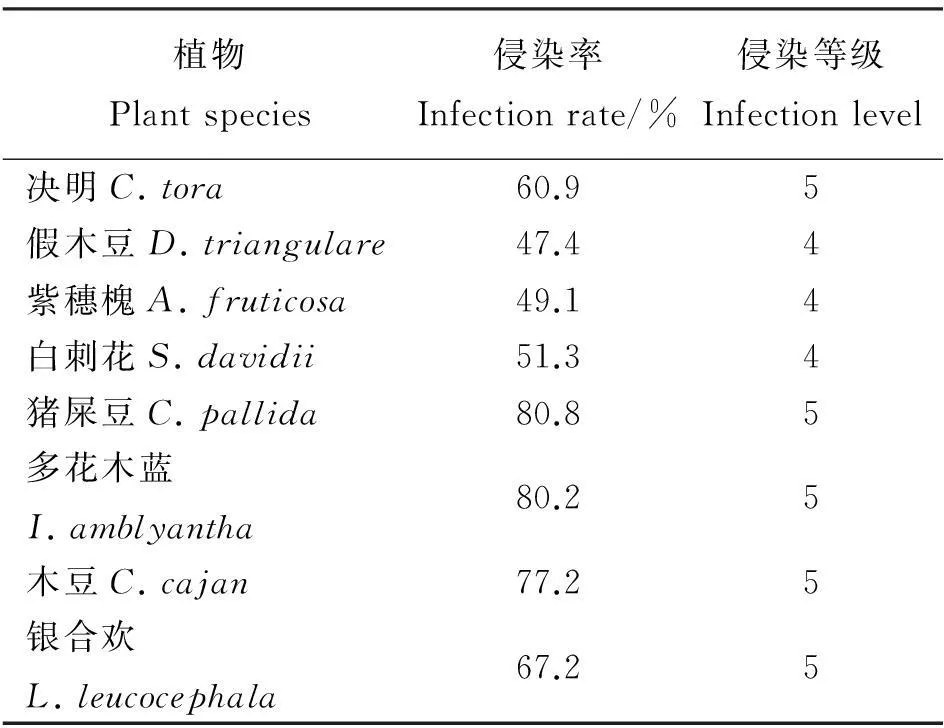
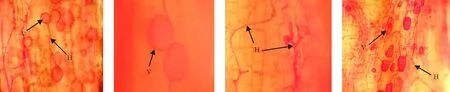
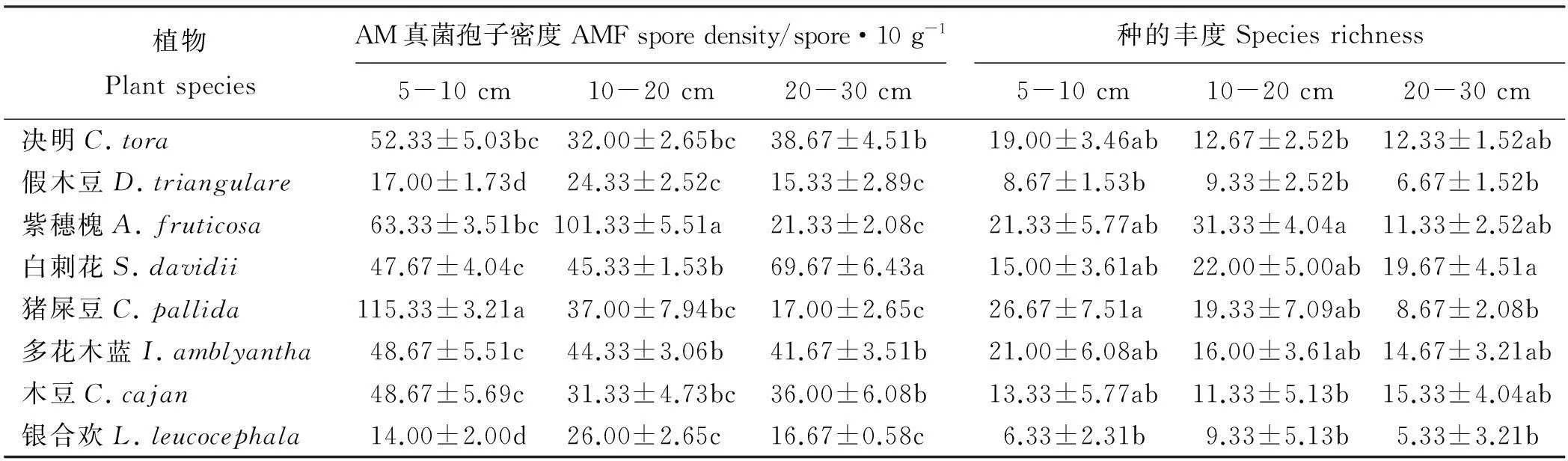
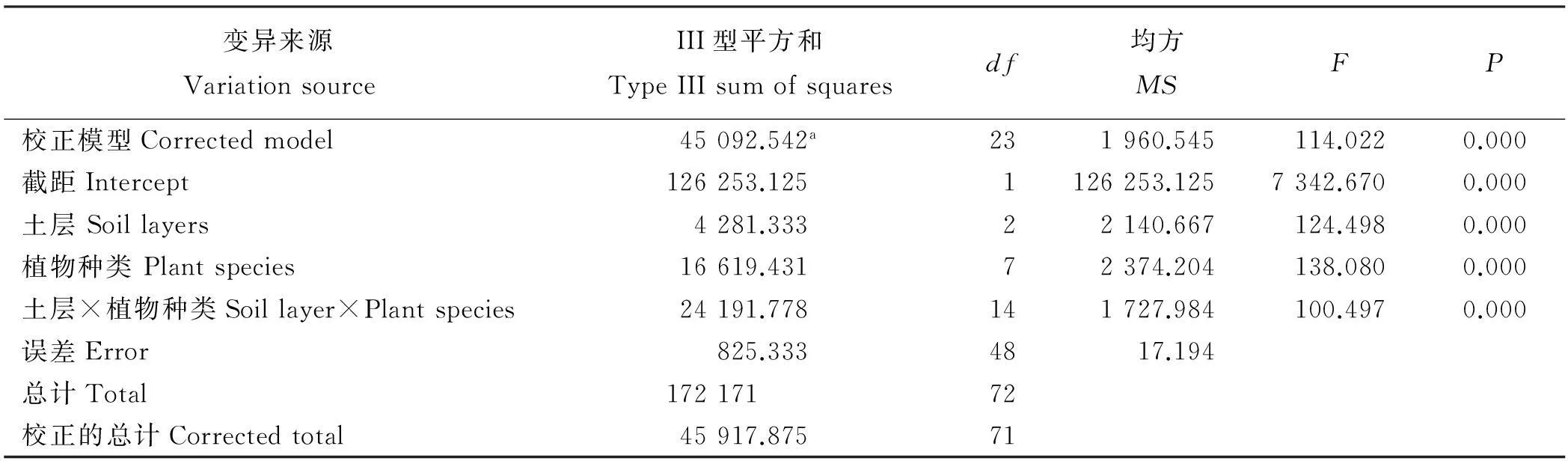
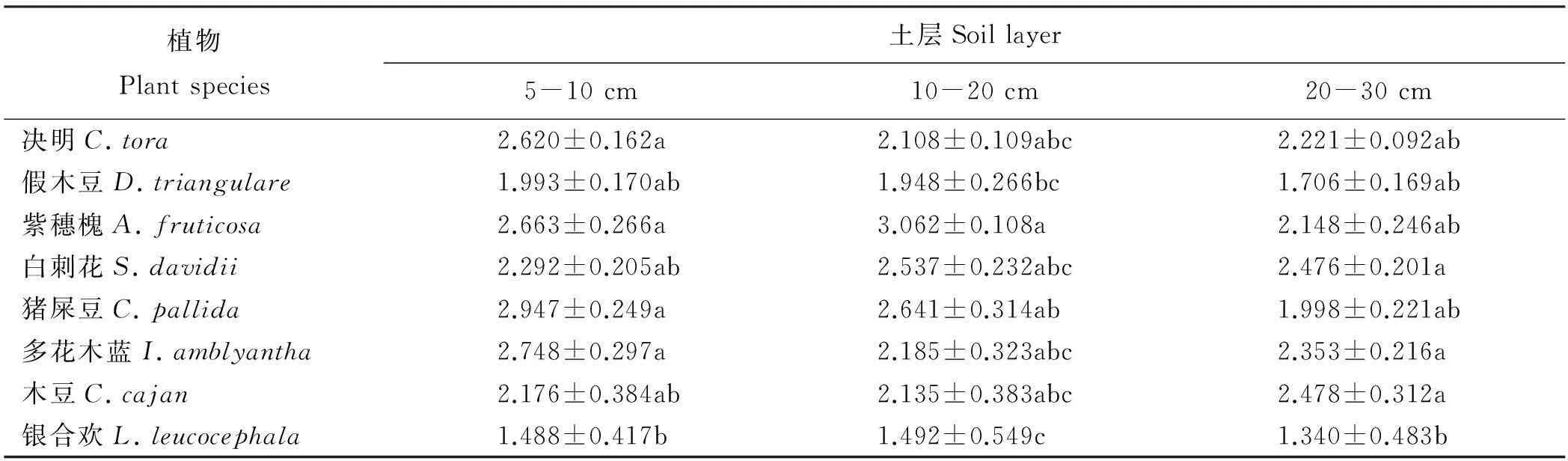
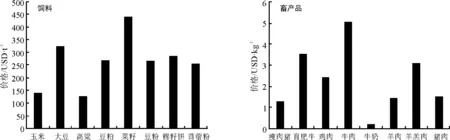
根据菌根侵染率的高低将其分为5个等级:1级(0≤侵染率 1.2.2AM真菌孢子分离与鉴定方法取10 g风干土壤,用湿筛倾析-蔗糖离心法分离AM真菌孢子[19];将选取的孢子置于显微镜下根据颜色、大小、形态和纹饰等进行分类。鉴定中辅助使用Melzer’s试剂,观察孢子的特异反应。综合以上观察结果,根据Scheck的“VA菌根鉴定手册”和国际丛枝菌根真菌保藏中心(INVAM)在Internet上http://invam.caf.wvu.edu提供的种的描述及图片[20],并参阅有关鉴定材料和近年来发表的新种的相关报道等进行种属检索、鉴定。 1.2.3AM真菌孢子密度和多样性相关指标计算方法孢子密度(Spore Number,SN)指10 g土样数中AM真菌的孢子个数[1]。SN=某土样中AM真菌所有孢子数/土样数。种丰度(Species Richness)指10 g土样含有的AM真菌种数。分离频度( Frequency,F)指AM某属或种在样本总体中出现的频度,F=(AM真菌某属或种出现的次数/土样数)×100%。相对多度(Relative Abundance,RA)指该采样点AM真菌某属或种的孢子数占总孢子数的比率,RA=(该采样点AM真菌某属或种的孢子数/该采样点AM真菌总孢子数)×100%。将AM真菌的优势度按分离频度(F)分为5个等级: F>80%为优势属(种),60% 本研究的物种多样性指数采用Shannon-Wiener指数(H)来描述,其公式如下: 式中,S为土样中AM真菌的种类数,Pi为种i所占的比例,H用平均值±标准差表示。 1.2.4AM真菌孢子根际土壤理化分析方法土壤全氮、水解氮、全磷、速效磷、全钾、速效钾、有机质、pH按《土壤农化分析与环境监测》所述方法进行测定[21]。 1.3数据分析 采用Excel软件进行数据整理,SPSS17.0软件进行相关性分析、单因素方差分析、多因素方差分析、主成分分析。 2结果 2.1宿主植物土壤环境与菌根侵染率分析 利用SPSS17.0软件对8个样地8个土壤因子进行主成分分析,根据相关矩阵特征值大于1,方差累计贡献率大于75%的原则,选择两个主成分。结果表明,选择两个主成分累积方差贡献率为78.888%(表1),能基本反映土壤因子的指标信息。第一主成分中,全钾具有较高载荷(权重为-0.357),第二主成分中,速效磷具有较高载荷(权重为0.398)。对菌根侵染率与根际土壤速效磷、全钾进行相关分析发现(表2),速效磷的含量与侵染率存在显著负相关(r=-0.733,P=0.039),全钾与侵染率没有表现出显著相关性。8种不同豆科灌木植物根系均发现被AM菌根侵染(表3),且菌根侵染率普遍较高,侵染等级多为4、5级,8种豆科灌木植物的菌根侵染率平均为64.26%,其中侵染率最高的为猪屎豆80.8%,侵染等级5级;最低为假木豆47.4%,侵染等级4级。8种豆科灌木植物中泡囊和菌丝是AM真菌侵染的主要形式如图1所示。 表1 主成分载荷矩阵、特征值和贡献率 2.2豆科植物AM真菌孢子鉴定与AM真菌多样性 2.2.1AM真菌孢子密度不同宿主植物中AM真菌孢子密度存在差异,不同宿主植物的AM真菌孢子密度最大值也存在差异,5-10 cm土层中猪屎豆的AM真菌孢子密度显著高于同层其它植物(P<0.05),为115.33个·10 g-1土壤(表4);10-20 cm土层中紫穗槐的AM真菌孢子密度显著高于其它植物,为101.33个·10 g-1土壤;20-30 cm土层中白刺花的AM真菌孢子密度显著高于其它植物的(P<0.05),为69.67个·10 g-1土壤。多因素方差分析发现,宿主植物与土壤层位对孢子密度交互效应显著(F=100.497,P<0.001,表5),进一步通过简单效应检验分析发现:同一土层不同宿主植物对孢子密度影响显著;宿主植物多花木蓝的不同土层对孢子密度影响不显著(F=2.178,P>0.05),其它宿主植物不同土层对孢子密度的影响显著(P<0.05)。 表2 侵染率与土壤理化性质相关性分析 注:**和*分别表示在0.01和0.05水平上显著相关。 Note: ** and * are significant correlation at 0.01 and 0.05 level, respectively. 表3 8种植物菌根侵染率 2.2.2AM真菌的种类及多样性指数本研究共分离、鉴定出AM真菌孢子4个属79种,球囊霉属(Glomus)49种,无梗囊霉属(Acaulospora)26种,多孢囊霉属(Paraglomus)1种,盾巨孢囊霉属(Scutelospora)3种。通过对各个层位土壤AM真菌种的丰度调查发现(表4),AM真菌种类最丰富的为紫穗槐10-20 cm土层(种丰度为31.33)和猪屎豆5-10 cm土层(种丰度为26.67)。在8种豆科植物根际土壤中分离出的AM真菌优势种能在4种豆科灌木植物以上均有分布,其中在5-20 cm土层,优势种枫香球囊霉(G.liquidambaris)、脆无梗囊霉(A.delicate)在7种植物中均有分布,在20-30 cm土层中8种植物均有分布(表6)。 8种植物的AM真菌各层的多样性指数存在差异,其中AM真菌物种多样性最丰富为紫穗槐10-20 cm土层(H=3.062);最低的为银合欢20-30 cm土层(H=1.340)(表7)。从3个不同的土层分析,5-10cm土层的平均多样性指数最高,则该土壤层AM真菌物种多样性最丰富,随着土壤深度的增加,平均多样性指数在降低,物种多样性减少。 图1 AM真菌菌丝(H)、泡囊(V)(400×) 植物PlantspeciesAM真菌孢子密度AMFsporedensity/spore·10g-15-10cm10-20cm20-30cm种的丰度Speciesrichness5-10cm10-20cm20-30cm决明C.tora52.33±5.03bc32.00±2.65bc38.67±4.51b19.00±3.46ab12.67±2.52b12.33±1.52ab假木豆D.triangulare17.00±1.73d24.33±2.52c15.33±2.89c8.67±1.53b9.33±2.52b6.67±1.52b紫穗槐A.fruticosa63.33±3.51bc101.33±5.51a21.33±2.08c21.33±5.77ab31.33±4.04a11.33±2.52ab白刺花S.davidii47.67±4.04c45.33±1.53b69.67±6.43a15.00±3.61ab22.00±5.00ab19.67±4.51a猪屎豆C.pallida115.33±3.21a37.00±7.94bc17.00±2.65c26.67±7.51a19.33±7.09ab8.67±2.08b多花木蓝I.amblyantha48.67±5.51c44.33±3.06b41.67±3.51b21.00±6.08ab16.00±3.61ab14.67±3.21ab木豆C.cajan48.67±5.69c31.33±4.73bc36.00±6.08b13.33±5.77ab11.33±5.13b15.33±4.04ab银合欢L.leucocephala14.00±2.00d26.00±2.65c16.67±0.58c6.33±2.31b9.33±5.13b5.33±3.21b 注:同列不同小写表示相同土层不同物种间差异显著(P<0.05)。 Note:Different lower case letters within the same column mean significant difference among different species in the same soil depth at 0.05 level. 表5主体间的效应检验 Table 5Tests of between-subjects effects 因变量Dependent variable:孢子密度Spore density 变异来源VariationsourceIII型平方和TypeIIIsumofsquaresdf均方MSFP校正模型Correctedmodel45092.542a231960.545114.0220.000截距Intercept126253.1251126253.1257342.6700.000土层Soillayers4281.33322140.667124.4980.000植物种类Plantspecies16619.43172374.204138.0800.000土层×植物种类Soillayer×Plantspecies24191.778141727.984100.4970.000误差Error825.3334817.194总计Total17217172校正的总计Correctedtotal45917.87571 a,R2=0.982(调整AdjustedR2=0.973)。 3讨论 AM真菌对宿主植物根的侵染率受宿主植物、土壤环境等诸多因素的影响[22-24]。本研究结果表明,8种人工栽培豆科植物AM真菌侵染率普遍较高,平均侵染率为64.26%,侵染率较高的为猪屎豆(80.80%)和多花木蓝(80.20%)。不同宿主植物中AM真菌的侵染率存在差异,AM真菌侵染植物受到不同宿主植物所处的具体生境的影响较大,对宿主植物没有严格的专一性[22-24]。通过主成分分析发现,全钾和速效磷是主要影响因子,经过相关分析发现,AM真菌的侵染率与速效磷的含量存在显著负相关(r=-0.733,P=0.039),与任爱天等[25]研究结果一致,表明AM真菌的侵染可以显著改善低磷土壤中宿主植物对磷营养的吸收[26-27]。 8种豆科灌木植物AM真菌垂直分布存在差异,但AM真菌孢子分布主要集中于5-20 cm土层。猪屎豆与多花木蓝的孢子密度变化规律表现为随着土壤深度的增加而降低,这种变化规律与许伟等[28]、刘春卯等[29]研究结果一致,其中最大孢子密度位于5-10 cm土层,猪屎豆115.33个·10 g-1土壤;假木豆、紫穗槐、银合欢的在5-20 cm土层孢子密度变化表现为当土壤深度达到20 cm时达到峰值,10-20 cm土层中紫穗槐AM真菌孢子密度最大,为101.33个·10 g-1土壤;决明、白刺花、木豆的孢子密度则是随着土壤深度的增加先降低后升高,20-30 cm土层中白刺花AM真菌孢子密度为69.67个·10 g-1土壤;通过效应分析发现,宿主植物种类与土壤层位交互效应显著,同一土层不同宿主植物和同一宿主植物不同土层对孢子密度影响显著,以上结果表明,喀斯特地区豆科灌木植物能与AM真菌形成共生关系。 表7 8种植物AM真菌多样性指数 Table 7 The species diversity of arbuscular mycorrhizal fungi genera 植物Plantspecies土层Soillayer5-10cm10-20cm20-30cm决明C.tora2.620±0.162a2.108±0.109abc2.221±0.092ab假木豆D.triangulare1.993±0.170ab1.948±0.266bc1.706±0.169ab紫穗槐A.fruticosa2.663±0.266a3.062±0.108a2.148±0.246ab白刺花S.davidii2.292±0.205ab2.537±0.232abc2.476±0.201a猪屎豆C.pallida2.947±0.249a2.641±0.314ab1.998±0.221ab多花木蓝I.amblyantha2.748±0.297a2.185±0.323abc2.353±0.216a木豆C.cajan2.176±0.384ab2.135±0.383abc2.478±0.312a银合欢L.leucocephala1.488±0.417b1.492±0.549c1.340±0.483b 注:同列不同小写表示差异显著(P<0.05)。 Note:Different lower case letters in the same column mean significant difference at 0.05 level. 综合3个不同的土层AM真菌孢子种丰度和多样性指数结果表明,8种豆科灌木植物根际土壤共分离出4属79种AM真菌,豆科灌木植物(除白刺花、木豆外)的AM真菌种丰度[29]和多样性指数随土壤深度的增加而降低;同一土层不同宿主植物AM真菌孢子种类存在一定差异,紫穗槐10-20 cm土层的种丰度(31.33)和多样性指数(H=3.062)均为最高。豆科植物的AM真菌物种多样性较丰富,表明豆科植物具有丰富的AM真菌资源[6-7,25],对喀斯特地区豆科灌木在农牧业生产和石漠化生态修复植被建植方面具有重要意义。本研究筛选出AM真菌优势种枫香球囊霉、黄球囊霉、近明球囊霉、明球囊霉、孢果无梗囊霉、脆无梗囊霉、瑞氏无梗囊霉、细凹无梗囊霉、皱壁无梗囊霉能与8种豆科灌木植物形成良好的共生关系。本研究结果有助于通过进一步筛选得出与8种豆科植物相互匹配的优势AM真菌,为今后开展豆科灌木植物接种优势AM真菌和根瘤菌在喀斯特地区进行农业生产推广和退化生态系统修复效应的研究提供了理论依据和试验基础。 参考文献(References) [1]刘润进,陈应龙.菌根学.北京:科学出版社,2007. Liu R J,Chen Y L.Mycorrhizology.Beijing:Science Press,2007.(in Chinese) [2]Bolan N S.A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants.Plant and Soil,1991,134(2):189-208. [3]Borowicz V A.Do arbuscular mycorrhizal fungi alter plant pathogen reactions.Ecology,2001,82(11):3057-3068. [4]杨海霞,徐萌,刘宁,郭绍霞.丛枝菌根真菌对两种草坪草耐盐性的影响.草业科学,2014,31(7):1261-1268. Yang H X,Xu M,Liu N,Guo S X.Effects of arbuscular mycorrhizal fungi on salinity tolerance of two turfgrass.Pratacultural Science,2014,31(7):1261-1268.(in Chinese) [5]林双双,孙向伟,王晓娟,李媛媛,罗巧玉,孙莉,金樑.AM真菌提高素质植物耐受重金属胁迫的生理机制.草业科学,2013,30(3):365-374. Lin S S,Sun X W,Wang X J,Li Y Y,Luo Q Y,Sun L,Jin L.Mechanism of plant tolerance to heavy metals enhanced by arbuscular mycorrhizal fungi.Pratacultural Science,2013,30(3):365-374.(in Chinese) [6]Azcón-Aguilar C,Azcón R,Barea J M.Endomycorrhizal fungi and Rhizobium as biological fertilisers forMedicagosativain normal cultivation.Nature,1979,279:325-327. [7]Antunes P M,de Varennes A,Rajcan I,Goss M J.Accumulation of specific flavornoids in so- ybean (GlycinemaxL.Merr.) as a function of the early tripartite symbiosis with arbuscular mycorrhizal fungi andBradyrhizobiumjaponicum(Kirchner) Jorda.Soil Biology and Biochemistry,2006,38:1234-1242. [8]毕银丽,王瑾,冯彦博,余海洋,秦亚非,于淼.菌根对干旱区采煤沉陷地紫穗槐根系修复的影响.煤炭学报,2014,39(8):1758-1764. Bi Y L,Wang J,Feng Y B,Yu H Y,Qin Y F,Yu M.Effect of arbuscular mycorrhiza on root self-repairing action ofAmorphafruticosaL.in coal mining subsidence land in arid areas.Journal of China Coal Society,2014,39(8):1758-1764.(in Chinese) [9]高丽霞,刘水,陈阳春,莫爱琼,李秀娃.印度木豆及丛枝菌根真菌在镉污染土壤中的抗性研究.广东农业科学,2009,12:180-190. Gao L X,Liu S,Chen Y C,Mo A Q,Li X W.Effects of AMF on resistance of pigeonpea to Cd-contaminated soil.Guangdong Agricultural Science,2009,12:180-190.(in Chinese) [10]申鸿,刘于,李晓林,陈保东,冯固,白淑兰.丛枝菌根真菌(Glomuscaledonium)对铜污染土壤生物修复机理初探.植物营养与肥料学报,2005,11(2):199-204. Shen H,Liu Y,Li X L,Chen B D,Feng G,Bai S L.Influence of arbuscular mycorrhizal fungus (Glomuscaledonium) on maize seedlings grown in copper contaminated soil.Plant Nutrition and Fertilizer Science,2005,11(2):199-204.(in Chinese) [11]刘德良,王开峰,杨期和.煤矿区先锋植物猪屎豆接种丛枝菌根的效应研究.水土保持学报,2013,27(2):282-287. Liu D L,Wang K F,Yang Q H.Study on effects ofCrotalariapallidinoculated with arbuscular mycorrhizal fungi in coal mining area.Journal of Soil and Water Conservation,2013,27(2):282-287.(in Chinese) [12]李馨,熊康宁,龚进宏,陈永毕.人工草地在喀斯特石漠化治理中的作用及其研究现状.草业学报,2011,20(6):279-286. Li X,Xiong K N,Gong J H,Chen Y B.Advances in research on the function of artificial grassland in karst rock desertification control.Acta Prataculturae Sinica,2011,20(6):279-286.(in Chinese) [13]Saini V K,Bhandari S C,Tarafdar J C.Comparison of crop yield,soil microbial C,N and P,N-fixation,nodulation and mycorrhizal infection in inoculated and non-inoculated sorghum and chickpea crops.Field Crops Research,2004,89:39-47. [14]Ruiz-Lozano J M,Collados C,Barea J M,Azcón R.Arbuscular mycorrhizal symbiosis can alleviate drought induced nodule senescence in soybean plants.New Phytologist,2001,151:493-502. [15]包玉英,闫伟.内蒙古中西部草原主要植物的丛枝菌根及其结构类型研究.生物多样性,2004,12(5):501-508. BaoY Y,Yan W.Arbuscular mycorrhizae and their structural types on common plants in grasslands of mid-western Inner Mongolia.Biodiversity Science,2004,12(5):501-508.(in Chinese) [16]贺学礼,赵丽莉,杨宏宇.毛乌素沙地豆科植物丛枝菌根真菌分布研究.自然科学进展,2006,16(6):684-688. He X L,Zhao L L,Yang H Y.The distribution of arbuscular mycorrhizal fungi from the leguminous in Mao wusu sandland.Progress in Natural Science,2006,16(6):684-688.(in Chinese) [17]赵莉,贺学礼.毛乌素沙地3种豆科植物根际AM真菌生态分布研究.干旱地区农业研究,2007,25(2):197-199. Zhao L,He X L.Colonization of arbuscular mycorrhizal fungi from the rhizoshpere of three legume species in mao wusu sandland.Agricultural Research in the Arid Areas,2007,25(2):197-199.(in Chinese) [18]Komanik P P,Bryon W C,Schultz R C.Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay.Canadian Journal of Microbiology,1980,26(4):536-538. [19]Ianson D C,Allen M F.The effects of soil texture on extraction of vesicular-arbuscular mycorrhizal fungal spores from arid sites.Mycologia,1986,78:164-168. [20]Schenck P.Manula for the Identiifeation of Vesicular Arbuscular Mycorrhizal Fungi.2nd ed.Gainesville:INVAM Univesrity of Floirda,1988:1139. [21]杨剑虹,王成林,代亨林.土壤农化分析与环境监测.北京:中国大地出版社,2008. Yang J H,Wang C L,Dai H L.Soil Agro-chemistry Analysis and Environmental Monitoring.Beijing:China Earth Press,2008.(in Chinese) [22]孙向伟,王晓娟,陈牧,豆存艳,高飞翔,金樑.生态环境因子对AM真菌孢子形成与分布的作用机制.草业学报,2011,20(1):214-221. Sun X W,Wang X J,Chen M,Dou C Y,Gao F X,Jin L.Effects of eco-environmental factors on the production and distribution of arbuscular mycorrhizal fungal spores.Acta Prataculturae Sinica,2011,20(1):214-221.(in Chinese) [23]杨高文,刘楠,杨鑫,张英俊.丛枝菌根真菌与个体植物的关系及其对群落生产力和物种多样性的影响.草业学报,2015,24(6):188-203. Yang G W,Liu N,Yang X,Zhang Y J.Relationship between arbuscular mycorrhizal fungi and individual plant and their effects on plant productivity and species diversity of plant community.Acta Prataculturae Sinica,2015,24(6):188-203.(in Chinese) [24]He X L,Mouratov S,Steinberger Y.Spatial distribution and colonization of arbuscular mycorrhizal fungi under the canopies of desert halophytes.Arid Land Research& Management,2002,16(2):149-160. [25]任爱天,鲁为华,杨洁晶,马春晖.石河子绿洲区苜蓿地丛枝菌根真菌的多样性及与土壤因子的关系.草业科学,2014,31(9):1666-1672. Ren A T,Lu W H,Yang J J,Ma C H.Arbuscular mycorrhizal fungi diversity and its relationship with soil environmental factors in oasis alfalfa planting of Shihezi.Pratacultural Science,2014,31(9):1666-1672.(in Chinese) [26]Van der Heijden M G A,Boller T R.Socialism in soil?The importance of mycorrhizal fungal networks for facilitation in natural ecosystems.Journal of Ecology,2009,97(6):1139-1150. [27]Smith S E,Smith F A.Roles of arbuscular mycorrhizas in plant nutrition and growth:New paradigms from cellular to ecosystem scales.Annual Review of Plant Biology,2011,62:227-250. [28]许伟,贺学礼,孙茜,王晓乾,刘春卯,张娟,赵丽莉.塞北荒漠草原柠条锦鸡儿AM真菌的空间分布.生态学报,2015,35(4):1124-1133. Xu W,He X L,Sun Q,Wang X Q,Liu C M,Zhang J,Zhao L L.The spatial distribution of arbuscular mycorrhizal fungi in the rhizosphere ofCaraganakorshinskiiin Saibei desert steppe.Acta Ecologica Sinica,2015,35(4):1124-1133.(in Chinese) [29]刘春卯,贺学礼,徐浩博,张淑容,牛凯.蒙古沙冬青AM真菌物种多样性研究.生态环境学报,2013,22(7):1148-1152. Liu C M,He X L,Xu H B,Zhang S R,Niu K.Species diversity of arbuscular mycorrhizal fungi in the rhizosphere ofAmmopiptanthusmonglicus.Ecology and environmental Sciences,2013,22(7):1148-1152.(in Chinese) (责任编辑张瑾) 2016年1月国际市场主要畜产品与饲料价格分析 1月国际饲料价格跌涨互现,畜产品价格继续下降,部分商品价格出现反弹。 一、玉米、大豆、豆粕、棉籽饼、豆粉市场价格下降,菜籽、高梁、苜蓿粉市场价格上涨 1月份玉米、大豆、豆粕、棉籽饼、豆粉市场平均价格分别为142.23、325.67、270.65、286.25、267.64美元·t-1,环比分别下降2.27%、0.58%、1.43%、3.32%、1.60%。菜籽、高梁、苜蓿粉市场平均价格分别为440.46、130.17、256.63美元·t-1,环比分别上涨0.78%、5.90%、0.60%。 二、羊羔肉、羊肉、鸡肉、牛奶、牛肉价格持普遍下降,育肥牛、瘦肉猪、猪肉市场市场价格上涨 1月份羊羔肉、羊肉、鸡肉、牛奶、牛肉市场平均价格分别为3.16、1.50、2.48、0.26、5.10美元·kg-1,环比分别下降2.30%、8.60%、0.40%、15.57%、3.20%。育肥牛、瘦肉猪、猪肉市场平均价格为3.59、1.34、1.67美元·kg-1,环比分别上涨4.29%、6.54%、0.60%。 图1 2016年1月国际市场主要饲料与畜产品价格 数据来源:国际市场商品价格网 http://price.mofcom.gov.cn/;中国农业信息http://www.agri.gov.cn/;鸡肉 http://www.indexmundi.com/;羊羔肉、羊肉 http://www.interest.co.nz/rural;牛肉http://www.thebeefsite.com/;猪肉 http://www.thepigsite.com/;货币汇率:http://qq.ip138.com/hl.asp。 (兰州大学草地农业科技学院王迎新 整理) The category and distribution of arbuscular mycorrhizal fungi from the rhizosphere of eight cultivated leguminous shrubs Wu Tao1, Yao Hong-yan2, Mo Ben-tian3, Long Zhong-fu3, Luo Chong1 (1.School of Life Sciences, Guizhou Normal University, Guiyang 550001, China;2.College of Animal Science, Guizhou University, Guiyang 550025, China;3.Guizhou Institute of Pratacultural, Guiyang 550006, China) Abstract:Soil samples of eight leguminous shrub plants were collected respectively from the experimental field, and the plants were Cassia tora, Dendrolobium triangulare, Amorpha fruticosa, Sophora davidii, Crotalaria pallida, Indigofera amblyantha, Cajanus cajan and Leucaena leucocephala which cultivated in Guiyang. Each soil sample was collected from each sites at three depths in the soil profile: 5-10, 10-20 and 20-30 cm, respectively. This study mainly analyzed the infection rate, spore density, species and the diversity of arbuscular mycorrhizal fungi. The results indicated that the eight leguminous shrub plants had a higher infection rate of AM fungi, the infection rate of AM fungi for C. pallid was the highest, up to 80.8%; Soil available phosphorus had significantly negative correlation with the infection rate(r=-0.733,P=0.039); The spores of AM fungi mainly distributed in the 5-20 cm soil layer, the spore density of C. pallida at the 5-10 cm layer was the highest;Spore density were significantly affected by the host plants and soil layers (F=100.497, P<0.001);The dominant species of AM fungi were Glomus liquidambaris and Acoaclospora delicate, which were detected in the soil of eight leguminous shrub plants. It was important to inoculate the dominant AM fungi for leguminous shrub plant in karst area and do other related researches about rhizobia. What's more, these researches had a great effect on improving animal husbandry production and restoring degraded ecosystem. Key words:leguminous shrub plants; arbuscular mycorrhizal fungi; infection rate; diversity Corresponding author:Luo ChongE-mail: gzluochong@sina.com 中图分类号:S432.4+4 文献标识码:A 文章编号:1001-0629(2016)2-0210-09 通信作者:罗充(1970-),男,贵州铜仁人,教授,硕士,研究方向为植物生理学。E-mail:gzluochong@sina.com 基金项目:国家牧草产业技术体系(CARS-35-37);贵州省科学技术厅资助项目(黔科合NY 字[2008]3049号) *收稿日期:2015-06-17接受日期:2015-10-09 DOI:10.11829/j.issn.1001-0629.2015-0345 吴涛,姚红艳,莫本田,龙忠富,罗充.8种豆科灌木栽培种丛枝菌根真菌种类及分布.草业科学,2016,33(2):210-218. Wu T,Yao H Y,Mo B T,Long Z F,Luo C.The category and distribution of arbuscular mycorrhizal fungi from the rhizosphere of eight cultivated leguminous shrubs.Pratacultural Science,2016,33(2):210-218. 第一作者:吴涛(1988-),男(苗族),贵州黄平人,在读硕士生,研究方向为植物生理生态学。E-mail:505544288@qq.com