藁本内酯对低灌注大鼠水迷宫成绩的改善和对海马神经元保护作用
2016-04-18王成牛冯展波彭彬李洁佳陆亚鹏朱俐
王成牛,冯展波,彭彬,李洁佳,陆亚鹏,朱俐
(1.南通大学医学院 基础医学研究中心,江苏 南通 226001; 2.南通大学 航海医学研究所,江苏 南通 226001)
藁本内酯对低灌注大鼠水迷宫成绩的改善和对海马神经元保护作用
王成牛1,冯展波2,彭彬2,李洁佳1,陆亚鹏2,朱俐2
(1.南通大学医学院 基础医学研究中心,江苏 南通226001; 2.南通大学 航海医学研究所,江苏 南通226001)
[摘要]目的:研究藁本内酯对低灌注大鼠水迷宫成绩的改善和对海马神经元的保护作用,探讨其神经元保护的作用机制。方法:取健康雄性SD大鼠24只(体重260~280 g),随机分为对照组、低灌注组和藁本内酯组,每组8只。对低灌注组和藁本内酯组大鼠行双侧颈总动脉永久性结扎术,对照组不结扎。术后第8天,藁本内酯组大鼠灌胃给予藁本内酯(以大豆油为溶剂,每日剂量80 mg·kg(-1)),另外两组大鼠予相同体积的大豆油灌胃。所有大鼠连续灌胃21 d后进行水迷宫实验,观察各组大鼠水迷宫成绩(即潜伏期的长短)的差异。水迷宫实验结束后处死大鼠,采用尼氏染色观察各组大鼠海马CA1和CA3区神经元尼氏小体阳性细胞数量的变化,采用免疫荧光和免疫组化法观察各组大鼠海马CA1和CA3区神经元的神经元特异性核蛋白(NeuN)、神经胶质纤维酸性蛋白(GFAP)和半胱氨酸天冬氨酸特异性蛋白酶3(Caspase3)表达变化。结果:藁本内酯组大鼠水迷宫成绩较低灌注组明显提高(P<0.05),海马CA1、CA3区尼氏小体阳性细胞数量较低灌注组明显增加,海马CA1、CA3区GFAP和Caspase3阳性细胞数量较低灌注组明显减少。结论:藁苯内酯能够改善低灌注大鼠水迷宫成绩,并对海马区神经元具有较好的保护作用。
[关键词]藁本内酯; 脑低灌注; 神经保护; 海马; 凋亡
藁本内酯(Ligustilide)可透过血脑屏障,改善脑微循环、抗氧化损伤、抑制炎症反应,并可提高胆碱乙酰转移酶活性,有利于改善记忆功能[1- 6]。本课题中,我们研究藁本内酯对低灌注大鼠水迷宫成绩的改善和对海马神经元的保护作用,并探讨藁本内酯神经保护作用的机制,为其临床应用提供实验参考。
1材料与方法
1.1实验动物与模型制备
健康雄性清洁级SD大鼠24只(260~280 g),由南通大学医学实验动物中心提供。将大鼠随机分为对照组、低灌注组和藁本内酯组,每组8只。对低灌注组和藁本内酯组大鼠行双侧颈总动脉永久性结扎术,对照组不结扎。术后第8天,藁本内酯组予藁本内酯灌胃(以大豆油为溶剂,每日剂量80 mg·kg-1),另外两组大鼠予相同体积的大豆油灌胃。
1.2主要试剂和器材
藁本内酯(本实验室制备,纯度:95%~97%),鼠抗GFAP一抗、鼠抗NeuN一抗(Millipore,美国),兔抗Caspase3一抗、FITC羊抗鼠二抗及TRITC 羊抗兔二抗(Bioworld,美国),抗鼠/兔二抗试剂盒(北京中杉金桥),其他试剂为国产分析纯。荧光显微镜、冰冻切片机(莱卡,德国),水迷宫(北京,中国药物科学院)。
1.3实验方法
大鼠连续灌胃21 d后进行连续5 d的水迷宫实验,实验流程见本课题组前期报道[7],由电脑自动记录大鼠潜伏期时间。水迷宫实验结束后处死大鼠取脑,制备冰冻切片,切片厚度25 μm。取切片行尼氏染色,观察各组大鼠海马CA1和CA3区神经元尼氏小体阳性细胞数量的变化;采用免疫荧光和免疫组化法观察各组大鼠海马CA1和CA3区神经元的神经元特异性核蛋白(neuronal specific nuclear protein,NeuN)、神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和半胱氨酸天冬氨酸特异性蛋白酶3(cysteinyl aspartate specific proteinase 3,Caspase3)表达变化。
1.4统计学处理
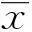
2结果
2.1藁本内酯能有效提高低灌注大鼠水迷宫成绩见图1。
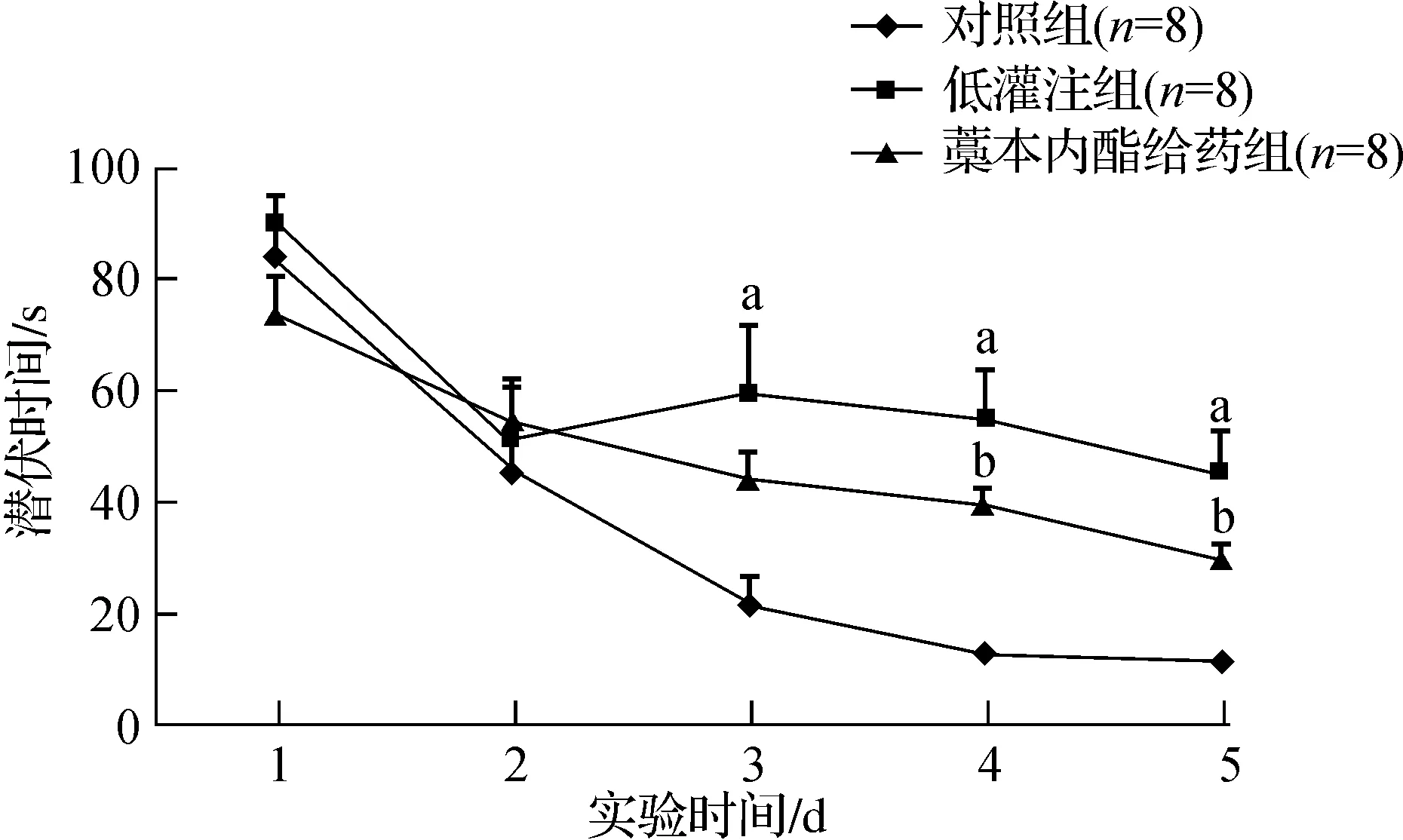
与对照组比较,aP<0.01;与低灌注组比较,bP<0.05
图1各组大鼠水迷宫潜伏期结果
图1显示,随着实验天数的增加,各组大鼠的潜伏期出现差异。从第3天开始,低灌注组大鼠的潜伏期较对照组大鼠的潜伏期明显延长(P<0.01),即水迷宫成绩变差;从第4天起,藁本内酯组大鼠的潜伏期较低灌注组大鼠的潜伏期明显缩短(P<0.05),即水迷宫成绩提高。
2.2藁本内酯能有效抑制低灌注大鼠海马尼氏小体阳性细胞数量的减少见表1。
表1各组大鼠海马CA1、CA3区尼氏小体阳性细胞数量与对照组平均值的比值

组 别海马CA1区海马CA3区对照组1±0.031±0.03低灌注组0.42±0.08a0.56±0.07a藁本内酯组0.94±0.04b0.91±0.03b
与对照组比较,aP<0.01;与低灌注组比较,bP<0.01
表1显示,低灌注组大鼠海马CA1、CA3 区尼氏小体阳性细胞数量与对照组平均值的比值较对照组明显减小(P<0.01),藁本内酯组海马CA1、CA3区尼氏小体阳性细胞数量与对照组平均值的比值较低灌注组明显增大(P<0.01)。
2.3藁本内酯能有效抑制低灌注大鼠海马GFAP阳性细胞的增加见表2。
表2各组大鼠海马CA1、CA3区GFAP阳性细胞数量与对照组平均值的比值

组 别海马CA1海马CA3对照组1±0.061±0.08低灌注组1.65±0.12a1.5±0.12a藁本内酯组1.09±0.07b1.14±0.11b
与对照组比较,aP<0.01;与低灌注组比较,bP<0.01
表2显示,低灌注组大鼠海马CA1、CA3区GFAP阳性细胞与对照组平均值的比值较对照组明显增大(P<0.01),藁本内酯组海马CA1、CA3区GFAP阳性细胞数量与对照组平均值的比值较低灌注组明显减小(P<0.01,表2)。
2.4藁本内酯能有效减少低灌注大鼠海马Caspase3阳性细胞的增加见表3、图2。
表3各组大鼠海马CA1、CA3区Caspase3阳性细胞数量与对照组平均值的比值

组 别海马CA1海马CA3对照组1±0.211±0.09低灌注组7.12±11.2a3.2±0.36a藁本内酯组3.24±0.18b1.75±0.13b
与对照组比较,aP<0.01;与低灌注组比较,bP<0.01

A~C为海马CA1区,D~F为海马CA3区;A和D为对照组,B和E为低灌注组,C和F为藁本内酯组
图2大鼠海马区NeuN和Caspase- 3免疫荧光双标结果
表3显示,低灌注组海马CA1和CA3区Caspase3阳性细胞与对照组平均值的比值较对照组明显增大(P<0.01);藁本内酯组海马CA1和CA3区Caspase3阳性细胞数量与对照组平均值的比值较低灌注组明显减小(P<0.01)。NeuN和Caspase- 3免疫荧光双标结果显示,低灌注大鼠的Caspase3阳性细胞与NeuN阳性细胞基本重叠。
3讨论
大鼠水迷宫成绩(即潜伏期的长短)是反映大鼠空间学习记忆功能的一项重要指标;而学习记忆功能的正常发挥与海马神经元的活力和数量密切相关。尼氏小体是神经元糙面内质网的核糖体,也是神经细胞功能活性的形态指标。当神经元的轴突被切断或受到过分的刺激时,尼氏小体会逐渐消失。NeuN是一种成熟的神经元标记物,不与星形胶质细胞和小胶质细胞发生交叉反应,其阳性细胞数量的多少,能更加准确地代表神经元的数量。本实验中,藁本内酯组大鼠海马CA1、CA3区尼氏小体阳性和NeuN阳性细胞数量(数据未给出)与对照组平均值的比值明显大于低灌注组大鼠,说明藁本内酯治疗后的大鼠海马CA1、CA3区神经元的活力和数量指标较低灌注大鼠更好。藁本内酯组大鼠水迷宫成绩较低灌注组大鼠明显提高,正是这种生理性差异的直接体现。
在中枢神经系统中,炎症因子NF- κB可广泛表达于神经元、星形胶质细胞和小胶质细胞。其在大鼠脑缺血神经细胞中表达升高。有研究发现,在脑出血神经元中Caspase3的表达与NF-κB的表达呈正相关[8]。本研究中,我们发现藁本内酯能够有效减少低灌注大鼠海马CA1、CA2区域GFAP和Caspase3阳性细胞,推测藁本内酯通过减少该区域Caspase3阳性细胞使炎症因子NF- κB的表达减少,但是其确切的机制还需要进一步的实验进行验证。
综上所述,藁本内酯能够有效改善低灌注大鼠水迷宫成绩,这种改善作用可能是通过抑制低灌注大鼠海马CA1、CA3区域尼氏小体阳性细胞的减少,并且抑制该区域GFAP和Caspase3阳性细胞的增加实现的。虽然关于藁本内酯的神经保护作用机制不断被发现和阐明,但是更深入的药理机制仍有待进一步的研究,比如给药后海马区域正常神经元是来自于缺血前,还是缺血后的再生,还是两者都有的问题尚未得到解决,这将是我们今后进一步研究的课题。
[参考文献]
[1] FARKAS E,LUITEN P G,BARI F.Permanent,bilateral common carotid artery occlusion in the rat:a model for chronic cerebral hypoperfusion- related neurodegenerative diseases[J].Brain Res Rev,2007,54:162- 180.
[2] GUO J M,SHANG E X,DUAN J A,et al.Determination of ligustilide in the brains of freely moving rats using microdialysis coupled with ultra performance liquid chromatography/mass spectrometry[J].Fitoterapia,2011,82:441- 445.
[3] YU Y,DU J R,WANG C Y,et al.Protection against hydrogen peroxideinduced injury by Z- ligustilide in PC12 cells[J].Exp Brain Res,2008,184:307- 312.
[4] LI J J,ZHU Q,LU Y P,et al.Ligustilide prevents cognitive impairment and attenuates neurotoxicity in D- galactose induced
aging micebrain[J].Brain Res,2015,1959:19- 28.
[5] SHI Y,WANG D T,LU L,et al.Ligustilide prevents the apoptosis effects of tumour necrosis factor- alpha during C2C12 cell differentiation[J].Int Immunopharmacol,2014,19:358- 364.
[6] PENG B,ZHAO P,LU Y P,et al.Z- ligustilide activates the Nrf2/HO- 1 pathway and protects against cerebral ischemia- reperfusion injuryinvivoandinvitro[J].Brain Res,2013,1520:168- 177.
[7] FENG Z B,LU Y P,WU X M,et al.Ligustilide alleviates brain damage and improves cognitive function in rats of chronic cerebral hypoperfusion[J].J Ethnopharmacol,2012,144:313- 321.
[8] 吴丹,滕伟禹.大鼠实验性脑出血后脑组织TL2、NF- κB/p65及caspase- 3表达变化的研究[J].中风与神经疾病杂志,2010,27(6):484- 488.
doi:10.3969/j.issn.1671- 6264.2016.02.019
[中图分类号]R966
[文献标识码]A
[文章编号]1671- 6264(2016)02- 0228- 04
[通信作者]朱俐E- mail:zhulili65@126.com
[作者简介]王成牛(1985-),男,江苏南京人,实验师,医学硕士。E- mail:wangchengniu@163.com
[基金项目]江苏省科技厅高技术研究计划基金(BG2007607);南通大学校级自然科学类科研基金一般项目(12Z020)
[收稿日期]2015- 10- 10[修回日期] 2015- 12- 01
[引文格式] 王成牛,冯展波,彭彬,等.藁本内酯对低灌注大鼠水迷宫成绩的改善和对海马神经元保护作用[J].东南大学学报:医学版,2016,35(2):228- 231.
·论著·
