多层螺旋CT对局灶性机化性肺炎与周围型肺癌的鉴别诊断
2016-04-18韩文广HANWenguang王红梅WANGHongmei周永ZHOUYong余莹莹YUYingying文智WENZhi
韩文广HAN Wenguang王红梅WANG Hongmei周 永ZHOU Yong余莹莹YU Yingying文 智WEN Zhi
作者单位1. 新疆医科大学附属肿瘤医院CT室 新疆乌鲁木齐 8300112. 新疆医科大学附属肿瘤医院妇二科 新疆乌鲁木齐 830011
多层螺旋CT对局灶性机化性肺炎与周围型肺癌的鉴别诊断
韩文广1HAN Wenguang
王红梅2WANG Hongmei
周永1ZHOU Yong
余莹莹1YU Yingying
文智1WEN Zhi
作者单位
1. 新疆医科大学附属肿瘤医院CT室新疆乌鲁木齐830011
2. 新疆医科大学附属肿瘤医院妇二科 新疆乌鲁木齐 830011
【摘要】目的 探讨局灶性机化性肺炎(FOP)的影像特征,提高多层螺旋CT对FOP与周围型肺癌的鉴别诊断价值。资料与方法 收集32例经病理证实的FOP患者,并随机选取43例周围型肺癌作为周围型肺癌组,比较两组大病灶(直径>3 cm)和小病灶(直径≤3 cm)临床特征、CT征象及强化方式的差异。结果 ①临床特征:FOP小病灶患者年龄小于肺癌小病灶患者、男女性别比高于肺癌小病灶患者(P<0.05),FOP组与周围型肺癌组大、小病灶患者吸烟史、临床症状及实验室检查差异均无统计学意义(P>0.05)。②CT征象:FOP组与周围型肺癌组大、小病灶患者病灶分布、血管集束征、毛刺、支气管充气征、结构疏松、胸膜凹陷方面差异有统计学意义(P<0.05);FOP组与周围型肺癌组大病灶在空洞、紧贴胸膜征象方面差异有统计学意义(P<0.05)。③增强扫描:两组平扫CT值及静脉期较动脉期CT净增值差异均无统计学意义(P>0.05)。FOP组动脉期CT净增值及总CT净增值均大于周围型肺癌组,差异有统计学意义(P<0.05)。结论 不同大小FOP与周围型肺癌临床特征、CT征象及强化均有一定的差异性及特征性,临床上应综合分析,对于不能确诊的病例,抗感染治疗后短期影像学随访具有一定的价值。
【关键词】闭塞性细支气管炎机化性肺炎;肺肿瘤;体层摄影术,螺旋计算机;病理学,外科;诊断,鉴别
Department of CT, Xinjiang Medical University Affiliated Tumor Hospital, Urumqi 830011, China
Address Correspondence to: WEN Zhi E-mail: 13999936442@163.com
R734.2;R730.42
修回日期:2016-02-12
中国医学影像学杂志
2016年 第24卷2期:106-110
机化性肺炎(organizing pneumonia,OP)又称为闭塞性细支气管炎伴OP,其病理学特征为肺泡腔内出现以增生的成纤维细胞为主的机化成分。局灶性机化性肺炎(focal organizing pneumonia,FOP)是OP的一种亚型,表现为肺部孤立性结节或肿块,占OP 的10%~15%[1]。FOP的CT表现多样,临床上经常会误诊为周围性肺癌而进行肺叶切除或细针穿刺活检。OP经糖皮质激素治疗后大部分病变可吸收好转[2]。为避免不必要的肺叶切除或穿刺活检,本研究拟比较FOP及周围性肺癌的临床资料及CT征象,探讨FOP与周围型肺癌的鉴别要点,提高对两者的认识及鉴别诊断能力。
1 资料与方法
1.1研究对象收集2005年5月—2015年4月新疆医科大学附属肿瘤医院收治的32例FOP患者,纳入标准:①胸部CT影像表现为孤立小结节或大肿块;②首次住院患者,住院前未行任何治疗;③病灶经外科切除或CT引导下经皮穿刺活检并均经病理证实。随机选取同期收治的43例周围型肺癌作为对照组。纳入标准:①经病理结果证实;②CT表现为实性结节或肿块;③未合并肺内及远处转移。FOP与周围型肺癌患者的临床特征见表1。

表1 FOP与周围型肺癌患者的临床特征
1.2仪器与方法采用Philips 16排大孔径螺旋CT机、Siemens Somatom Definition AS 64排螺旋CT机或GE LightSpeed VCT 64排螺旋CT机,扫描参数:管电压120 kV,管电流250 mA,层距、层厚5 mm。所有图像均常规进行薄层重建,部分图像加做冠状位、矢状位。增强扫描采用非离子型对比剂碘海醇(300 mgI/ml),注射剂量80~100 ml,注射速度2.5~3.0 ml/s。动脉期延迟25~30 s扫描,静脉期延迟55~60 s扫描。
1.3图像分析根据不同大小病灶的影像学表现差异及既往研究[3],本研究将FOP组及周围型肺癌组病例分为大病灶及小病灶,分析两组大、小病灶临床特征、CT征象、病变强化特征。对于位于肺尖及肺底的病灶,本研究将其分布定义为肺外带。测量横断面图像上病灶最大径,直径>3 cm的病灶定义为大病灶,直径≤3 cm的病灶定义为小病灶。FOP组与周围型肺癌组CT征象分析及增强扫描后CT净增值测量分别由1名医师和1名副主任医师独立完成,意见不一致时由主任医师复审确定结果。
1.4统计学方法采用SPSS 17.0软件,计量资料比较采用t检验,计数资料比较采用χ2检验或Fisher确切概率法,采用受试者操作特征(ROC)曲线评价增强扫描后CT增加值对病变的诊断效能,P<0.05表示差异有统计学意义。
2 结果
2.1FOP与周围型肺癌的临床特征FOP组25例出现临床症状,主要为咳嗽、胸痛、胸部不适、咯血、气短及发热;7例无任何临床症状,为胸部体检偶然发现。FOP组与周围型肺癌患者的临床特征见表1。
2.2FOP与周围型肺癌的CT征象FOP组与周围型肺癌组大病灶在空洞、紧贴胸膜(图1)征象上差异有统计学意义(P<0.05)。FOP组与周围型肺癌组大、小病灶在病灶分布、血管集束征、毛刺、支气管充气征(图1)、结构疏松、胸膜凹陷差异有统计学意义(P<0.05)。两者均有液化、坏死发生(27.8%比37.5%),但数量差异无统计学意义(P>0.05),FOP坏死多集中在中央区,边界较清(图2);而周围型肺癌往往呈弥漫性坏死,坏死范围较大(图1)。两组CT征象见表2。
2.3FOP与周围型肺癌的强化特征32例FOP及43例周围型肺癌均进行增强扫描,其中26例FOP和35例周围型肺癌进行两期扫描。除2例肺癌外,所有患者两期扫描病灶均表现为渐进性强化。两组在平扫CT值及静脉期较动脉期CT净增值差异均无统计学意义(P>0.05)。FOP在动脉期CT净增值及总CT净增值均大于周围型肺癌组,差异有统计学意义(P<0.05)。ROC曲线发现,动脉期CT增加值曲线下面积为0.688,低于总CT增加值的曲线下面积0.722,见图3。动脉期CT增加值最佳临界值为18.50 HU,此时敏感度为76.9%,灵敏度为62.2%。总CT增加值最佳临界值为27.00 HU,此时敏感度为92.3%,灵敏度为48.6%。FOP与周围型肺癌患者的强化特征见表3。
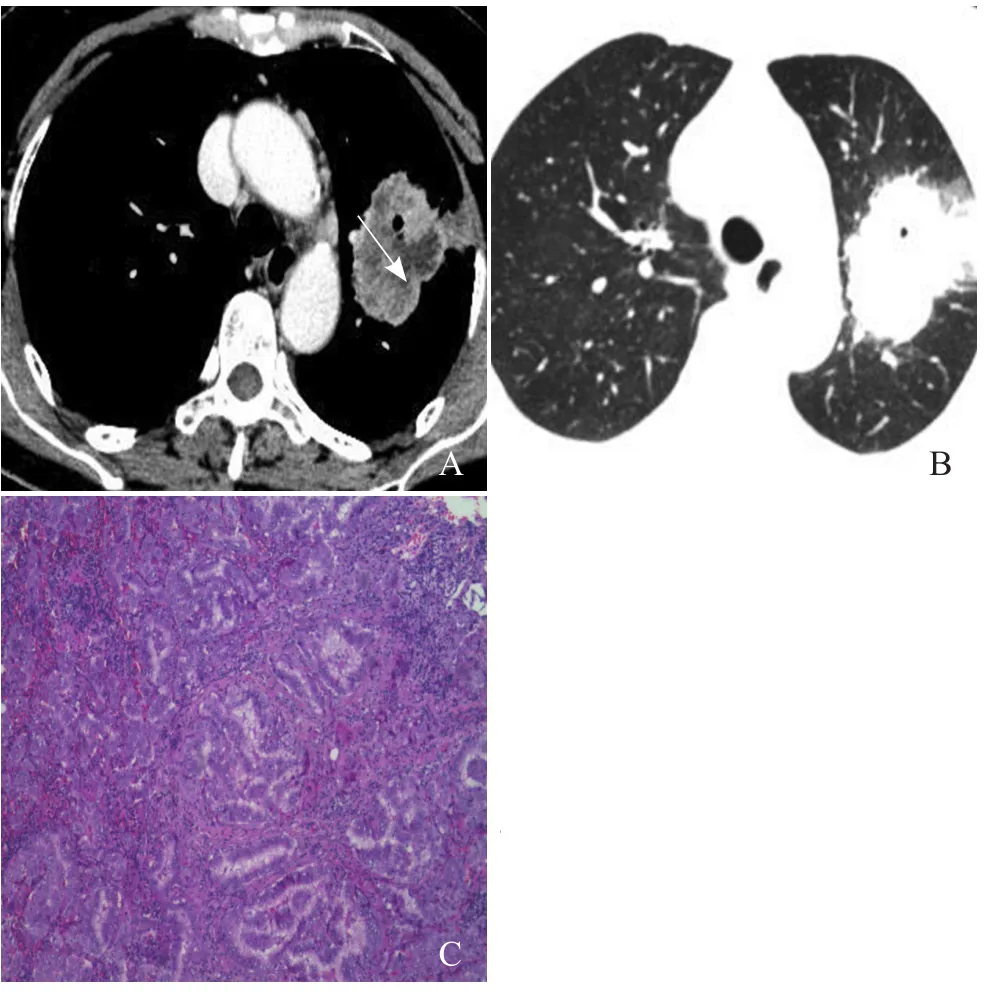
图1 女,61岁,周围型肺癌。病变位于左肺上叶尖后段,与胸膜局部相连,邻近胸膜增厚,纵隔窗示病灶呈分叶状,内见液化坏死,范围较大(箭),边界不清,形态不规则(A);肺窗示病灶内见“空泡征”(B);病理镜下示肺癌癌细胞紧密排列成腺腔样状癌巢,细胞异型明显(HE,×100,C)

图2 男,59岁,FOP。病灶位于左肺上叶外带,紧贴胸膜,纵隔窗示病灶内液化坏死,边界较清(A);肺窗示病灶前缘见支气管充气征(箭,B);病理镜下示FOP在肺泡腔内可见由成纤维细胞组成的疏松组织,通过肺泡腔间孔到相邻肺泡腔(HE,×100,C)
3 讨论
OP的病理学特征表现为肺泡或细支气管腔内出现以纤维蛋白渗出物及成纤维细胞为主的肉芽组织。OP可分为自发性和继发性两种,继发性OP多与感染、恶性肿瘤、移植、药物等有关。Pipavath等[4]报道16例造血干细胞移植引起的OP患者CT征象,主要表现为透明磨砂玻璃影、实性和条索影,好发于上肺。特发性OP又称为隐源性OP,占所有OP的15%~55%[5],常表现为两肺外带或沿支气管束分布的斑片影。OP有时表现为孤立性结节或肿块,称为FOP。既往研究[3,6]报道,直径>3 cm的孤立性肺部病变往往是恶性的,而直径<3 cm的结节更趋向于良性病变。

表2 FOP与周围型肺癌患者CT征象比较[n(%)]
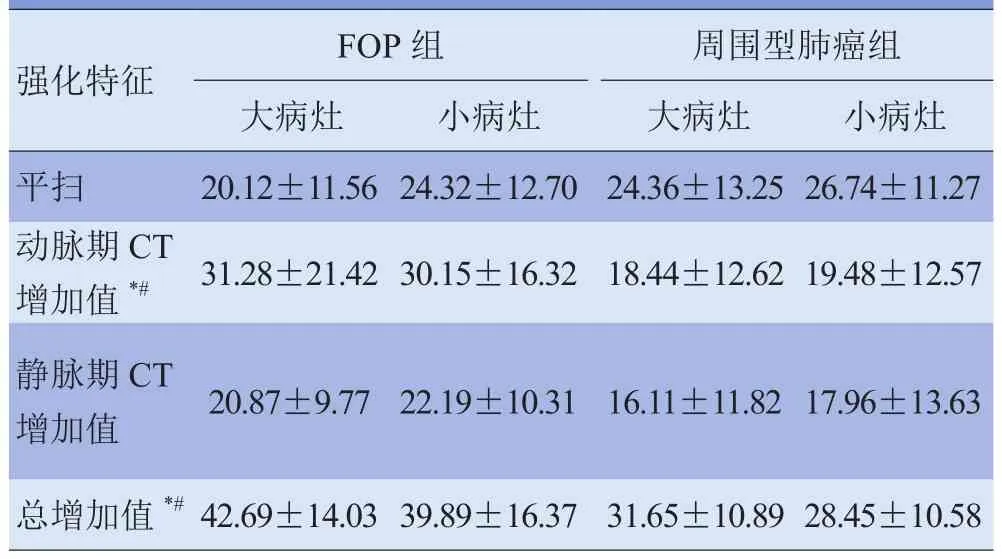
表3 FOP与周围型肺癌患者强化特征比较(HU)

图3 动脉期CT增加值及总CT增加值的ROC曲线。动脉期CT增加值曲线下面积为0.688,总CT增加值曲线下面积为0.722
3.1FOP与周围型肺癌的临床特征Huo等[7]报道,约81.08%的FOP属于继发性OP,原因不明者(特发性)仅占18.91%。17例(40.47%)病灶肺间质可见中性粒细胞浸润和聚集,提示存在急性活动性炎症。本研究发现FOP与周围型肺癌患者在白细胞及中性粒细胞升高方面差异无统计学意义。与既往[3]研究类似,本研究中,FOP好发于52~57岁人群,有吸烟史的男性更易罹患此病。FOP小病灶患者平均年龄明显低于肺癌小病灶患者(P<0.05)。FOP小病灶患者男性所占比例高于周围型肺癌组(P<0.05)。但两组大病灶患者年龄、性别差异无统计学意义(P>0.05),其可能原因为两组大病灶样本量过少。FOP组25例及肺癌组35例出现临床症状,FOP组临床症状出现率最高的为咳嗽、胸痛,与周围型肺癌的症状有较多重叠,无特异性临床症状。FOP 组7例及肺癌组8例患者无临床症状,为胸部体检偶然发现,故单凭临床症状很难对结节性质做出正确诊断。
3.2FOP与周围型肺癌的CT征象本研究结果显示,9例FOP病灶位于右肺下叶,10例位于左肺下叶,与Zhao等[3]的研究结果基本相符。Kohno等[8]报道18例FOP患者,病变均在肺外带。本组26例FOP位于肺外带,可能与此处支气管引流不畅、慢性炎症迁延不愈等有关。肺癌组仅18例病灶位于肺外带,12例病灶位于内带时,以上结果表明,当一个病灶位于肺野内带时,应高度怀疑肺癌可能。
在病灶内部情况方面,液化、坏死多由于炎症吸收不彻底、纤维肉芽组织包裹、液化成分长时间无法排出造成,少数病灶最终可形成空洞将其排出。与Zhao等[3]报道的液化、坏死仅发生于大FOP及周围型肺癌不同,本研究结果表明FOP及肺癌小病灶组也均有液化、坏死发生,分别为27.8%、37.5%,尽管两者差异无统计学意义,但FOP与周围型肺癌在坏死形态上表现有差异性,FOP坏死多集中在中央区,边界较清;而肺癌往往呈弥漫性坏死,坏死范围较大。FOP大病灶较周围型肺癌更易出现空洞。10例(71.4%)FOP大病灶及13例(72.2%)小病灶出现支气管充气征。肺癌组仅13例(30.2%)出现,大多数病例出现管腔截断,两组差异有统计学意义(P<0.05)。结构疏松指病灶在纵隔窗测量大小较肺窗小,提示病灶周边组织相对疏松。5例(35.7%)FOP大病灶病变表现为结构疏松,表明FOP的组成成分不密集,可能由于病灶周围纤维肉芽组织增生所致。约79.1%(34/43)的肺癌病灶出现血管集束征、肺血管中断,提示肿瘤组织对肺血管的破坏,而FOP病变大部分可见肺血管穿过,较少出现肺血管突然中断。因此,病灶出现肺血管突然中断有利于周围型肺癌的诊断。
Greenberg-Wolff等[9]报道8例不明原因的OP出现纵隔淋巴结增大。本研究中,以短径>1 cm作为纵隔肺门淋巴结肿大的标准,5例FOP大病灶有纵隔淋巴结肿大,小病灶无一例出现淋巴结肿大;10例周围型肺癌出现纵隔淋巴结肿大,其中大病灶6例,小病灶4例;两组差异无统计学意义(P>0.05)。因此,将纵隔淋巴结肿大作为FOP及周围型肺癌的鉴别依据缺乏足够的证据,仍需进一步研究。
本研究表明,FOP与周围型肺癌在病变形态、边缘晕征及病灶与肺组织分界方面无显著差异,而在毛刺及病灶与胸膜的关系方面有显著差异。FOP大病灶有12例(85.7%)病灶与胸膜紧贴,而在周围型肺癌大病灶中仅5例(26.3%)出现此征象,提示对于直径>3 cm的病灶如出现与胸膜紧贴,病变性质更倾向于FOP。由于FOP大病灶多与胸膜紧贴,本研究中所有FOP大病灶均未出现胸膜凹陷,FOP小病灶仅8例(44.4%)出现胸膜凹陷;10例(52.6%)肺癌大病灶、19例(79.2%)小病灶出现胸膜凹陷。毛刺征的出现与促结缔组织增生性反应有关[10]。本研究中19例FOP出现长毛刺,多由病灶周围纤维化导致。29例肺癌出现短毛刺,提示癌组织向周围正常组织侵犯。
3.3FOP与周围型肺癌的强化特征姚灵等[11]报道周围型肺癌支气管动脉灌注血流量和肺动脉灌注血流量均高于中央型肺癌,认为肺癌的供血以支气管动脉为主。本组患者行CT增强扫描后,除2例肺癌强化方式表现为“快进快出”外,所有进行两期扫描病灶均表现为渐进性强化。两组在平扫CT值及静脉期较动脉期CT增加值差异均无统计学意义(P>0.05)。FOP动脉期CT值平均增加约30~31 HU,总CT增加值约40~42 HU,肺癌组动脉期CT值平均净增值18~20 HU,总CT净增值29~32 HU。两期增强扫描FOP在动脉期CT净增值及总CT净增值均大于肺癌组,与既往研究[12]基本相符。ROC曲线发现,动脉期CT增加值曲线下面积低于总CT增加值曲线下面积,提示两期增强扫描对于FOP与周围型肺癌的鉴别诊断高于单期增强扫描。
本研究的局限性:①本研究为回顾性研究,不能排除患者的选择偏倚;②本组各病灶样本量相对较少;③肺癌组未按病理类型进行分组,对于不同病理类型的肺癌,结果可能会有所不同。今后应进行多中心、大样本前瞻性研究,以验证本研究结果。
总之,不同病灶大小FOP与周围型肺癌的临床特征、CT征象及强化均有一定的差异性及特征性,在临床实践中应综合分析,对于不能确诊的病例,抗感染治疗后短期影像学随访具有一定的价值。
参考文献
[1]Zheng Z, Pan YM, Song CG, et al. Focal organizing pneumonia mimicking lung cancer: a surgeon's view. Am Surg, 2012, 78(1): 133-137.
[2]张旻, 邓晓涛, 谭晔, 等. 隐原性机化性肺炎的CT表现特点及激素治疗后改变. 中华放射学杂志, 2012, 46(3): 239-243.
[3]Zhao F, Yan SX, Wang GF, et al. CT features of focal organizing pneumonia: an analysis of consecutive histopathologically confirmed 45 cases. Eur J Radiol, 2014, 83(1): 73-78.
[4]Pipavath SN, Chung JH, Chien JW, et al. Organizing pneumonia in recipients of hematopoietic stem cell transplantation: CT features in 16 patients. J Comput Assist Tomogr, 2012, 36(4): 431-436.
[5]Cottin V, Cordier JF. Cryptogenic organizing pneumonia. Semin Respir Crit Care Med, 2012, 33(5): 462-475.
[6]Leef JL 3rd, Klein JS. The solitary pulmonary nodule. Radiol Clin North Am, 2002, 40(1):123-143.
[7]Huo Z, Feng RE, Tian XL, et al. Clinicopathological findings of focal organizing pneumonia: a retrospective study of 37 cases. Int J Clin Exp Pathol, 2015, 8(1): 511-516.
[8]Kohno N, Ikezoe J, Johkoh T, et al. Focal organizing pneumonia: CT appearance. Radiology, 1993, 189(1): 119-123.
[9]Greenberg-Wolff I, Konen E, Ben Dov I, et al. Cryptogenic organizing pneumonia: variety of radiologic findings. Isr Med Assoc J, 2005, 7(9): 568-570.
[10]Maldonado F, Daniels CE, Hoffman EA, et al. Focal organizing pneumonia on surgical lung biopsy: causes, clinicoradiologic features, and outcomes. Chest, 2007, 132(5): 1579-1583.
[11]姚灵, 郭晓山, 张千里. CT灌注成像技术分析原发性肺癌的血供模式. 中国医学影像学杂志, 2014, 22(8): 607-609.
[12]朱刚明, 李兆勇, 李扬彬, 等. 局灶性机化性肺炎的多层螺旋CT诊断及与周围型肺癌鉴别. 临床放射学杂志, 2014, 33(11): 1675-1679.
(本文编辑张春辉)
Chinese Journal of Medical Imaging 2016 Volume 24(2): 106-110
Multi-slice Spiral CT in Differential Diagnosis Between Focal Organizing Pneumonia and Peripheral Lung Cancer
【Abstract】Purpose To investigate the imaging features of focal organizing pneumonia (FOP), and to improve the value of multi-slice spiral CT in the differential diagnosis between FOP and peripheral lung cancer. Materials and MethodsThirty-two patients with pathologically confirmed FOP were enrolled, with 43 cases of randomly selected peripheral lung cancer as control group, the differences of clinical features, CT findings and enhancement pattern of large lesions (diameter>3 cm) and small lesions (diameter≤ 3 cm) between the two groups were compared. Results①Clinical features: there was significant difference in mean age and sex ratio of the small lesions between FOP and lung cancer groups (P<0.05), while there was no statistically significant difference of the smoking history, clinical symptoms and laboratory indicators of both large and small lesions between the FOP group and lung cancer group (P>0.05).②CT signs: there were significant differences in the distribution of lesions, vessel tract syndrome, burr, bronchial inflatable syndrome, structure loosing, pleural indentation between FOP group and lung cancer group in both large and small lesion group (P<0.05); there were statistically significant differences in voids, close to the pleura sign between FOP and lung cancer group on large lesions (P<0.05).③Contrast enhanced scan: there was no statistically significant difference in non-contrast CT value and venous phase added CT value to arterial phase between the two groups (P>0.05). The arterial phase net added CT value and the total added CT value of FOP were higher than those of the lung cancer group, and the differences were statistically significant (P<0.05). Conclusion There are some differences and characters of the clinical features, CT signs and contrast enhanced patterns between FOP and peripheral lung cancer, they should be analyzed comprehensively in clinical practice, for the cases that can't be diagnosed, short-term imaging follow-up after anti-inflammatory treatment may be helpful.
【Key words】Bronchiolitis obliterans organizing pneumonia; Lung neoplasms; Tomography, spiral computed; Pathology, surgical; Diagnosis, differential
收稿日期:2015-12-27
中图分类号
通讯作者文智
Doi:10.3969/j.issn.1005-5185.2016.02.006
