转基因水稻标准质粒分子的构建与分析
2016-04-17邓汉超王学林侯红利李永红杨启鹏陈惠芳周向阳
刘 晋 邓汉超 王学林 侯红利 李永红 杨启鹏 陈惠芳 周向阳
(农业部农作物种子质量监督检验测试中心(深圳)/深圳市农业科技促进中心,广东深圳518040)
转基因水稻标准质粒分子的构建与分析
刘 晋 邓汉超 王学林 侯红利 李永红 杨启鹏 陈惠芳 周向阳
(农业部农作物种子质量监督检验测试中心(深圳)/深圳市农业科技促进中心,广东深圳518040)
针对目前转基因(GM)产品检测标准分子的缺乏,构建适用于转基因水稻的标准质粒分子pMDSPS和pMDTheli,其中包含水稻内源基因SPS通用序列,耐盐基因ThST3和Ubiquitin启动子序列的构建特异性Theli序列。对其特异性及制备标准曲线的可靠性进行鉴定研究,研究结果显示,在进行普通PCR扩增时,采用质粒标准分子为阳性对照,均能特异扩增目的条带。以标准质粒分子构建的标准曲线,SPS基因的定量标准曲线的相关系数平均为0.9993,PCR扩增效率在1.0004~1.034之间;ThST3基因的定量标准曲线的相关系数平均为0.9937,PCR扩增效率在0.9358~0.9486之间。因此,构建的标准分子pMDSPS和pMDTheli既能作为普通PCR的阳性对照,也能用于定量标准曲线的构建,为转基因水稻的定量检测提供简便、价格低廉的标准分子打下基础。
标准质粒分子;实时荧光PCR;标准曲线;PCR效率
随着转基因(GM,genetically modified)技术的不断发展,产生(获得)更多优良的作物品种有望在解决全球粮食危机方面作出贡献,然而转基因产品的出现也引发公众对转基因产品影响食品安全与环境安全的担忧。因此,世界各国政府和组织都非常重视转基因作物及产品的食用安全的监管,纷纷建立转基因标识的制度。检测技术的发展为转基因作物及产品的监管提供了重要的技术保障,基于核酸的检测方法是目前转基因检测最为常用的检测方法。无论是基于核酸还是蛋白质的转基因检测方法,都需要阳性对照物质。标准物质既可以作为阳性对照,也可以用来绘制标准曲线用于定量分析。然而目前我国使用的大部分标准物质都是购买国外的产品,这些产品价格贵、针对转基因的品种少、货期长等,显然难以满足我国对不断增加的转基因产品监督检测的需求[1-2]。
质粒标准分子(plasmid standard molecule),是在质粒中重新组装目标基因或片段的分子。一般整合转基因的目标基因、序列(包括内源基因、外源基因、筛选基因、构建特异片段、品系特异片段等)。由于构建质粒标准分子的生产成本低、操作简便、技术成熟等特点,质粒标准分子已经公认成为一种解决转基因检测标准物质缺乏的有效方法[3-4]。这种方法已经大量地应用于转基因及其产品的定量检测之中。本研究旨在构建适用于转基因水稻检测的标准分子,并对其在特异性及制备标准曲线的可靠性进行检测。
1 材料与方法
1.1 材料转基因材料 转Theli基因水稻,非转基因水稻。
试剂 质粒DNA提取溶液Ⅰ、溶液Ⅱ、溶液Ⅲ;pMD-T载体连接试剂盒购自TaKaRa公司,TaKaRa Premix PCR试剂盒,100mg/mL氨苄青霉素、IPTG和X-Gal为大连宝生物公司产品,DH5α大肠杆菌为全式金产品,Qiagen Dneasy Plant Mini Kit DNA提取试剂盒,PCR产物纯化试剂盒为上海生工产品。
1.2 方法
1.2.1 DNA提取使用试剂盒Qiagen Dneasy Plant Mini Kit提取植物DNA,采用Neno1000检测DNA的浓度和纯度,将DNA稀释到10~50ng/μ L,-20℃保存备用。
1.2.2 引物和探针设计转Theli基因水稻的特异性引物(耐盐基因ThST3和Ubiquitin启动子序列),内源基因SPS引物使用L.X.Jiang等[5]引物。利用Primer5软件设计目标基因的引物和探针。设计的引物和探针由生工合成,详见表1。

表1 普通PCR及定量PCR所用引物和探针序列
1.2.3 质粒标准分子的构建普通PCR扩增目标基因片段 PCR扩增体系中Primex Ex Taq 10μL,F引物(10μmol/L)0.4μL,R引物(10μmol/L)0.4μL,DNA(10~50ng/μL)2μL,补充ddH2O至总体积20μL。PCR扩增程序为:94℃预变性2 min;40个循环(95℃ 30s,58℃30s,72℃ 40s);72℃延伸 2min;20℃10min。PCR产物电泳后采用PCR产物纯化试剂盒说明书进行回收。
连接 使用pMD-T克隆载体进行连接,1μL的10×T4 DNA Ligase Buffer,2μL的pMD-T载体,0.5μL的50μg/mL DNA,0.4μL的 T4 DNA Ligase,补充ddH2O至总体积10μL,在4℃冰箱中过夜连接。
转化 取连接产物5μ L加入含有100μ L的感受态细胞中,冰浴30min,然后42℃热激90s,于离心管加入500μ L LB液体培养基,将混匀离心管置于37℃摇床(220r/min,60min),最后用100μ L菌液涂板,37℃培养16h。
单克隆PCR鉴定 挑取单个白色克隆,于10μL双蒸水中稀释,取1μL稀释液作为模板进行PCR扩增,在2%琼脂糖凝胶中电泳PCR产物,凝胶成像鉴定,大小片段一致的单克隆送测序。
质粒标准DNA拷贝数测定与计算 大量表达制备标准质粒分子,采用Neno1000测定质粒DNA浓度,按下列公式计算拷贝数:质粒DNA拷贝数=质粒DNA浓度×上样质粒体积/质粒DNA分子量×6.02×1023(阿佛加德罗常数)。
1.2.4 实时荧光定量PCR(RT-PCR)定量PCR在ABI 7500荧光PCR仪上进行,反应体系为Primex Ex Taq 10μL,F引物(10μmol/L)0.4μL,R引物(10μmol/L)0.4μL,探针(10μmol/L)0.4μL,DNA(10~50ng/μL)2μL,补充ddH2O至总体积20μL。RT-PCR反应程序:95℃10s;40个循环(95℃5s,60℃ 34s)。
1.2.5 标准曲线的制作取5×109copies/μL的质粒DNA以10倍浓度梯度进行稀释,取稀释梯度为10-1~10-7共7个梯度的DNA为模板,每个梯度重复3次,进行RT-PCR反应。以拷贝数的对数为横坐标,Ct均值为纵坐标,绘制标准曲线,并获得定量的线性方程。
2 结果与分析
2.1 转基因标准质粒分子的构建及鉴定为了构建适用于转Theli基因水稻的特异性检测标准分子,分别将内源基因SPS(277bp)和外源基因Theli(1108bp)克隆到pMD-T载体中,得到pMDSPS(图1A)和pMDTheli(图1B)2个标准质粒分子,大小分别为2969bp和3800bp,质粒分子经基因测序,结果与目的序列完全一致。

图1 质粒标准分子结构图
2.2 质粒标准分子的特异性采用非转基因水稻基因组DNA、转Theli基因水稻基因组DNA、质粒标准分子为扩增模板,进行PCR扩增,经2%琼脂糖电泳显色,其结果见图2和图3。内源基因SPS均能在非转基因水稻基因组DNA、转Theli基因水稻基因组DNA、质粒标准分子特异扩增,对Theli序列的扩增(图3)可见转Theli基因水稻基因组DNA和pMDTheli质粒标准分子能特异扩增,而非转基因水稻和空白对照未见扩增。
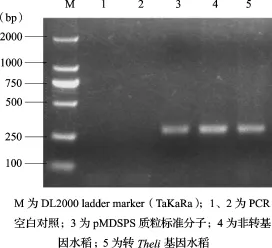
图2 SPS基因扩增检测结果
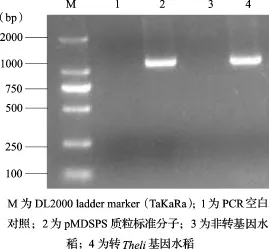
图3 Theli序列扩增检测结果
2.3 质粒标准曲线的可靠性分析使用质粒标准分子10倍梯度稀释产物,每个重复3次进行PCR扩增,获取的CT值与拷贝数对数分别绘制内源基因与目标基因的标准曲线,结果见扩增曲线及标准曲线(图4、图5),相关系数和PCR效率见表2。SPS基因的定量标准曲线(图4)的相关系数在0.9993~0.9994之间,平均为0.9993,PCR扩增效率在1.0004~1.034之间,平均为1.02;ThST3基因的定量标准曲线(图5)的相关系数在0.9876~0.9996之间,平均为0.9937,PCR扩增效率在0.9358~0.9486,平均为0.94。
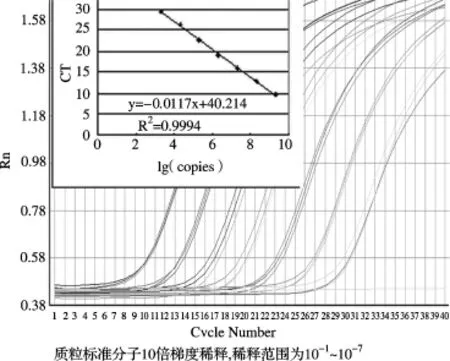
图4 SPS实时扩增曲线及标准曲线
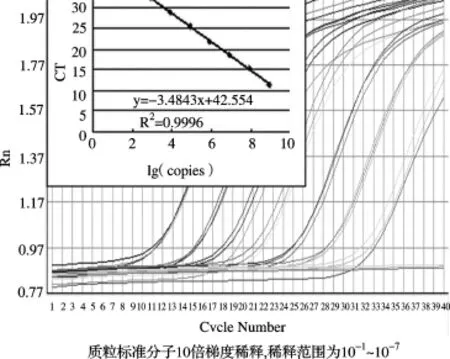
图5 ThST3实时扩增曲线及标准曲线
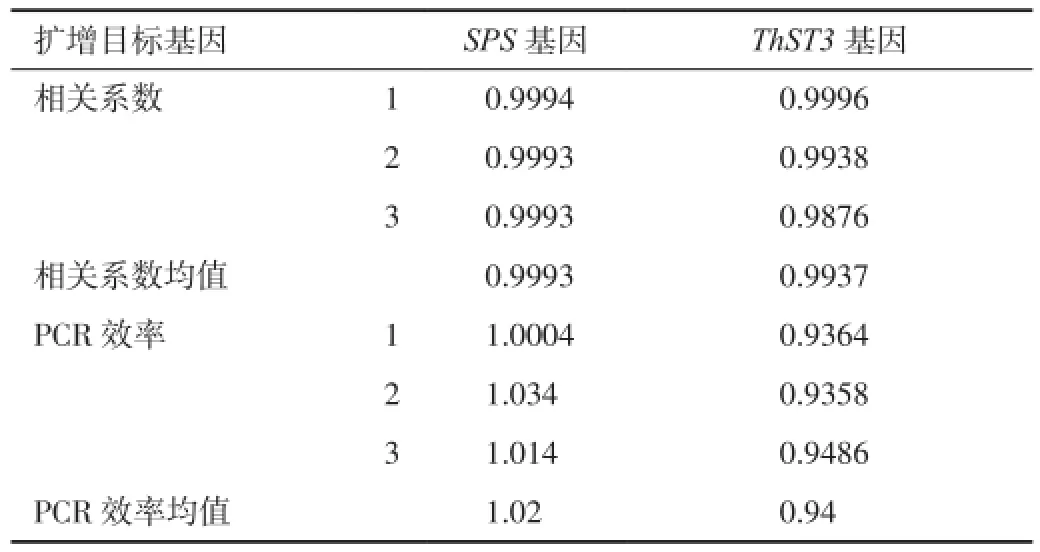
表2 质粒标准分子扩增目标基因的相关系数和PCR效率
3 结论与讨论
目前,检测转基因植物及其产品较为通用的标准物质主要来源于植物原材料本身,而且制备标准物质的过程非常复杂,需要精度很高的设备、生产成本较高、保存环境要求高等,为此难以获得全面的不同转基因植物的标准样品,市场上已经商业化的转基因标准物质仅有30种左右[6-8]。转基因成分的实时荧光定量检测依赖于标准物质,标准物质的缺乏直接制约转基因作物定量检测技术的发展和应用。近年来发展起来的质粒标准分子技术有望能解决这个难题,该方法已经不断的被研究者所接受[9-11]。因此,本研究着力构建适用于转基因水稻的标准质粒分子pMDSPS和pMDTheli,其中包含水稻内源基因SPS通用序列,耐盐基因ThST3和Ubiquitin启动子序列的构建特异性Theli序列。对其特异性及制备标准曲线的可靠性进行检测,结果表明,以质粒标准分子为标准阳性对照的普通PCR扩增中,均能特异扩增目的条带。以标准质粒分子构建的标准曲线,SPS基因的定量标准曲线的相关系数平均为0.9993,PCR扩增效率在1.0004~1.034之间;ThST3基因的定量标准曲线的相关系数平均为0.9937,PCR扩增效率在0.9358~0.9486。因此,构建的标准分子pMDSPS和pMDTheli既能作为普通PCR的阳性对照,也能用于定量标准曲线的构建,为转基因水稻的定量检测提供简便、价格低廉的标准分子打下基础。
[1] 敖金霞,高学军.转基因大豆、玉米和水稻外源基因检测通用标准分子的构建.中国农业大学学报,2008,13(6):19-24
[2] Yang L T,Guo J C,Pan A H,et al.Event-specific quantitative detection of nine genetically modified maizes using one novel standard reference molecule.J Agric Food Chem,2007,55(1):15-24
[3] 沈愷琳,李想,王姝,等.四种转基因玉米新型质粒标准分子协同实验验证.中国农业科技导报,2009,11(5):2-6
[4] Zhang H,Yang L,Guo J,et al.Development of one novel multiple-target plasmid for duplex quantitative PCR analysis of roundup ready soybean. J Agric Food Chem,2008,56(1):5514-5520
[5] Jiang L X,Yang L T,Zhang H B,et al.International collaborative study of the endogenous reference gene,Sucrose Phosphate Synthase(SPS),Used for qualitative and quantitative analysis of genetically modified rice. J Agric Food Chem,2009,57:3525-3532
[6] Vaitilingom M,Pijnenburg H,Gendre F,et al. Real-time quantitative PCR detection of genetically modified Maximizer maize and Roundup Ready Soybean in some representative foods. J Agric Food Chem,1999,47(12):5261-5266
[7] Huang C,Pan T. Event-specific real-time detection and quantification of genetically modified Roundup Ready soybean. J Agric Food Chem,2005,53(10):3833-3839
[8] Liu G M,Li Q G,Wang Q L,et al. Multiplex fluorescence PCR method for detecting transgenic component 35S and nos simultaneously. Jorunal of Xiamen University(Natural Science),2002,41(4):493-497
[9] Höhne M,Santisi C,Meyer R. Real-time multiplex PCR:An accurate method for the detection and quantification of 35S-CaMV promoter in genetically modified maize-containing food. European Food Research and Technology,2002,215(1):59-64
[10] Yang X K,Guo L Y,Yang D Y,et al. Progress in quantitative analysis technology of genetically modified organisms. Chinses Journal of Health Laboratory Technology,2008,18(8):1682-1686
[11] Salvi S,D′orso F,Morelli G. Detection and quantification of genetically modified organisms using very short,locked nucleic acid TaqMan probes. J Agric Food Chem,2008,56(12):4320-4327
2016-10-13)
深圳市技术创新项目(CXZZ20120614165508810);转基因新品种培育重大专项(2009ZX08001-023B)
邓汉超
