瘢痕疙瘩中成纤维细胞耐药基因mdr1的研究
2016-04-16陈亚红曲淼王文波刘伟武晓莉
陈亚红 曲淼 王文波 刘伟 武晓莉
瘢痕疙瘩中成纤维细胞耐药基因mdr1的研究
陈亚红曲淼王文波刘伟武晓莉
【摘要】目的研究瘢痕疙瘩成纤维细胞(KF)与正常皮肤组织成纤维细胞(NF)耐药基因mdr1的表达差异。方法利用RT-PCR、免疫组化及流式细胞分析等方法,检测瘢痕疙瘩与正常皮肤组织中成纤维细胞耐药基因mdr1及其蛋白ABCB1的表达;并对30例不同部位瘢痕疙瘩的ABCB1蛋白表达量进行流式细胞分析。结果瘢痕疙瘩成纤维细胞中耐药基因mdr1及其蛋白ABCB1的表达明显高于正常皮肤;流式细胞分析显示,瘢痕疙瘩原代成纤维细胞中ABCB1表达率:胸部>背部、腹部,差异有统计学意义。结论瘢痕疙瘩成纤维细胞表达耐药基因mdr1及其蛋白ABCB1,且较正常皮肤中的表达量增高。
【关键词】瘢痕疙瘩成纤维细胞多药耐药基因
瘢痕疙瘩(Keloid)具有超过原始损伤边界,向周围正常组织浸润[1],呈“蟹足”样生长的特性,一般无自愈倾向,且极少自发消退。单纯的药物注射、手术切除、激光或放疗等治疗后均易复发,生长超过原瘢痕范围[2],具有类似肿瘤生长的特点,因此存在瘢痕疙瘩肿瘤源性学说[3-5];然而,经抗肿瘤药物治疗后瘢痕疙瘩仍具有一定的复发率[6],并呈现出瘢痕疙瘩局部组织对治疗药物不敏感的现象,表明瘢痕疙瘩和肿瘤的生长具有某些相似性,提示了瘢痕疙瘩可能有着与肿瘤类似的“细胞耐药”机制存在。
关于肿瘤细胞的耐药机制,最新的学说认为是由于肿瘤干细胞(Tumor stem cell,TSC)表达耐药基因所致[7-8]。TSC指肿瘤中存在的少量具有自我更新能力、分化潜能,并能产生异质性肿瘤细胞的细胞。TSC理论认为,肿瘤可能是由TSC产生,而TSC则可能由正常组织干细胞突变形成[9]。更重要的是TSC还表现出对多种抗肿瘤药物的耐药性(表达耐药基因),被认为是导致肿瘤化疗失败的重要原因。
耐药基因是一种在细胞膜表面表达的ATP-binding cassette(ABC)家族膜转运蛋白[10],这类蛋白通过ATP水解供能,逆浓度梯度将代谢产物、药物、毒性物质、染料等多种物质泵出细胞外,导致细胞内药物或染料浓度降低,而产生多药耐药及外排染料等表型[10]。ABC转运蛋白家族参与肿瘤多药耐药的成员中,研究最深入是ABCB1。ABCB1由多药耐药基因mdr1(multidrug resistance 1)所编码,通过其疏水位点与疏水性抗肿瘤药物,如长春新碱或盐酸米托蒽醌结合,经ATP水解供能,逆浓度梯度将药物泵出细胞外,导致细胞内药物浓度降低而产生耐药,这种泵出作用能够通过ABCB1抑制剂维拉帕米(Verapamil)的作用而逆转[11-12]。ABCB1在多种癌细胞中过表达,是细胞内聚集足量药物的主要障碍之一,超过90%的转移癌患者临床治疗失败与mdr1基因过表达有关[13-14]。
鉴于瘢痕疙瘩浸润性的生长方式及治疗后易于产生药物耐药性等特性,我们认为瘢痕疙瘩中可能也存在着表达耐药基因的细胞。本研究以正常皮肤为对照,检测瘢痕疙瘩组织中成纤维细胞耐药基因mdr1的表达状况,探索瘢痕疙瘩对于药物治疗产生耐药性的机理。
1 材料和方法
1.1试验试剂
0.2%Ⅰ型胶原酶(Worthington,USA);DMEM培养液(Gibco,USA);磷酸盐缓冲液、0.25%胰蛋白酶(上海思吉生物制品有限公司);胎牛血清(上海华美生物工程公司);mdr1引物(上海生工生物工程技术服务有限公司);ABCB1鼠抗人抗体(Chemicon,USA);ABCB1流式检测抗体(Ebioscience,USA)。
1.2方法
瘢痕疙瘩及正常皮肤标本均来源于手术切除的瘢痕疙瘩组织及正常皮肤组织,获患者及家属知情同意(表1)。
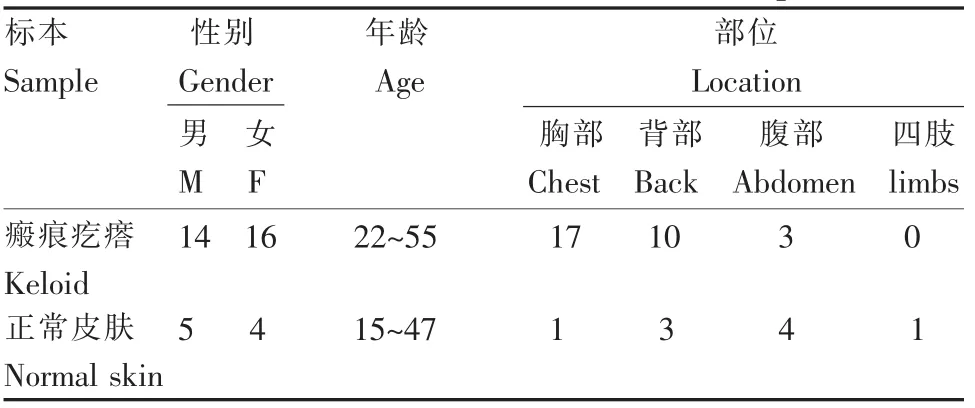
表1 瘢痕疙瘩与正常皮肤标本Table 1The data of keloid and normal dermal specimens
1.2.1获取KF和NF组织中成纤维细胞
将获得的KF和NF组织用氯霉素、PBS各振荡洗涤3遍,去除血渍及其他组织碎片;无菌条件下去除表皮和皮下脂肪组织,将KF和NF真皮部分剪至1 mm×1 mm×1 mm大小,PBS振荡洗涤1遍后加入0.2%Ⅰ型胶原酶,37℃恒温振荡消化,6~8 h(正常皮肤4~6 h)后收获真皮层细胞。取少量细胞,加入台盼蓝溶液进行拒染试验,血球记数板活细胞计数。用低糖DMEM培养液重悬细胞,以1×106个/皿的密度接种于10 cm培养皿,置37℃、5%CO2恒温培养箱培养。
1.2.2RT-PCR检测mdr1基因在KF及NF成纤维细胞中的表达
预冷的PBS冲洗KF及NF成纤维细胞2遍,各加入1 ml Trizol和4℃氯仿400 μL,剧烈振荡10 sec,室温下静置15 min,4℃、12 000 r/min离心15 min;取0.5 mL上清于另一EP管内,加入4℃异丙醇500 μL,混匀,静置10 min,4℃、12 000 r/min离心10 min;弃上清后加入75%乙醇1 mL,振荡;4℃、7 500 r/min离心10 min;弃上清;50 μL 0.01%DEPC水溶解混匀,测OD值,瞬时离心。按说明书进行逆转录和real time-PCR检测(表2)。

表2 mdr1和β-actin的基因引物序列Table 2Gene primer sequences of mdr1 and β-actin
1.2.3免疫组织化学法检测ABCB1蛋白在KF及NF组织中的表达
常规石蜡包埋,5 μm连续切片,60℃烤片1 h后脱蜡,PBS冲洗3 min×3次;体积分数3%的H2O2阻断内源性过氧化物酶,室温下放置15 min,PBS冲洗3 min×3次;滴加山羊血清30 μL阻断非特异性抗原,室温下15 min,倾去勿洗,滴加30 μL一抗(鼠抗人ABCB1),抗体1∶100稀释,4℃湿盒过夜;PBS冲洗3 min×3次,滴加30 μL生物素化二抗,37℃孵育30 min;PBS冲洗3 min×3次,DAB室温下避光显色;自来水冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树脂封固。以PBS代替一抗作为空白对照,镜下观察并拍照。
1.2.4流式细胞分析KF及NF组织成纤维细胞中ABCB1蛋白的表达
将KF和NF原代细胞消化后,4%FBS-PBS缓冲液重悬,滤网过滤为单细胞悬液,进行记数;离心1 500 r/min,5 min;弃废液,加入4%FBS-PBS缓冲液中稀释,平均分装入EP管中,每管细胞数约为0.5×106个;加入抗体,抗体1∶20稀释,充分震荡混匀;置于冰盒内30 min,每隔10 min将细胞悬液震荡混匀;30 min后,以4%FBS-PBS(500 μL/EP管)洗涤离心2次,充分洗净残余抗体;上流式细胞仪进行流式检测。
1.2.5统计分析
2 结果
2.1RT-PCR检测mdr1基因在KF和NF成纤维细胞中的表达
我们对6例KF和6例NF真皮成纤维细胞进行了RT-PCR检测,在基因水平上检测两者成纤维细胞中mdr1的表达差异。结果显示,KF成纤维细胞中mdr1基因表达量较高,明显高于NF,差异具有统计学意义(P<0.05)(图1)。
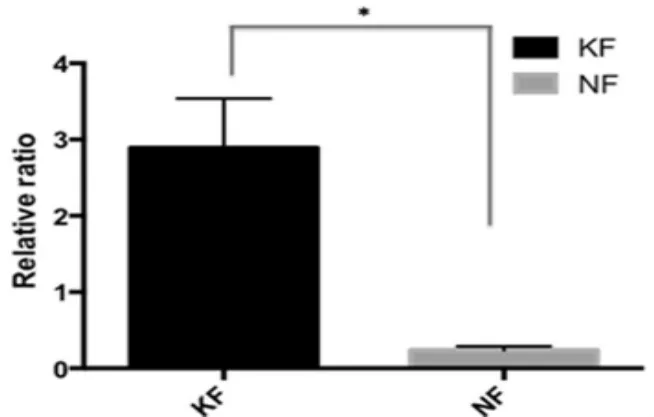
图1 瘢痕疙瘩和正常真皮组织中mdr1的基因表达情况分析(*:P<0.05)Fig.1The expression of mdr1 gene in keloid and normal dermis(*:P<0.05)
2.2免疫组织化学染色检测ABCB1蛋白在KF和NF中的表达
我们对5例KF和3例NF进行了免疫组织化学染色。KF中ABCB1阳性细胞散在分布于真皮层,同一标本不同区域的阳性细胞密度有一定差异,不同标本间阳性细胞的比例亦有所不同,反映出KF标本个体间差异较大;而在NF真皮层中亦存在ABCB1阳性细胞,但较稀少。对每个视野(400×)中ABCB1阳性细胞数进行定量分析,KF和NF中ABCB1阳性细胞数分别为(9.08±2.65)和(0.60±0.16),占比分别为(8.53±3.28)%和(1.15±0.41)%,KF中ABCB1阳性细胞数明显高于NF组织,差异有统计学意义(P<0.01)(图2)。

图2 瘢痕疙瘩和正常真皮组织中ABCB1蛋白表达情况分析Fig.2ABCB1 protein expression in keloids and normal dermis
2.3流式细胞分析ABCB1蛋白在KF及NF成纤维细胞中的表达
我们对3例KF和3例NF的原代细胞进行了ABCB1流式分析。ABCB1在原代KF中有表达,在KF原代细胞中ABCB1的表达率较高,为(3.71± 0.71)%,而NF原代细胞中ABCB1表达率比较低,约为0.13%。总体上两种标本来源的原代细胞中都可以检测到ABCB1的表达,KF组表达水平要明显高于NF组,差异有统计学意义(P<0.05)(图3)。
2.4不同部位KF成纤维细胞中ABCB1的表达结果分析
30例KF流式细胞分析ABCB1蛋白表达量结果显示,KF原代成纤维细胞中ABCB1表达为胸部明显高于背部和腹部,差异显著(P<0.05)(图4)。
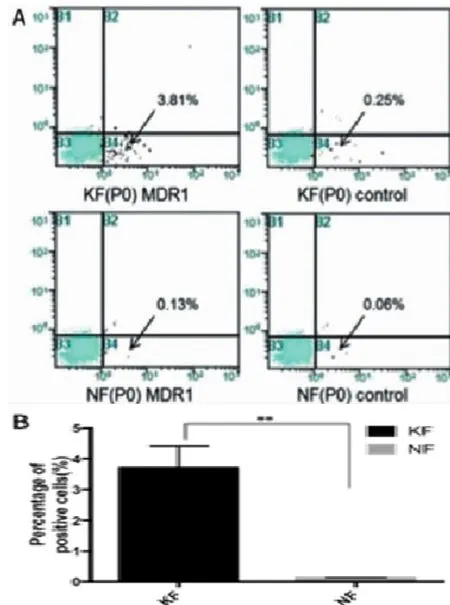
图3 KF、NF原代细胞中ABCB1表达水平的流式细胞检测及分析结果(*:P<0.05)Fig.3ABCB1 expression in keloid fibroblasts and normal dermal fibroblasts by flow cytometry(*:P<0.05)
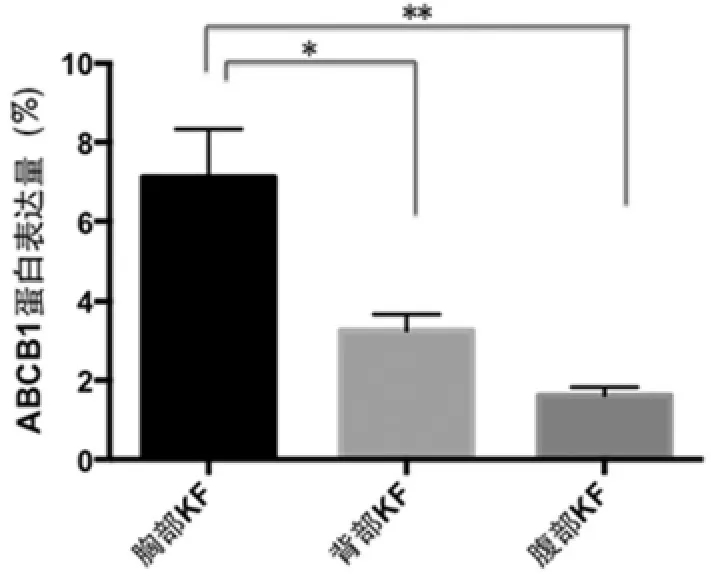
图4 不同部位瘢痕疙瘩成纤维细胞中ABCB1的蛋白表达(*:P<0.05;**:P<0.01)Fig.4The expression of ABCB1 protein in fibroblasts of different body parts of keloid(*:P<0.05;**:P<0.01)
3 讨论
瘢痕疙瘩是自发或继发于皮肤损伤,以胶原过度沉积于真皮和皮下组织为特征的过度纤维化疾病,是人类特有的病理现象,好发于胸骨区、肩背部、下颌部及耳部等,且具有一定的遗传倾向及家族聚集性[15-17],多见于有色人种。瘢痕疙瘩的发病机理尚未明确,治疗后极易复发,导致临床缺乏切实有效的治疗手段[18-19],严重者伴有长期感染,甚至恶化,造成患者极大的身心痛苦和经济负担。
目前虽有多种治疗手段,但瘢痕疙瘩经过各种单一治疗后都易复发,复发范围可超过原瘢痕范围[2]。糖皮质激素或抗肿瘤药物瘢痕内注射是最为有效的治疗手段,但治疗一段时间后机体可能对该药物产生耐药性,导致治疗效果减弱。此外,瘢痕疙瘩可以采用抗肿瘤药物,如5-氟尿嘧啶(5-FU)、平阳霉素、秋水仙碱、丝裂霉素等进行治疗[6,22],治疗后大部分瘢痕疙瘩会出现萎缩,但仍存在一定的复发率,并出现瘢痕疙瘩局部组织对治疗药物不敏感的现象,提示瘢痕疙瘩可能存在与肿瘤类似的“细胞耐药”机制[23]。
关于肿瘤细胞的耐药机制,最新的学说认为是由于肿瘤干细胞(Tumor stem cell,TSC)表达耐药基因所致[7-8],即TSC表现出对多种抗肿瘤药物的耐药性(表达耐药基因)。肿瘤对化疗药物固有或获得性耐受,是阻碍化疗成功的巨大障碍。在肿瘤耐药基因的研究中,以对ABC蛋白家族的研究较为深入。ABC蛋白家族为细胞膜上的药物流出泵,在细胞耐药机制中起重要作用[24]。例如,急性白血病的化疗失败与癌细胞ABCB1,ABCB2及米托蒽醌耐药蛋白(Mitoxantrone resistance protein,MXR)的过表达密切相关[25-26]。近年来,随着对ABCB1研究的深入,ABCB1被公认为导致多种细胞耐药的蛋白,运用药物SCI-1776阻断ABCB1的表达,可以提高癌症化疗成功率[27]。而Song等[23]发现,瘢痕疙瘩成纤维细胞对长春新碱和米多蒽醌存在耐药性,提示瘢痕疙瘩成纤维细胞可能也存在耐药基因的过表达。
本研究结果显示,mdr1基因在瘢痕疙瘩成纤维细胞中表达明显上调,提示瘢痕疙瘩的发病和复发可能与耐药基因mdr1的过表达有关;此外,免疫组化及流式细胞分析结果显示,瘢痕疙瘩比正常皮肤组织含有更多ABCB1阳性细胞,说明KF对抗肿瘤药物的耐受很可能与ABCB1的表达有关。ABCB1阳性细胞亚群在瘢痕疙瘩的发病中可能具有重要的意义,该亚群可能是瘢痕疙瘩组织中的瘢痕疙瘩干细胞,正是由于该群细胞的存在,造成瘢痕疙瘩出现耐药性和高复发、浸润性生长等特点。
对发生在机体不同部位的瘢痕疙瘩,流式分析发现,胸部的瘢痕疙瘩成纤维细胞ABCB1表达阳性率最高,人体胸部张力相对较高[28],是瘢痕疙瘩最易发生的部位,说明瘢痕疙瘩成纤维细胞中ABCB1的表达可能与瘢痕疙瘩的生长环境有一定的联系,张力较大的环境利于瘢痕疙瘩干细胞的生长。后续实验中,我们选取患者胸部的瘢痕疙瘩成纤维原代细胞进行流式细胞分选,筛选出ABCB1阳性和阴性细胞进行培养,但细胞活力差,悬浮在培养皿中,未能继续进一步验证ABCB1阳性细胞是否就是瘢痕疙瘩干细胞。
结合本研究,我们认为瘢痕疙瘩成纤维细胞中膜转运蛋白表达的增强可能与瘢痕疙瘩的耐药性相关。膜转运蛋白与瘢痕疙瘩干细胞之间的关系及其在瘢痕疙瘩发病中的作用,需要深入研究,以揭示瘢痕疙瘩耐药及易复发的机制,为瘢痕疙瘩的治疗提供新思路。
参考文献
[1]Muir IF.On the nature of keloid and hypertrophic scars:a review [J].Br J Plast Surg,1990,43(1):61-69.
[2]Gao Z,Wu X,Song N,et al.Differential expression of growth differentiation factor-9 in keloids[J].Burn,2010,36(8):1289-1295.
[3]Vincent AS,Phan TT,Mukhopadhyay A,et al.Human skin keloid fibroblasts display bioenergetics of cancer cells[J].J Invest Dermatol,2008,128(3):702-709.
[4]Satish L,Lyons-Weiler J,Hebda PA,et al.Gene expression patterns in isolated keloid fibroblasts[J].Wound Repair Regen, 2006,14(4):463-470.
[5]蔡景龙.瘢痕疙瘩发生的肿瘤源性学说[J].中华医学杂志,2009, 89(16):1084-1087.
[6]Al-Attar A,Mess S,Thomassen JM,et al.Keloid pathogenesis and treatment[J].Plast Reconstr Surg,2006,117(1):286-300.
[7]Sabisz M,Skladanowski A.Cancer stem cells and escape from drug-induced premature senescence in human lung tumor cells: implications for drug resistance and in vitro drug screening models[J].Cell Cycle,2009,8(19):3208-3217.
[8]Gangemi R,Paleari L,Ferrini S,et al.Cancer stem cells:a new paradigm for understanding tumor growth and progression and drug resistance[J].Curr Med Chem,2009,16(14):1688-1703.
[9]Polyak K,Hahn WC.Roots and stems:stem cells in cancer[J]. Nat Med,2006,12(3):296-300.
[10]Donnenberg VS,Donnenberg AD.Multiple drug resistance in cancer revisited:the cancer stem cell hypothesis[J].J Clin Pharmacol, 2005,45(8):872-877.
[11]Huang Y,Sadee W.Membrane transporters and channels in chemoresistance and-sensitivity of tumor cells[J].Cancer Lett,2006,239 (2):168-182.
[12]Svirnovski AI,Shman TV,Serhiyenka TF,et al.ABCB1 and ABCG2 proteins,their functional activity and gene expression in concert with drug sensitivity of leukemia cells[J].Hematology, 2009,14(4):204-212.
[13]Longley DB,Johnston PG.Molecular mechanisms of drug resistance [J].J Pathol,2005,205(2):275-292.
[14]Shen J,Wang Q,Hu Q,et al.Restoration of chemosensitivity by multifunctional micelles mediated by P-gp siRNA to reverse MDR[J].Biomaterials,2014,35(30):8621-8634.
[15]Brown JJ,Ollier W,Arscott G,et al.Genetic susceptibility to keloid scarring:SMAD gene SNP frequencies in Afro-Caribbeans[J]. Exp Dermatol,2008,17(7):610-613.
[16]De Felice B,Ciarmiello LF,Mondola P,et al.Differential p63 and p53 expression in human keloid fibroblasts and hypertrophic scar fibroblasts[J].DNA Cell Biol,2007,26(8):541-547.
[17]胡振富,罗力生,罗盛康.病理性瘢痕中c-myc、c-fos和ras原癌基因表达的实验研究[J].中华整形外科杂志,2002,18(3):165-167. A comparative analysis with Western centers[J].Ann Plast Surg, 2014,72(1):50-55.
[22]Kang EH,Yamaguchi T,Tajima A,et al.Association of the growth hormone receptor gene polymorphisms with mandibular height in a Korean population[J].Arch Oral Biol,2009,54(6):556-562.
[23]Tomoyasu Y,Yamaguchi T,Tajima A,et al.Further evidence for an association between mandibular height and the growth hormone receptor gene in a Japanese population[J].Am J Orthod Dentofacial Orthop,2009,136(4):536-551.
[24]Keogh IJ,Troulis MJ,Monroy AA,et al.Isolated microtia as a marker for unsuspected hemifacial microsomia[J].Arch Otolaryngol Head Neck Surg,2007,133(10):997-1001.
[25]Tuin AJ,Tahiri Y,Paine KM,et al.Clarifying the relationship among the different features of the OMENS+classification in craniofacial microsomia[J].Plast Reconstr Surg,2015,135(1): 149e-156e.
[18]Ghazizadeh M,Tosa M,Shimizu H,et al.Functional implications of the IL-6 signalingpathway in keloid pathogenesis[J].J Invest Dermatol,2007,127(1):98-105.
[19]Niessen FB,Spauwen PH,Schalkijk J,et al.On the nature of hypertrophicscars and keloids:a review[J].Plast Reconstr surg, 1999,104(5):1435-1458.
[20]Tanaka A,Hatoko M,Tada H,et al.Expression of p53 family in scars[J].J Dermatol Sci,2004,34(1):17-24.
[21]Witt E,Maliri A,McGrouther DA,et al.RAC activity in keloid disease:comparative analysis of fibroblasts from margin of keloid to its surrounding normal skin[J].Eplasty,2008,8:e19.
[22]陈发国,姜萍,张建军,等.丝裂霉素C治疗产瘢痕疙瘩21例[J].皮肤病与性病,2006,28(4):40-41.
[23]Song N,Wu X,Gao Z,et al.Enhanced expression of membrane transporter and drug resistance in keloid fibroblasts[J].Hum Pathol,2012,43(11):2024-2032.
[24]Szakács G,Paterson JK,Ludwig JA,et al.Targeting multidrug resistance in cancer[J].Nat Rev Drug Discov,2006,5(3):219-234.
[25]Benderra Z,Faussat AM,Sayada L,et al.Breast cancer resistance protein and P-glycoprotein in 149 adult acute myeloid leukemias [J].Clin Cancer Res,2004,10(23):7896-7902.
[26]Damiani D,Tiribelli M,Calistri E,et al.The prognostic value of P-glycoprotein(ABCB)and breast cancer resistance protein (ABCG2)in adults with de novo acute myeloid leukemia with normal karyotype[J].Haematologica,2006,91(6):825-828.
[27]Natarajan K,Bhullar J,Shukla S,et al.The Pim kinase inhibitor SGI-1776 decreases cell surface expression of P-glycoprotein (ABCB1)and breast cancer resistance protein(ABCG2)and drug transport by Pim-1-dependent and-independent mechanisms [J].Biochem Pharmacol,2013,85(4):514-524.
[28]Ogawa R.Keloid and hypertrophic scarring may result from a mechanoreceptor or mechanosensitive nociceptor disorder[J]. Med Hypotheses,2008,71(4):493-500.
Research of Drug Resistance Gene MDR1 in Keloid Fibroblasts
CHEN Yahong,QU Miao,WANG Wenbo,LIU Wei,WU Xiaoli.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai Key Laboratory of Tissue Engineering,Shanghai 20001l,China.Corresponding author:WU Xiaoli(E-mail:wuxiaoli528@126.com).
【Abstract】ObjectiveTo compare the expression of drug resistance gene mdr1 between keloid fibroblast(KF)and normal dermal fibroblast(NF).MethodsThe expression of drug resistance gene mdr1 and its corresponding protein ABCB1 in KF and NF were assessed with real-time PCR,immunohistochemical and flow cytometry.The expression of ABCB1 protein in 30 cases of keloid was analyzed by flow cytometry.ResultsThe expression of mdr1 and ABCB1 in keloid was significantly higher than in normal skin;The expression rate of ABCB1 of the primary fibroblasts in pectoral keloid was higher than in abdominal and dorsal keloid.ConclusionDrug resistance gene mdr1and its corresponding protein ABCB1are all expressed in KF,and the expression amount is much higher than in NF.
【Key words】Keloid;Fibroblast;Multi-drug resistance gene
收稿日期:(2015年12月4日;修回日期:2015年12月23日) (2015年11月15日;修回日期:2015年12月28日)
通信作者:武晓莉(E-mail:wuxiaoli528@126.com)。
doi:10.3969/j.issn.1673-0364.2016.01.003
【中图分类号】R619+.6
【文献标识码】A
【文章编号】1673-0364(2016)01-0011-05
作者单位:200011上海市上海交通大学医学院附属第九人民医院整复外科。
