杏鲍菇甲壳素对大鼠实验性脂肪肝的预防作用
2016-04-15黄家福林娇芬欧一新刘静娜庄诗怡潘秋瑜潘裕添闽南师范大学菌物产业工程技术中心福建漳州363000
黄家福,林娇芬,欧一新,刘静娜,曹 娜,庄诗怡,潘秋瑜,潘裕添(闽南师范大学菌物产业工程技术中心,福建 漳州 363000)
杏鲍菇甲壳素对大鼠实验性脂肪肝的预防作用
黄家福,林娇芬,欧一新,刘静娜,曹 娜,庄诗怡,潘秋瑜,潘裕添*
(闽南师范大学菌物产业工程技术中心,福建 漳州 363000)
摘 要:为研究杏鲍菇甲壳素对脂肪肝的预防作用,采用给脂肪肝模型大鼠对其喂食不同浓度杏鲍菇甲壳素,以考来烯胺为阳性对照,饲养5 周后观察其血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、总甘油三酯(total triglycerides,TG)水平,肝脏组织中的TC、TG、丙二醛(malonaldehyde,MDA)水平、超氧化物歧化酶(superoxide dismutase,SOD)活性及肝组织病理学变化情况。结果表明:杏鲍菇甲壳素能极显著性(P<0.01)地降低大鼠血清中ALT、AST、TC、TG水平,显著提高肝脏组织中SOD活性(P<0.05)、降低MDA活性,减轻肝组织脂肪性样变,减少TC、TG在肝组织中积累,并呈现剂量效应,并值得注意的是,与考来烯胺组相比,杏鲍菇甲壳素高剂量组的预防效果与之相近,无差异性(P>0.05)。结论:杏鲍菇甲壳素具有预防脂肪肝形成的作用。
关键词:杏鲍菇;甲壳素;实验性脂肪肝;预防
引文格式:
黄家福,林娇芬,欧一新,等.杏鲍菇甲壳素对大鼠实验性脂肪肝的预防作用[J].食品科学,2016,37(5):219-222.
HUANG Jiafu,LIN Jiaofen,OU Yixin,et al.Preventive effect of chitin from Pleurotus eryngii on fatty liver in rats[J].Food Science,2016,37(5):219-222.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605039.http://www.spkx.net.cn
甲壳素是2-乙酰胺基-2-脱氧-β-D-葡萄糖单体通过β-1,4糖苷键相连的线性多糖,也是自然界中少见的一种带正电荷的碱性多糖,广泛存在于昆虫类、水生甲壳类的外壳和菌类、藻类的细胞壁中[1]。具有无毒性、亲水性、生物相溶性、生物可降解性、抗菌性等特点,广泛应用于生物医用材料[2-3]、生物医药[4-5]、生物农药[6-7]、保健食品[8-9]、环保[10-11]、复合材料[12-14]等领域。
随着经济高速发展,人民生活习惯和饮食结构随之发现相应改变,脂肪肝的发病率也呈快速持续上升的趋势。脂肪肝可分为酒精性脂肪肝和非酒精性脂肪肝,后者又根据其病因分为肥胖性脂肪肝、高脂血症性脂肪肝、糖尿病性脂肪肝、营养失调性脂肪肝、药物性脂肪肝等[15]。非酒精性脂肪肝并不是一种良性及静止的病变,它可在较短期内发展为不可逆的肝损害,进一步发展为脂肪性肝炎、脂肪性肝纤维化、脂肪性肝硬化[16]。目前,国内外尚未有理想预防脂肪肝的药物,然而,据Neyrinck[17]和Zacour[18]等的报道,甲壳素可以减少热量的摄入以及甘油三酯在肝脏中积累,并且可以抑制血脂水平,而且本研究中的甲壳素来自于杏鲍菇,其蛋白质、灰分、砷等含量较低,有别于虾蟹壳来源的甲壳素。基于前者的研究基础上,本课题组通过建立高脂血症性脂肪肝模型,观察杏鲍菇甲壳素预防脂肪肝形成的作用,为开发天然药物和功能食品、拓展传统的杏鲍菇产业链提供理论基础和科学依据。
1 材料与方法
1.1材料与试剂
48 只清洁级雄性Sprague-Dawley(SD)大鼠购自上海斯莱克实验动物有限公司,体质量(100±20) g,动物许可证号:SCXK(沪)2012-0002,合格证编号:2007000546954,环境温度(22±2) ℃,每日光照12 h,分笼饲养,自由取食和饮水,适应环境饲养7 d。
高脂饲料(质量分数为78.8%,下同):基础饲料、1%胆固醇、10%蛋黄粉、10%猪油、0.2%胆盐,基础饲料 上海斯莱克实验动物有限公司。
杏鲍菇甲壳素(Pleurotus eryngii chitin,PC)闽南师范大学菌物产物工程技术中心实验室;考来烯胺 南京厚生药业有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、总甘油三酯(total triglycerides,TG)试剂盒 深圳迈瑞生物医疗电子股份有限公司;丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒 南京建成生物工程研究所。
1.2仪器与设备
UV-1100紫外-可见分光光度计 上海美谱达仪器有限公司;PRO200组织匀浆器 美国Pro Scientific公司;超低温冰箱 美国Thermo公司;高速冷冻离心机 德国Eppendorf公司;生物相差数码显微镜 日本Olympus公司;电子分析天平 日本Shimadzu公司;全自动生化分析仪 迈瑞生物医疗公司;组织切片机 德国Slee公司;EG1150组织包埋机、组织脱水机 德国Leica公司;漩涡振荡器 Minishaker公司。
1.3方法
1.3.1分组与给药
取适应环境后的雄性SD大鼠48 只,随机分为6 组,每组8 只,设正常组、模型组、考来烯胺组、PC高剂量组、PC中剂量组、PC低剂量组,除正常组给予基础饲料外,模型组等5 组均饲以高脂饲料,同时考来烯胺组(1 g/(kg·d))、PC高剂量组(1 g/(kg·d))、PC中剂量组(0.5 g/(kg·d))、PC低剂量组(0.25 g/(kg·d))按体质量比(10 mL/kg)灌胃给药,正常组、模型组给予同等剂量的质量分数为0.2%羧甲基纤维素钠,每日1 次,连续给药5 周后。每天观察大鼠生活状况,定时称质量,记录进食情况,并于每天19:00灌胃给药,给药前2 h禁食[19-20]。
1.3.2观察指标及测定方法
末次给药后,禁食禁水12 h,称体质量,尾静脉取血,3 000 r/min、4 ℃条件下离心5 min,采用全自动生化仪测测血清中TG、TC、AST、ALT含量,颈椎脱臼处死,取肝脏,称质量,取肝左小叶置10%的福尔马林固定,常规石蜡包埋、4 μm切片,进行苏木素-伊红(hematoxylin-eosin,HE)染色,肝右小叶置液氮保存,测肝脏组织中的TC、TG、MDA含量,SOD活性及计算肝脏指数。

1.4数据处理
2 结果与分析
2.1经甲壳素处理后各组大鼠肝组织病理变化
2.1.1肉眼观察结果

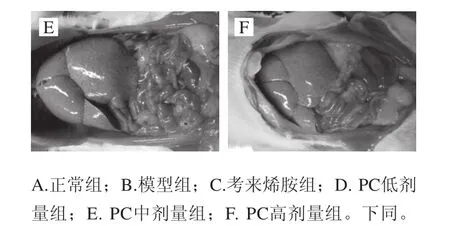
图1 各组大鼠肝脏外观变化Fig.1 Change in appearance of liver tissue of rats from each group
由图1可知,正常组肝色鲜红、边缘锐利、质韧,有光泽且富有弹性;模型组肝脏体积明显增大,包膜紧张、边缘圆钝、整个肝脏呈奶黄色,并见局灶性黄白色变性灶,切面油腻;考来烯胺组肝脏色偏黯红、质软、表面光滑、边缘锐利;PC各剂量组(图1D、E、F)情况有不同程度的好转,呈现剂量依赖关系。
2.1.2组织病理学观察结果
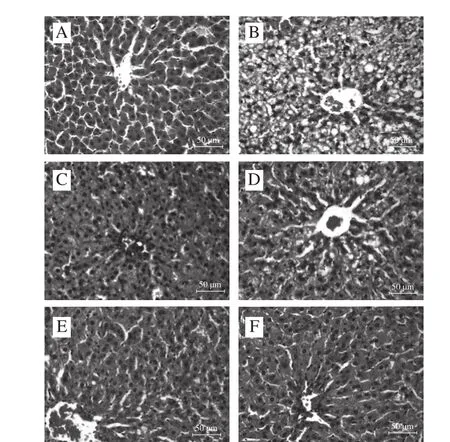
图2 各组大鼠肝脏组织病理学变化(×40000)Fig.2 Change in histopathological characteristics of liver of rats from each group(× 400)
由图2可知,正常组大鼠肝组织结构正常,肝细胞以中央静脉为中心呈放射状排列、肝窦清晰可见、肝索排列整齐、肝细胞无脂肪变性、肝组织内无脂肪空泡。模型组大鼠肝小叶边界模糊不清、肝索排列紊乱、肝窦消失、肝细胞极度肿胀呈圆形、胞浆内充满脂肪空泡,出现组织重度脂肪变性。考来烯胺组中肝组织结构正常、肝细胞以中央静脉为中心呈放射状排列、肝细胞无脂肪变性、肝组织内无脂肪空泡,但肝细胞肿胀。PC低剂量组中大鼠肝组织结构完整,但出现脂肪变性、有少量的脂肪空泡,PC中剂量组和高剂量组较PC低剂量组更进一步好转,较考来烯胺组略有好转,与正常组相似。
2.2经甲壳素处理后大鼠血脂、肝功能变化
由表1可知,经甲壳素处理5 周后,相对模型组,甲壳素处理组大鼠的血脂有极显著下降(P<0.01),并且呈现剂量关系,如模型组血清中的TC浓度为(2.72±0.17) mmol/L,PC高、中、低剂量组的TC水平分别为(2.01±0.12)、(2.21±0.34)、(2.26±0.09) mmol/L;PC处理组大鼠的肝功能也有极显著下降(P<0.01),如模型组血清中的ALT含量为(119.76±10.80) U/L,PC高、中、低剂量组的ALT含量分别为(62.17±10.30)、(73.67±8.89)、(73.98±4.98) U/L,并且与考来烯胺相比较,PC高剂量组中的TC、TG、ALT、AST含量无显著性差异,预防效果相近。
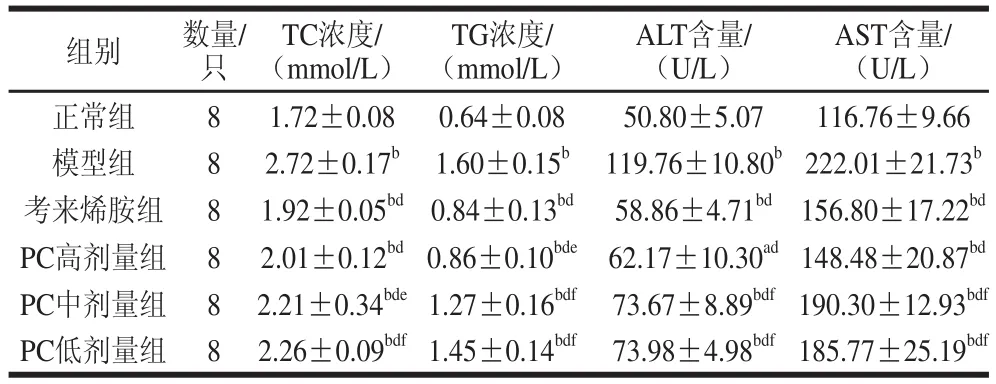
表1 PC对大鼠血脂和肝功能的影响Table 1 Effect of PC on blood lipids and liver function in rats
2.3经PC处理后大鼠肝脂、肝脏指数、肝组织中相关酶酶活性变化
与模型组相比,PC可以显著性提高由于脂质代谢紊乱所造成的低SOD活性、降低高MDA含量,并减少TC和TG在肝脏组织中沉积,降低肝脏指数(表2),PC处理组中大鼠肝脏中TC、TG含量极显著下降(P<0.01),SOD活性极显著性升高(P<0.01),MDA显著性降低(P<0.05),肝脏指数显著性降低(P<0.05),相比之下,PC高剂量组的预防效果与考来烯胺的相近,无显著性差异。

表2 PC对大鼠肝脏中TC、TG、SOD、MDA及肝脏指数的影响Table 2 Effect of PC on liver index,TC,TG,SOD and MDA in rats
3 讨 论
脂肪性肝病简称为脂肪肝,是一种遗传-环境-代谢应激相关性疾病,同时也是多种肝脏疾病发展中的一种病理过程,是最常见的弥漫性肝病之一,其以肝细胞内甘油三酯蓄积过多为主要病理改变,当肝细胞内脂肪堆积过多,脂肪含量超过肝湿质量的5%,或组织学上每单位面积见1/3以上肝细胞脂变时,称为脂肪肝[15,21]。
肝脏是脂肪代谢的重要场所,当进行高脂饮食时,体内外源性脂肪增多、肝细胞酯化形成TG增多、血浆中TG降解减少、流入肝脏的TG增加,由于过量摄入胆固醇、游离脂肪酸会产生细胞毒性,使肝细胞功能受损,肝细胞转运TG能力下降,则表现为肝功能异常、血清中TC、TG水平异常升高[22-23]。在本实验中,SD大鼠用高脂饲料饲养,模型组大鼠血清中TC、TG、ALT、AST水平均较正常组极显著升高(P<0.01),但经喂食5 周的PC预防处理,PC各剂量组大鼠的血脂(TC、TG)水平有显著性下降,肝功能(ALT、AST)明显恢复,且PC高剂量组的预防效果与考来烯胺组相近,PC的预防效果呈现剂量关系。
脂肪肝的确切发病机理尚未明确,通常以为是肝细胞脂肪合成增加和氧化减少所致,本研究结果中,模型组肝组织中MDA含量均较正常组明显升高,SOD活性均较正常组明显降低(P<0.01),表明模型组大鼠肝细胞耗氧量明显增加,体内产生大量自由基,脂质过氧化反应增强,致使其反应产物MDA增多。经喂食PC 5 周,PC中剂量组和高剂量组均能极显著提高肝脏组织中SOD活性(P<0.01),PC各处理组均能显著抑制MDA过度增多(P<0.05),且肝脏指数随剂量的增加而降低,这与张军等[24]所报道的相一致,甲壳素可以提高SOD活性,降低MDA含量。
综上所述,PC具有清除机体自由基、增强抗氧化能力的作用,可以调节和改善自由基代谢平衡,增加脂肪代谢减少其在肝脏组织中的积累,从而起到预防脂肪肝的形成。
参考文献:
[1]蒋挺大.甲壳素[M].北京:中国环境科学出版社,1996:1-4.
[2]PARK S Y,PARK J C,KIM M S,et al.Differential effect of watersoluble chitin on collagen synthesis of human bone marrow stem cells and human periodontal ligament stem cells[J].Tissue Engineering:Part A,2015,21(3/4):451-462.DOI:10.1089/ten.TEA.2014.0156.Epub 2014 Oct 2.
[3]VENKATESAN J,VINODHINI P A,SUDHA P N,et al.Chitin and chitosan composites for bone tissue regeneration[J].Advances in Food and Nutrition Research,2014,73:59-81.DOI:10.1016/B978-0-12-800268-1.00005-6.
[4]BOUHENNA M,SALAH R,BAKOUR R,et al.Effects of chitin and its derivatives on human cancer cells lines[J].Environmental Science andPollution Research,2015,22(20):15579-15586.DOI:10.1007/s11356-11015-14712-11353.
[5]LIM S C,LEE K M,KANG T J.Chitin from cuttlebone activates inflammatory cells to enhance the cell migration[J].Biomolecules & Therapeutics,2015,23(4):333-338.DOI:10.4062/biomolther.2015.062.Epub 2015 Jul 1.
[6]YOUNES I,HAJJI S,FRACHET V,et al .Chitin extraction from shrimp shell using enzymatic treatment.Antitumor,antioxidant and antimicrobial activities of chitosan[J].International Journal of Biological Macromolecules,2014,69:489-498.DOI:10.10 16/j.ijbiomac.2014.06.013.Epub 2014 Jun 17.
[7]SHANTHI MARI L S,JAGRUTHI C,ANBAZAHAN S M,et al.Protective effect of chitin and chitosan enriched diets on immunity and disease resistance in Cirrhina mrigala against Aph anomyces invadans[J].Fish & Shellfish Immunology,2014,39(2):378-385.DOI:10.1016/j.fsi.2014.05.027.Epub 2014 May 27.
[8]GHOTLOO S,HOSEINI M H,ALIMOHAMMADIAN M H,et al.Immunomodulatory effects of chitin micropa rticles on Leishmania major-infected BALB/c mice[J].Parasitology International,2015,64(2):219-221.DOI:10.1016/j.parint.2014.12.007.Epub 2014 Dec 24.
[9]van DYKEN S J,MOHAPATRA A,NUSSBAUM J C,et al.Chitin activates parallel immune modules that direct distinct inflammatory responses viainnate lymphoid type 2 and gammadelta T cells[J].Immunity,2014,40(3):414-424.DOI:10.1016/j.immuni.2014.02.003.Epub 2014 Mar 13.
[10]KIELAK A M,CRETOIU M S,SEMENOV A V,et al.Bacterial chitinolytic communities respond to chitin and pH alteration in soil[J].Applied and Environmental Microbi ology,2013,79(1):263-272.DOI:10.1128/AEM.02546-12.Epub 2012 Oct 26.
[11]JACQUIOD S,FRANQUEVILLE L,CECILLON S,et al.Soil bacterial community shifts after chitin enrichment:an integrative metagenomic approach[J].PLoS ONE,2013,8(11):e79699.DOI:10.1371/journal.pone.0079699.eCollection 2013.
[12]NGUYEN V Q,ISHIHARA M,KINODA J,et al.Development of antimicrobial biomaterials produced from chitin-nanofi ber sheet/silver nanoparticle composites[J].Journal of Nanobiotechnology,2014,12:49-57.DOI:10.1186/s129 51-014-0049-1.
[13]NASERI N,ALGAN C,JACOBS V,et al.Electrospun chitosan-based nanocomposite mats reinforced with chitin nanocrystals for wound dressing[J].Carbohydrate Polymers,2014,109:7-15.DOI:10.1016/j.carbpol.2014.03.031.Epu b 2014 Mar 26.
[14]KUO Y C,LIN C C.Accelerated nerve regeneration using induced pluripotent stem cells in chitin-chitosan-gelatin scaffolds with inverted colloidal crystal geometry[J].Colloids and Surfaces B:Biointerfaces,2013,103:595-600.DOI:10.1016/j.colsurfb.2012.11.001.Epub 2012 Nov 9.
[15]吕瑞娟,任登先,闫明.脂肪肝的发病机理和治疗研究进展[J].甘肃科学学报,2001,13(2):57-64.DOI:10.3969/j.issn.1004-0366.2001.02.015.
[16]苌新明,贠建蔚.脂肪性肝病防治的研究进展[J].世界华人消化杂志,2009,17(35):3573-3578.DOI:10.3969/j.issn.1009-3079.2009.35.001.
[17]NEYRINCK A M,POSSEMIERS S,VERSTRAETE W,et al.Dietary modulation of clostridial cluster XIVa gut bacteria(Roseburia spp.)by chitin-glucan fi ber improves host metabolic alterationsinduced by high-fat diet in mice[J].Journal of Nutritional Biochemistry,2012,23(1):51-59.DOI:10.1016/j.jnutbio.2010.10.008.Epub2011Mar 15.
[18]ZACOUR A C,SILVA M E,CECON P R,et al.Effect of dietary chitin on cholesterol a bsorption and metabolism in rats[J].Journal of Nutritional Science and Vitaminology,1992,38(6):609-613.
[19]王赫,杨良月,曹晓东,等.SD大白鼠高脂血症及脂肪肝模型的建立[J].黑龙江畜牧兽医,2015(3):172-174; 235.
[20]钟岚 ,范建高,王国良,等.肥胖、高脂血症性脂肪性肝炎模型的建立[J].实验动物科学与管理,2000,17(2):16-20.
[21]刘丽萍.他汀类药物在脂肪性肝病治疗中的应用[J].药品评价,2013,10(1):21-24; 46.DOI:10.3969/j.issn.1672-2809.2013.01.007.
[22]衣桂燕,杨庭树,李云芝,等.普罗布考和阿托伐他汀联合用药对高脂饮食自发性高血压大鼠肝脏的影响[J].中国动脉硬化杂志,2009,17(2):117-121.
[23]董春富,吴国华.脂肪肝患者血脂、肝功能指标改变的分析[J].检验医学,2005,20(2):160-161.DOI:10.3969/j.issn.1673-8640.2005.02.025.
[24]张军,韩春涛,邵红.关于短跑运动员服用甲壳素影响运动能力的研究[J].哈尔滨体育学院学报,2006,24(1):115-117.DOI:10.3969/j.issn.1 008-2808.2006.01.048.
Preventive Effect of Chitin from Pleurotus eryngii on Fatty Liver in Rats
HUANG Jiafu,LIN Jiaofen,OU Yixin,LIU Jingna,CAO Na,ZHUANG Shiyi,PAN Qiuyu,PAN Yutian*
(Engineering Technological Center of Mushroom Industry,Minnan Normal University,Zhangzhou 363000,China)
Abstract:An experimental rat model of fatty liver was constructed to explore the preventive effect of chitin from Pleurotus eryngii on fatty liver.The rats were fed chitin at various concentration levels while cholestyramine was used as a positive control.After 5 weeks,the levels of alanine aminotransferase(ALT),aspartate aminotransferase(AST),total cholesterol(TC)and total triglycerides(TG)in serum and the levels of malonaldehyde(MDA)and superoxide dismutase(SOD)in liver were detected and pathological changes in liver were examined.Results showed the levels of ALT,AST,TC and TG in serum and the levels of TC,TG and MDA in liver significantly decreased(P < 0.01),and SOD activity significantly increased(P < 0.05)after administration with P.eryngii chitin for 5 weeks.Moreover,fatty degeneration in liver tissue was alleviated,and the levels of TC and TG were reduced in liver tissue.Furthermore,the hepatoprotective activity of P.eryngii chitin(PC)was dose dependent.Notably,the preventive effect of high-dose PC was similar to that of cholestyramine(P < 0.05).All these results indicated that P.eryngii chitin has the potential to prevent fatty liver disease in rats.
Key words:Pleurotus eryngii; chitin; experimental fatty liver; prevention
中图分类号:Q539.3
文献标志码:A
文章编号:1002-6630(2016)05-0219-04
DOI:10.7506/spkx1002-6630-201605039 10.7506/spkx1002-6630-201605039.http://www.spkx.net.cn
*通信作者:潘裕添(1969—),男,教授,学士,研究方向为天然产物。E-mail:xmpyt@sina.com
作者简介:黄家福(1982—),男,讲师,硕士,研究方向为微生物次生代谢产物。E-mail:dongxie1982@126.com
基金项目:2015年福建省科技厅引导性项目(2015N0030);福建省自然科学基金指导性计划项目(2012D137);福建省自然科学基金青年创新项目(2015J05071);2014年福建省教育科研项目一般项目(JA14205)
收稿日期:2015-08-24
