亚油酸氧化产物——白细胞毒素和白细胞毒素二醇的研究进展
2016-04-15耿志明王道营杜盼盼张牧焓徐为民江苏省农业科学院农产品加工研究所江苏南京2004南京农业大学肉品加工与质量控制教育部重点实验室江苏南京20095
宋 慧,耿志明,任 双,王道营,杜盼盼,张牧焓,孙 冲,刘 芳,徐为民(.江苏省农业科学院农产品加工研究所,江苏 南京 2004;2.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 20095)
亚油酸氧化产物——白细胞毒素和白细胞毒素二醇的研究进展
宋 慧1,2,耿志明1,*,任 双1,2,王道营1,杜盼盼1,2,张牧焓1,孙 冲1,刘 芳1,徐为民1
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;
2.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
摘 要:白细胞毒素(leukotoxin,Ltx)和白细胞毒素二醇(leukotoxin diol,Ltxd)是亚油酸的氧化产物,研究表明,Ltx和Ltxd具有细胞毒性,与哺乳动物多种疾病相关,而外源性Ltx和Ltxd的摄入可以引起哺乳动物内分泌紊乱。本文系统综述Ltx和Ltxd的发现、形成机理、病理和生理学意义、毒性作用以及检测方法,并对未来的研究重点进行展望。
关键词:亚油酸;脂质氧化;白细胞毒素;白细胞毒素二醇
引文格式:
宋慧,耿志明,任双,等.亚油酸氧化产物——白细胞毒素和白细胞毒素二醇的研究进展[J].食品科学,2016,37(5):223-229.DOI:10.7506/spkx1002-6630-201605040.http://www.spkx.net.cn
SONG Hui,GENG Zhiming,REN Shuang,et al.Progress in studies on oxidation products of linoleic acid leukotoxin and leukotoxin diols[J].Food Science,2016,37(5):223-229.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605040.http://www.spkx.net.cn
亚油酸(linoleic acid,LA),即C18∶2 n-6,属于多不饱和脂肪酸,是膳食构成中的常见营养组分。LA是人体必需脂肪酸,参与生物体内许多重要的生理过程,包括磷脂和花生四烯酸的合成[1]。LA通过自动氧化或者在细胞色素P450(cytochrome P450)的作用下转化为9,10-环氧十八碳一烯酸(9,10-epoxyoctadecenic acid,9,10-EOME)[2]。由于9,10-EOME可以在白细胞内合成,并且对动物具有毒性作用,9,10-EOME又被命名为白细胞毒素(leukotoxin,Ltx)[2]。LA含有两个双键,因此9,10-EOME存在异构体——12,13-环氧十八碳一烯酸(12,13-epoxyoctadecenic acid,12,13-EOME),12,13-EOME也被称为异白细胞毒素(iso-leukotoxin,iLtx)。在生物体内,Ltx和iLtx可以被可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)分别转化为9,10-二羟基-十八碳一烯酸(9,10-dihydroxyoctadecenic acid,9,10-DHOME),即白细胞毒素二醇(leukotoxindiol,Ltxd)和12 ,13-二羟基十八碳一烯酸(12,13-dihydroxyoctadecenic acid,12,13-DHOME),即异白细胞毒素二醇(iso-leukotoxin diol,iLtxd)[2-4]。现有的研究结果表明,Ltxs(Ltx和iLtx的总称)和Ltxds (Ltxd和iLtxd的总称)是生物体内脂质代谢过程中LA的氧化产物,具有多重生理学和病理意义,如参与构建植物病虫害防御体系,导致哺乳动物心、肺等多种器官衰竭[5-9]。近年来的研究发现,Ltxs和Ltxds也广泛存在于贮运加工的富含油脂的食品中,如贮运加工中的动物肉制品以及高温处理的动植物油脂等[10-11]。毒理学研究[12-13]证实,外源性Ltxs和Ltxds具有激素作用,可以引起哺乳动物内分泌紊乱、刺激乳腺癌细胞增殖。因此,Ltxs和Ltxds的相关研究一直是病理和生理学研究的一个热点。近年来,随着食品中的Ltxs和Ltxds不断被发现,它们在食品加工过程中的形成规律、影响因素、含量水平以及潜在的健康危害也已引起了广泛关注。本文就Ltx和Ltxd的发现、产生机理、病理和生理学意义、检测方法等进行简要综述,并对它们在食品安全领域的相关研究作一些展望。
1 Ltx及Ltxdd的发现
1977年,Wu等[14]从LA单分子层的自动氧化产物中分离鉴定了9,10-EOME和12,13-EOME两种EOMEs。随后,Sevanian等[15]从呼吸NO2的大鼠肺中分离出了EOMEs,并认为它们是大鼠肺组织中LA自动氧化的产物。1986年,日本学者Ozawa[16]和Hayakawa[17]等将LA和肺泡灌洗液中的白细胞共培育,发现EOMEs是白细胞代谢LA的产物,具有潜在的线粒体呼吸解偶联作用以及平滑肌收缩的松弛效应,分别将其命名为Ltx和iLtx。随后在大面积烧伤病人[18]、急性呼吸窘迫综合征患者及纯氧导致肺损伤的大鼠的肺灌洗液中发现了高浓度的Ltxs[19]。1989年,Halarnkar等[20]从鼠和人肝脏中分离纯化sEH,以Ltx和iLtx为底物成功合成了Ltxd和iLtxd。随后,在大鼠尿液[21]、人血浆[22]、小麦[23]、水稻[24]、麦芽及啤酒[25]等样本中也相继检测出Ltxs和Ltxds。
除了生物合成外,近年来非生物途径的脂质自动氧化产生的Ltxs也不断地被发现。Velasco[11,26]、Berdeaux[27]、Guillén[28]等发现经过高温加工的植物油以及油炸食品剩余的油中含有大量的环氧化脂肪酸,其中包括Ltxs。
2009年,Püssa等[10]在机械脱骨鸡肉、猪肉及火鸡肉中发现了Ltxs及其水解产物Ltxds,并且浓度远高于相应的手工脱骨肉中的含量。Toomik等[29]发现在腌制猪肉中也存在Ltxs和Ltxds。食品贮藏、加工过程中脂质氧化同时涉及脂肪氧合酶、细胞色素等酶介导的氧化过程,以及自由基引起的自动氧化过程,温度、金属离子、光照、各种酶活性等因素都可以对脂质氧化过程及产物产生影响。因此,食品贮藏、加工过程中Ltxs和Ltxds形成规律、影响因素等将更为复杂。
2 Ltx及Ltxd产生机理
2.1Ltx生物合成——亚油酸的自动氧化途径
Ltx最早是研究亚油酸单分子层的自动氧化时发现的,随后在大鼠肺组织及肺灌洗液中发现有Ltx存在。Wu[14]和Sevanian[15]等认为,在脂肪酸自动氧化初始阶段形成脂肪酸过氧自由基,生物膜中脂肪酸的排列有利于脂肪酸过氧自由基与相邻的脂肪酸C=C通过共轭形成中间产物,并最终形成脂肪酸环氧化物。亚油酸的这一自动氧化途径即产生Ltx(图1)。

图1 亚油酸单分子层中Ltx的形成途径[[1155]]Fig.1 Formation pathway of Ltx in linoleic acid monolayers[15]
2.2Ltx生物合成——亚油酸的P450途径
多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)的代谢涉及环氧合酶、脂肪氧合酶以及P450,其中P450是单氧合酶[2,30]。P450广泛分布于动植物及微生物中,是一类血红素硫铁蛋白,催化外源性和内源性物质的氧化,如脂肪酸、脂质氢过氧化物、类固醇、胆汁酸、类VA、前列腺素、白细胞三烯和细胞因子等[31]。P450氧化PUFA有多种不同途径:1)ω-端羟基化(ω1、ω2、ω3等);2)二烯丙基碳的羟基化;3)C=C键的环氧化;4)烯丙基碳的羟基化;5)C=C键发生迁移的羟基化。P450以单氧合酶方式催化PUFA氧化的作用是通过大鼠肾脏和肝脏微粒体在还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)和O2存在条件下与花生四烯酸(arachidonic acid,AA)共孵育过程中发现的[32-33],其对AA的环氧化作用同样适用于LA。目前普遍认为,P450是生物合成Ltx的主要途径(图2)。
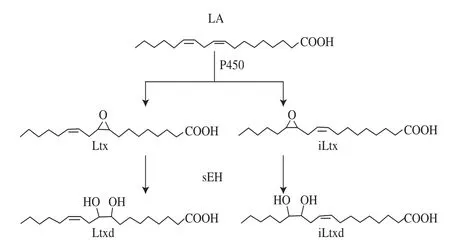
图2 生物体内P450和sEH产生Ltxs和Ltxds的途径[[22]]Fig.2 Synthetic pathway in vivo for the production of leukotoxins and leukotoxin diols from linoleic acid by P450 and sEH[2]
2.3Ltx非生物合成——亚油酸的自动氧化途径
PUFA通过自动氧化、非生物合成途径产生脂肪酸环氧化物的机理在20世纪80年代即已得到研究[34]。近年来,植物油高温加热产物的相关研究逐渐引起了人们的关注[11,35-40],Velasco等[11,37]将高温加热后的植物油脂甲酯化后进行分析,发现存在高浓度的单环氧脂肪酸甲酯,其中包括甲酯化的Ltxs,但未区分这些单环氧脂肪酸甲酯是来源于游离的还是结合在甘油骨架上。Guillén等[28]运用核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)发现高温诱导氧化的植物油脂降解产物中包括Ltxs。由于油脂高温加热过程包含复杂的反应:水解、自由基反应、氧化聚合、热聚合等,因此高温加热的植物油中可能含有包括Ltx及其异构体在内的游离脂肪酸单环氧化物。在阐述高温诱导氧化形成单环氧脂肪酸的途径时,Zhang Qing等[36]提出了类似于生物体内Ltx合成——亚油酸的自动氧化途径的形成机理:高温条件下油脂自动氧化产生过氧自由基(ROO•),ROO•直接攻击亚油酸的C=C键,产生Ltxs和烷氧自由基(图3)。

图3 亚油酸自动氧化形成Ltxs的途径[[3366]]Fig.3 Formation pathway of Ltxs from LA by autooxidation[36]
2.4Ltxd的产生机理
1989年,Halarnkar等[20]利用鼠和人肝脏中分离纯化的sEH,将Ltx和iLtx分别水解为Ltxd和iLtxd。Moghaddam[2]、Grant[41]、Beetham[42]等进一步利用哺乳动物sEH的DNA克隆与表达体系验证了Ltxs只有在环氧化物水解酶存在时才具有细胞毒性,并确认对肺泡上皮细胞具有毒性的是其二醇代谢产物——Ltxds,后续更多的研究[4,43-47]验证了这一结果。1997年,Moghaddam等[2]提出在体内sEH将Ltxs转化为Ltxds的机理(图2),认为许多归于Ltx或iLtx的病理现象可能是由sEH催化的水解转化造成的,并建议运用Ltxd或iLtxd重新评价Ltx或iLtx在肺水肿、血管舒张、毛细管损伤、凝血、心脏停搏、线粒体功能障碍以及NO浓度升高等方面的病理作用。这一机理表明,sEH将Ltxs降解为具有促炎症作用的Ltxds,在机体炎症反应的调节中扮演着重要角色,也为炎症控制提供了全新的治疗目标[48]。
不同于Ltx有多种形成机理,迄今未见有其他Ltxd形成机理的报道。但是宰后畜禽肌肉中发现有一定浓度的Ltxds[10],其来源及形成机理尚不明确,在食品加工、贮运过程中是否存在Ltx转化为Ltxd的非酶途径值得进一步研究。
3 Ltx和Ltxd的病理和生理学意义
植物受到病原体侵袭产生大量脂质氧化产物是其防御机制的特征性反应,越来越多的证据表明脂质氧化产物对于植物抵御病害具有重要意义[23,49]。Kato等[24]发现在水稻中存在亚油酸的环氧化物Ltx,这一化合物具有抗霉菌、抗细菌活性,作为自我防御物质存在于水稻中。因此,Ltx可以被认为是植物为抵御各种疾病侵袭而产生的一种物质。Levandi等[23]发现小麦中存在多种PUFA的氧化产物,包括Ltxs及其水解产物Ltxds,认为植物产生LA的氧化产物(Ltxs和Ltxds)是应对病虫害的一种防御方式。
病理和生理学研究发现,大面积烧伤病人血浆中的Ltx浓度高达100 μmol/L[18],在急性呼吸窘迫综合征患者及呼吸纯氧导致肺损伤大鼠的肺灌洗液中Ltx浓度急剧上升[19]。Ltx和iLtx可以导致血管舒张[50],高浓度Ltx可造成与严重烧伤、急性创伤、急性呼吸窘迫综合征相关的多重器官衰竭[18,51-52]。注射Ltx可导致犬心力衰竭[53]、天竺鼠体内血压升高最终诱发心脏停搏[54]。Ltx对鼠肝脏线粒体呼吸具有高解偶联活性,并且对鼠胃平滑肌有松弛作用[16]。静脉注射Ltx会使鼠肺灌洗液中白蛋白水平以及血管张力素转化酶活性升高,并导致肺水肿、肺泡上皮细胞损伤及内皮损伤[55]。对离体再灌注的鼠肺研究表明,Ltx抑制肺的线粒体呼吸,通过激活一氧化氮合酶(nitric oxide synthase,NOS)造成肺水肿,通过激活血管内皮NOS(endothelial NOS,eNOS)和诱导型NOS (inducible NOS,iNOS)造成肺部血管舒张[56]。随着sEH调节PUFA环氧化产物代谢研究的深入,愈来愈多的证据表明,Ltx在病理和生理学上的作用可能更多归于其sEH降解产物Ltxd[2,4,43-47]。
也有研究发现,P450介导的LA环氧化,再通过sEH水解产生相应的邻位二醇,可能是LA的脱毒过程,对于肾小管细胞而言,LA及其代谢产物的毒性顺序为LA≥Ltx≥Ltxd[57]。在低浓度时,Ltx及Ltxd并不呈现毒性,甚至具有某些有益的作用。例如,无论是离体大鼠心脏灌注30 μmol/L的LA、Ltx或Ltxd,还是以35 mg/(kg•h)的Ltxs饲喂大鼠,都未发现其对心脏有毒害作用[58]。在进行缺氧/再吸氧后,1~10 μmol/L的iLtx可以维持线粒体功能、并且激活近端肾小管细胞钠转运,具有类似于环氧二十碳三烯酸(花生四烯酸的P450代谢产物)的细胞保护功能[59]。
Ltxs和Ltxds可以在健康人、实验动物的血浆和尿液中被检出,鼠血浆中LA代谢物(Ltxs+Ltxds)的浓度达到20~50 nmol/L[60-61]。实验鼠通过尿液排泄LA代谢物(Ltxs+Ltxds)的速率为5 000 pmol/d[62],在人体尿液中排泄的LA代谢物以Ltxd为主,含量大约为iLtxd 的10 倍[63]。当健康人群摄入过多食盐时,尿液中Ltxds的量会增加3~4 倍[64]。值得关注的是,已成功用于缓解高血压、肾损伤、肺炎以及动脉粥样硬化的sEH抑制剂可减少Ltxs的降解,降低Ltxds在LA代谢产物(Ltxs+Ltxds)中的比例[60,62,65]。
4 Ltx和Ltxd的毒理学研究
一般而言,sEH将具有细胞毒性和致突变作用的环氧化物转化为相应的二醇,是白细胞脱毒体系的一个组成部分[66]。但是,LA的环氧化物Ltxs经sEH水解产生的Ltxds却具有更强的细胞毒性[2,4,43-47]。动物药理学研究发现sEH的抑制剂可以降低Ltx的致死率,但对Ltxd没有作用[43]。对于人和昆虫细胞,Ltxd具有急性细胞毒性,特异性地激活线粒体通透性转换,导致线粒体释放细胞色素c,进而致使细胞死亡[67]。
Zheng Jiang等[43]给小鼠分别注射相同剂量的Ltx和Ltxd,发现注射Ltxd的小鼠都死于类似急性呼吸窘迫综合征的呼吸困难,但是Ltx组的小鼠都存活了下来。
Moran等[4]用相同浓度的Ltxs和Ltxds与兔肾近端小管细胞共培养,在高达1 mmol/L时,未发现Ltxs组有细胞死亡,但在6 h时其相应的水解产物Ltxds组有42%的细胞死亡。
值得注意的是,近期的研究发现,外源性Ltxds具有干扰内分泌和刺激癌细胞增殖的作用[12-13]。Markaverich 等[12]通过在饮水中添加Ltxd的方式,研究外源性Ltxd对雌鼠发情周期、雄鼠性行为的影响,发现外源性摄入Ltxd可以改变雌鼠的动情周期和雄鼠性行为,最低可观察有害效应浓度(lowest observed adverse effect level,LOAEL)为0.2~0.5 mg/kg,仅为典型植物雌激素类内分泌干扰剂的1/200[12]。该研究团队还发现,Ltxd及其异构体iLtxd均可促进细胞的有丝分裂能力,刺激人乳腺癌细胞MCF-7增殖扩散[13]。
5 Ltx和Ltxd的检测方法
Ltx和Ltxd的分析对象主要包括哺乳动物(包括人及实验动物)的尿液、血液等以及植物油、动物肉制品等,采用的方法包括气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)、液相色谱-质谱联用(liquid chromatography-tandem mass spectrometry,LC-MS/MS)、酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)以及NMR等。
早期的Ltx分析测试[14-17]主要采用GC-MS进行分析鉴定。Wu[14]、Sevanian[15]等分别采用GC-MS对吸附在硅胶上脂肪酸单分子层和呼吸NO2的鼠肺灌洗液中的脂肪酸氧化产物,包括Ltx进行了分析。Ozawa[16]、Hayakawa[17]等进行了高效液相色谱(high performance liquid chromatography,HPLC)分离,以紫外检测器在192 nm波长处检测,再采用GC-MS对Ltxs进行结构鉴定的方法,分别对呼吸高压氧的鼠肺灌洗液和白细胞培养液中的Ltxs进行了分析。Ltx不能直接进行GC-MS分析,必须经过复杂、繁琐的衍生反应。目前,这一方法大多为LC-MS/MS所取代。
LC-MS/MS是PUFA氧化产物、包括Ltx和Ltxd的主要分析方法,适用于动物体液(血液、尿液等)、植物(水稻、小麦等)、食品(畜禽肉品、麦芽及麦芽汁等)样本的分析。Newman等[63]建立了同时分析鼠尿和人尿中包括Ltx和Ltxd在内的亚油酸及花生四烯酸P450代谢产物的方法,目标分析物经高效液相色谱分离后,采用串联质谱进行分析。结果表明,Ltx和Ltxd的检出限可达0.3、0.1 ng/mL,具有优异的灵敏度和选择性。Zhu等[22]以14,15-环氧二十碳三烯酸、14,15-二羟基二十碳三烯酸、Ltx以及Ltxd为体内可溶性环氧化物水解酶sEH活性的生物标记,建立了同时分析人体血浆中4 种分析物的高通量LC-MS/MS方法,具有良好的精密度和准确性,可用于临床样本的分析。Püssa等[10]采用LC-MS/MS方法分析了脱骨畜禽肉中PUFA的氧化产物,包括Ltxs和Ltxds。在脱骨火鸡肉中,Ltxd的含量高达250 mg/kg,远高于其LOAEL。LC-MS/MS是复杂样本中微量/痕量多组分同时分析的最常用的分析手段,具有优异的灵敏度和选择性。但其运行费用昂贵,对相关人员的专业技术和知识有较高的要求。
ELISA也是复杂样本中微量、痕量分析的常用方法,Ltx及Ltxd的ELISA方法研究报道很少,目前仅见于Zurek等[21]的研究,尚未有商品化的ELISA试剂盒用于Ltx 和Ltxd检测。Zurek等将Ltxds混合物与钥孔血蓝蛋白或牛血清白蛋白偶联,免疫兔子获得多克隆抗体,以蓖麻油酸和卵清蛋白的偶联物为包被抗原,建立了尿液中Ltxds 的ELISA检测方法,IC50值为8 μg/L。ELISA具有操作简便、通量高等优点,但存在交叉反应导致假阳性的可能,因此常用于大样本的筛查。
近年来运用NMR开展定量分析也引起了广泛的关注,Ibargoitia[68]、Guillén等[28,69]运用1H NMR分析了高温诱导氧化的植物油脂中降解产物,包括Ltx等的含量。与其他仪器分析方法相比,NMR具有所需样品量少、不破坏被测样品、无需对照标准品等优点。但也存在明显的缺点,如灵敏度低、基质干扰大等。
6 结 语6
Ltx和Ltxd是脂质氧化过程中亚油酸的氧化产物。自从20世纪80年代以来,内源性Ltx和Ltxd由于在病理和生理学上的作用一直是研究热点。Ltx和Ltxd,尤其是Ltxd作为某些疾病的信号分子以及sEH抑制剂的研究等将会是未来医药研究领域的一个重要方面。
外源性Ltx和Ltxd的相关研究在近年来才开展,现有少数的研究表明,Ltx和Ltxd在食品或食品原料中(加工的动植物油脂、生鲜肉、啤酒、麦芽汁、小麦、水稻)中广泛存在。由于Ltxd具有扰乱内分泌、促乳腺癌细胞增殖等作用,Ltx和Ltxd在食品中的安全性相关研究将越来越受到关注。这些研究包括:常见食品中Ltx/Ltxd的含量分布;食品贮藏、加工过程中Ltx/Lxtd的变化规律及影响因素;食品中Ltx/Ltxd在人及动物体内的转归;Ltx/Lxtd膳食暴露量评估及流行病学调查等。
参考文献:
[1]SALEM N,PAWLOSKY R,WEGHER B,et al.In vivo conversion of linoleic acid to arachidonic acid in human adults[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,1999,60(5/6):407-410.DOI:10.1016/S0952-3278(99)80021-0.
[2]MOGHADDAM M F,GRANT D F,CHEEK J M,et al.Bioactivation of leukotoxins to their toxic diols by epoxide hydrolase[J].Nature Medicine,1997,3:562-566.DOI:10.1038/nm0597-562.
[3]LURIA A,WELDON S M,KABCENELL A K,et al.Compensatory mechanism for homeostatic blood pressure regulation in Ephx2 genedisrupted mice[J].Journal of Biological Chemistry,2007,282:2891-2898.DOI:10.1074/jbc.M608057200.
[4]MORAN J H,WEISE R,SCHNELLMANN R G,et al.Cytotoxicity of linoleic acid diols to renal proximal tubular cells[J].Toxicology and Applied Pharmscology,1997,146:53-59.DOI:10.1006/taap.1997.8197.
[5]SISEMORE M F,ZHENG J,YANG J C,et al.Cellular characterization of leukotoxin diol-induced mitochondrial dysfunction[J].Archives of Biochemistry and Biophysics,2001,392(1):32-37.DOI:10.1006/abbi.2001.2434.
[6]ISHIZAKI T,SHIGEMORI K,NAKAI T,et al.Leukotoxin,9,10-epoxy-12-octadecenoate causes edematous lung injury via activation of vascular nitric oxide synthase[J].American Journal of Physiology,1995,269:L65-L70.
[7]ISHIZAKI T,SHIGEMORI K,NAKAI T,et al.Endothelin-1 potentiates leukotoxin-induced edematous lung injury[J].Journal of Applied Physiology,1995,79:1106-1111.
[8]HU J N,TAKI F,SUGIYAMA S,et al.Neutrophilderived epoxide,9,10-epoxy-12-octadecenoate,induces pulmonary edema[J].Lung,1988,166:327-337.DOI:10.1007/BF02714065.
[9]SUGIYAMA S,HAYAKAWA M,NAGAI S,et al.Leukotoxin,9,10-epoxy-12-octadecenoate,causes cardiac failure in dogs[J].Life Science,1987,40:225-231.DOI:10.1016/0024-3205(87)90336-5.
[10]PÜSSA T,RAUDSEPP P,TOOMIK P,et al.A study of oxidation products of free polyunsaturated fatty acids in mechanically deboned meat[J].Journal of Food Composition and Analysis,2009,22:307-314.DOI:10.1016/j.jfca.2009.01.014.
[11]VELASCO J,MARMESAT S,BORDEAUX O,et al.Formation and evolution of monoepoxy fatty acids in thermoxidized olive and sunflower oils and quantitation in used frying oils from restaurants and fried-food outlets[J].Journal of Agricultural and Food Chemistry,2004,52:4438-4443.DOI:10.1021/jf030753f.
[12]MARKAVERICH B M,CROWLEY J R,ALEJANDRO M A,et al.Leukotoxin diols from ground corncob bedding disrupt estrous cyclicity in rats and stimulate MCF-7 breast cancer cell proliferation[J].Environmental Health Perspectives,2005,113:1698-1704.DOI:10.1289/ehp.8231.
[13]MARKAVERICH B M,ALEJANDRO M,THOMPSON T,et al.Tetrahydrofurandiols(THF-diols),leukotoxin diols(LTX-diols),and endocrine disruption in rats[J].Environmental Health Perspectives,2007,115:702-708.DOI:10.1289/ehp.9311.
[14]WU G S,STEIN R A,MEAD J F,et al.Autoxidation of fatty acid monolayers adsorbed on silica gel:II.Rates and products[J].Lipids,1977,12:971-978.DOI:10.1007/BF02533320.
[15]SEVANIAN A,MEAD J F,STEIN R A,et al.Epoxides as products of lipid autoxidation in rat lungs[J].Lipids,1979,14:634-643.DOI:10.1007/BF02533449.
[16]OZAWA T,HAYAKAWA M,TAKAMURA T,et al.Biosynthesis of leukotoxin,9,10-epoxy-12-octadecenoate,by leukocytes in lung lavages of rat after exposure to hyperoxia[J].Biochemical and Biophysical Research Communications,1986,134:1071-1078.DOI:10.1016/0006-291X(86)90360-8.
[17]HAYAKAWA M,SUGIYAMA S,TAKAMURA T,et al.Neutrophills biosynthesize leukotoxin 9,10-epoxy-12-octadecenoate[J].Biochemical and Biophysical Research Communications,1986,137:424-430.DOI:10.1016/0006-291X(86)91227-1.
[18]KOSAKA K,SUZUKI K,HAYAKAWA M,et al.Leukotoxin,a linoleate epoxide:its implication in the late death of patients with extensive burns[J].Molecular and Cellular Biochemistry,1994,139:141-148.DOI:10.1007/BF01081737.
[19]OZAWA T,SUGIYAMA S,HAYAKAWA M,et al.Existence of leukotoxin 9,10-epoxy-12-octadecenoate in lung lavages from rats breathing pure oxygen and from patients with the adult respiratory distress syndrome[J].American Review of Respiratory Disease,1988,137:535-540.DOI:10.1164/ajrccm/137.3.535.
[20]HALARNKAR P P,WIXTROM R N,SILVA M H,et al.Catablism of epoxy fatty acids by the purified hydrolase from mouse and human liver[J].Archives of Biochemistry and Biophysics,1989,272:226-236.DOI:10.1016/0003-9861(89)90214-2.
[21]ZUREK G,GEE S J,HAMMOCK B D.Development of an enzyme immunoassay for linoleic acid diols in urine[J].Analytica Chimica Acta,2002,466:247-256.DOI:10.1016/S0003-2670(02)00589-5.
[22]ZHU P,PECK B,LICEA-PEREZ H,et al.Development of a semiautomated LC/MS/MS method for the simultaneous quantitation of 14,15-epoxyeicosatrienoic acid,14,15-dihydroxyeicosatrienoic acid,leukotoxin and leukotoxin diol in human plasma as biomarkers of soluble epoxide hydrolase activity in vivo[J].Journal of Chromatography B,2011,879:2487-2493.DOI:10.1016/j.jchromb.2011.06.042.
[23]LEVANDI T,PÜSSA T,VAHER M,et al.Oxidation products of free polyunsaturated fatty acids in wheat varieties[J].European Journal of Lipid Science and Technology,2009,111:715-722.DOI:10.1002/ejlt.200800286.
[24]KATO T,YAMAGUCHI Y,UYEHARA T,et al.Self defensive substances in rice plant against rice blast disease[J].Tetrahedron Letters,1983,24:4715-4718.DOI:10.1016/S0040-4039(00)86236-X.
[25]KOBAYASHI N,KANEDA H,KURODA H,et al.Simultaneous determination of mono-,di-,and trihydroxyoctadecenoic acids in beer and wort[J].Journal of the Institute of Brewing,2000,106:107-110.DOI:10.1002/j.2050-0416.2000.tb00046.x.
[26]VELASCO J,BERDEAUX O,MARQUEZ-RUIZ G,et al.Sensitive and accurate quantitation of monoepoxy fatty acids in thermoxidized oils by gas-liquid chromatography[J].Journal of Chromatography A,2002,982:145-152.DOI:10.1016/S0021-9673(02)01481-4.
[27]BERDEAUX O,M˘RQUEZ-RUIZ G,DOBARGANES M C.Characterization,quantitation and evolution of monoepoxy compounds formed in model systems of fatty acid methyl esters and monoacid triglycerides heated at high temperature[J].Grasas y Aceites,1999,50:53-59.DOI:10.3989/gya.1999.v50.i1.636.
[28]GUILLÉN M D,URIARTE P S.Monitoring by1H nuclear magnetic resonance of the changes in the composition of virgin linseed oil heated at frying temperature.Comparison with the evolution of other edible oils[J].Food Control,2012,28:59-68.DOI:10.1016/j.foodcont.2012.04.024.
[29]TOOMIK P,LEPP K,LEPASALU L,et al.The effect of tenderizing acids on linoleic acid oxidation during marination of pork[J].Meat Science,2012,92:870-873.DOI:10.1016/j.meatsci.2012.06.016.
[30]NIKI E,YOSHIDA Y,SAITO Y,et al.Lipid peroxidation:mechanisms,inhibition,and biological effects[J].Biochemical and Biophysical Research Communications,2005,338:668-676.DOI:10.1016/j.bbrc.2005.08.072.
[31]OLIW E H,BYLUND J,HERMAN C.Bisallylic hydroxylation and epoxidation of polyunsaturated fatty acids by cytochrome P450[J].Lipids,1996,31:1003-1021.DOI:10.1007/BF02522457.
[32]OLIW E H,LAWSON J A,BRASH A R,et al.Arachidonic acid metabolism in rabbit renal cortex.Formation of two novel dihydroxyeicosatrienoic acids[J].Journal of Biological Chemistry,1981,256:9924-9931.
[33]CHACOS N,FALCK J R,WIXTROM C,et al.Novel epoxides formed during the liver cytochrome P450 oxidation of arachidonic acid[J].Biochemical and Biophysical Research Communications,1982,104:916-922.DOI:10.1016/0006-291X(82)91336-5.
[34]GARDNER H W.Oxygen radical chemistry of polyunsaturated fatty acids[J].Free Radical Biology and Medicine,1989,7:65-86.DOI:10.1016/0891-5849(89)90102-0.
[35]AERTS H A J,JACOBS P A.Epoxide yield determination of oils and fatty acid methyl esters using1H NMR[J].Journal of the American Oil Chemists’ Society,2004,81:841-846.DOI:10.1007/s11746-004-0989-1.
[36]ZHANG Q,SALEH A S M,CHEN J,et al.Chemical alterations taken place during deep-fat frying based on certain reaction products:a review[J].Chemistry and Physics of Lipids,2012,165:662-681.DOI:10.1016/j.chemphyslip.2012.07.002.
[37]VELASCO J,BERDEAUX O,M˘RQUEZ-RUIZ G,et al.Sensitive and accurate quantitation of monoepoxy fatty acids in thermoxidized oils by gas-liquid chromatography[J].Journal of Chromatography A,2002,982:145-152.DOI:10.1016/S0021-9673(02)01481-4.
[38]BARRERA-ARELLANO D,MÁRQUEZ-RUIZ G,DOBARGANES M C.A simple procedure to evaluate the performance of fats and oils at frying temperatures[J].Grasas y Aceites,1997,48:231-235.DOI:10.3989/gya.1997.v48.i4.794.
[39]BERDEAUX O,VELASCO J,MÁRQUEZ-RUIZ G,et al.Evolution of short-chain glycerol-bound compounds during thermoxidation of FAME and monoacid TAG[J].Journal of the American Oil Chemists’Society,2002,79:279-285.DOI:10.1007/s11746-002-0474-x.
[40]CALDWELL J,COOKE B,GREER M.High performance liquid chromatography-size exclusion chromatography for rapid analysis of total polar compounds in used frying oils[J].Journal of the American Oil Chemists’ Society,2011,88:1669-1674.DOI:10.1007/s11746-011-1845-5.
[41]GRANT D F,STORMS D H,HAMMOCK B D.Molecular cloning and expression of murine liver soluble epoxide hydrolase[J].Journal of Biological Chemistry,1993,268:17628-17633.
[42]BEETHAM J K,TIAN T,HAMMOCK B D.cDNA cloning and expression of a soluble epoxide hydrolase from human liver[J].Archives of Biochemistry and Biophysics,1993,305:197-201.DOI:10.1006/abbi.1993.1411.
[43]ZHENG J,PLOPPER C G,LAKRITZ J,et al.Leukotoxin-diol:a putative toxic mediator involved in acute respiratory distress syndrome[J].American Journal of Respiratory Cell and Molecular Biologgy,2001,25:434-438.DOI:10.1165/ajrcmb.25.4.4104.
[44]STIMERS J R,DOBRETSOV M,HASTINGS S L,et al.Effects of linoleic acid metabolites on electrical activity in adult rat ventricular myocytes[J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,1999,1438:359-368.DOI:10.1016/S1388-1981(99)00064-5.
[45]GREENE J F,HAMMOCK B D.Toxicity of linoleic acid metabolites[J].Advances in Experimental Medicine and Biology,1999,469:471-477.DOI:10.1007/978-1-4615-4793-869.
[46]GREENE J F,NEWMAN J W,WILLIAMSON K C,et al.Toxicity of epoxy fatty acids and related compounds to cells expressing human soluble epoxide hydrolase[J].Chemical Research in Toxicology,2000,13:217-226.DOI:10.1021/tx990162c.
[47]GREENE J F,WILLIAMSON K C,NEWMAN J W,et al.Metabolism of monoepoxides of methyl linoleate:bioactivation and detoxification[J].Archives of Biochemistry and Biophysics,2000,376:420-432.DOI:10.1006/abbi.2000.1753.
[48]NEWMAN J W,MORISSEAU C,HAMMOCK B D.Epoxide hydrolases:their roles and interactions with lipid metabolism[J].Progress in Lipid Research,2005,44:1-51.DOI:10.1016/j.plipres.2004.10.001.
[49]SRINIVAS REDDY P,CHARLES KUMAR T,NARSA REDDY M,et al.Diferential formation of octadecadienoic acid and octadecatrienoic acid products in control and injured/infected potato tubers[J].Biochimica et Biophysica Acta,2000,1483(2):294-300.DOI:10.1016/S1388-1981(99)00191-2.
[50]ISHIZAKI T,TAKAHASHI H,OZAWA T,et al.Leukotoxin,9,10-epoxy-12-octadecenoate causes pulmonary vasodilation in rats[J].American Journal of Physiology,1995,268:123-128.
[51]FUKUSHIMA A,HAYAKAWA M,SUGIYAMA S,et al.Cardiovascular effects of leukotoxin(9,10-epoxy12-octadecenoate)and free fatty acids in dogs[J].Cardiovascular Research,1988,22:213-218.DOI:10.1093/cvr/22.3.213.
[52]OZAWA T,HAYAKAWA M,KOSAKA K,et al.Leukotoxin,9,10-epoxy-12-octadecenoate,as a burn toxin causing adult respiratory distress syndrome[J].Advances in Prostaglandin,Thromboxane and Leukotriene Research,1991,21:569-572.
[53]SUGIYAMA S,HAYAKAWA M,NAGAI S,et al.Leukotoxin,9,10-epoxy-12-octadecenoate,cause cardiac failure in dogs[J].Life Sciences,1978,40:225-231.DOI:10.1016/0024-3205(87)90336-5.
[54]AKABANE H,TAKATORI T,TERAZAWA K,et al.Leukotoxin synthesis and its effects on blood pressure of guinea pigs[J].Japanese Journal of Clinical Oncology,1991,20:203-209.DOI:10.14921/jscc1971b.20.4_203.
[55]HU J N,TAKI F,SUGIYAMA S,et al.Neutrophil-derived epoxide,9,10-epoxy-12-octadecenoate,induces pulmonary edema[J].Lung,1988,166:327-337.DOI:10.1007/BF02714065.
[56]NAKANISHI M,ISHIZAKI T,DEMURA Y,et al.Leukotoxin,9,10-epoxy-12-octadecenoate,causes pulmonary vasodilation by stimulation of vascular eNOS and iNOS[J].Lung,2000,178:137-148.DOI:10.1007/s00408000000017.
[57]MORAN J H,MITCHELL L A,BRADBURY J A,et al.Analysis of the cytotoxic properties of linoleic acid metabolites produced by renal and hepatic P450s[J].Toxicology and Applied Pharmacology,2000,168:268-279.DOI:10.1006/taap.2001.9160.
[58]MITCHELL L A,GRANT D F,MELCHERT R B,et al.Linoleic acid metabolites act to increase contractility in isolated rat heart[J].Cardiovascular Toxicology,2002,2(3):219-229.DOI:10.1007/s12012-002-0006-3.
[59]NOWAK G,GRANT D F,MORAN J H.Linoleic acid epoxide promotes the maintenance of mitochondrial function and active Na+transport following hypoxia[J].Toxicology Letters,2004,147:161-175.DOI:10.1016/j.toxlet.2003.11.002.
[60]SMITH K R,PINKERTON K E,WATANABE T,et al.Attenuation of tobacco smoke-induced lung inflammation by treatment with a soluble epoxide hydrolase inhibitor[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102:2186-2191.DOI:10.1073/pnas.0409591102.
[61]KUBALA L,SCHMELZER K R,KLINKE A,et al.Modulation of arachidonic and linoleic acid metabolites in myeloperoxidasedeficient mice during acute inflammation[J].Free Radical Biology and Medicine,2010,48:1131-1320.DOI:10.1016/j.freeradbiomed.2010.02.010.
[62]ZHAO X,YAMAMOTO T,NEWMAN J W,et al.Soluble epoxide hydrolase inhibition protects the kidney from hypertension-induced damage[J].Journal of American Society of Nephrology,2004,15:1244-1253.
[63]NEWMAN J W,WATANABE T,HAMMOCK B D.The simultaneous quantification of cytochrome P450 dependent linoleate and arachidonate metabolites in urine by HPLC-MS/MS[J].Journal of Lipid Research,2002,43:1563-1578.DOI:10.1194/jlr.D200018-JLR200.
[64]DREIS BACH A W,RICE J C,JAPA S.Salt loading increases urinary excretion of linoleic acid diols and triols in healthy human subjects[J].Hypertension,2008,51:755-761.DOI:10.1161/HYPERTENSIONAHA.107.100123.
[65]ULU A,DAVIS B B,TSAI H J,et al.Soluble epoxide hydrolase inhibitors reduce the development of atherosclerosis in apolipoprotein e-knockout mouse model[J].Journal of Cardiovascular Pharmacology,2008,52:314-323.DOI:10.1097/FJC.0b013e318185fa3c.
[66]JUDE A R,LITTLE J M,FREEMAN J P,et al.Linoleic acid diols are novel substrates for human UDP-glucuronosyltransferases[J].Archives of Biochemistry and Biophysics,2000,380:294-302.DOI:10.1006/abbi.2000.1933.
[67]SISEMORE M F,ZHENG J,YANG J C,et al.Cellular characterization of leukotoxin diol-induced mitochondrial dysfunction[J].Archives of Biochemistry and Biophysics,2001,392:32-37.DOI:10.1006/abbi.2001.2434.
[68]IBARGOITIA M L,SOPELANA P,GUILLÉN M D.1H Nuclear magnetic resonance monitoring of the degradation of margarines of varied compositions when heated to high temperature[J].Food Chemistry,2014,165:119-128.DOI:10.1016/j.foodchem.2014.05.065.
[69]GUILLÉN M D,RUIZ A.High resolution1H nuclear magnetic resonance in the study of edible oils and fats[J].Trends in Food Science and Technology,2001,12:328-338.DOI:10.1016/S0924-2244(01)00101-7.
Progress in Studies on Oxidation Products of Linoleic Acid Leukotoxin and Leukotoxin Diols
SONG Hui1,2,GENG Zhiming1,*,REN Shuang1,2,WANG Daoying1,DU Panpan1,2,ZHANG Muhan1,SUN Chong1,LIU Fang1,XU Weimin1
(1.Institute of Agricultural Products Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China; 2.Key Laboratory of Meat Processing and Quality Control,Ministry of Education,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:Leukotoxin(Ltx)and leukotoxin diol(Ltxd)are oxidation products of linoleic acid(LA).The existing studies indicate that both Ltx and Ltxd are cytotoxic and associated with a number of mammalian diseases.Exogenous Ltx and Ltxd can disrupt the endocrine function in female rats.The present paper reviews the recent progress made in the studies of Ltx and Ltxd with respect to discovery,mechanisms of formation,pathological and physiological significance,toxicological effects and analytical methods.Moreover,further studies in this area are also suggested.
Key words:linoleic acid; lipid oxidation; leukotoxin; leukotoxin diol
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2016)05-0223-07
DOI:10.7506/spkx1002-6630-201605040
*通信作者:耿志明(1965—),男,研究员,硕士,研究方向为食品科学。E-mail:zmgeng@163.com
作者简介:宋慧(1992—),女,硕士研究生,研究方向为肉品加工与质量控制。E-mail:1562275871@qq.com
基金项目:国家自然科学基金青年科学基金项目(31401560);江苏省农业科技自主创新资金项目(CX(13)3081)
收稿日期:2015-05-03
