脆江蓠多糖体内抗肿瘤活性及其作用机制
2016-04-15鞠瑶瑶叶天文陈美珍汕头大学理学院广东汕头515063
鞠瑶瑶,叶天文,谢 飞,陈美珍(汕头大学理学院,广东 汕头 515063)
脆江蓠多糖体内抗肿瘤活性及其作用机制
鞠瑶瑶,叶天文,谢 飞,陈美珍*
(汕头大学理学院,广东 汕头 515063)
摘 要:目的:研究脆江蓠多糖(Gracilaria chouae polysaccharides,GLP)的体内抗肿瘤活性。方法:以GLP为受试物,考察其对S180肉瘤荷瘤小鼠的抗肿瘤活性,同时通过测定小鼠机体免疫系统各项生化指标,初步探讨GLP的抗肿瘤作用机制。结果:GLP对S180荷瘤小鼠具有较强的抑瘤活性,当小鼠的GLP腹腔注射剂量为100 mg/(kg•d)(以体质量计)时,抑瘤率达到34.75%,高于中剂量灌胃组(200 mg/(kg•d))的抑瘤率(31.35%)。同时,S180荷瘤小鼠免疫器官指数极显著增大(P<0.01),GLP还激活了S180荷瘤小鼠淋巴细胞的增殖分化,S180荷瘤小鼠白细胞介素-2(interleukin-2,IL-2)、干扰素-γ(interferon-γ,IFN-γ)水平极显著上升(P<0.01),IL-10水平极显著下降(P<0.01),GLP对免疫系统显示出较好的保护作用。结论:GLP具有较强的抗肿瘤活性,且腹腔注射给药效果优于灌胃给药。GLP对小鼠机体免疫调节作用可能是其抗肿瘤作用的主要机制之一。
关键词:脆江蓠多糖;抗肿瘤;免疫作用
引文格式:
鞠瑶瑶,叶天文,谢飞,等.脆江蓠多糖体内抗肿瘤活性及其作用机制[J].食品科学,2016,37(5):208-213.DOI:10.7506/spkx1002-6630-201605037.http://www.spkx.net.cn
JU Yaoyao,YE Tianwen,XIE Fei,et al.Antitumor activity in vivo and mechanism of action of Gracilaria chouae polysaccharides[J].Food Science,2016,37(5):208-213.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605037.http://www.spkx.net.cn
江蓠是红藻门(R h o d o p h y t a)、真红藻纲(Florideae)、杉藻目(Gigartinales)、江蓠科(Gracilariaceae)、江蓠属(Gracilaria)的统称[1],脆江蓠(Gracilaria chouae)为江蓠属的一种大型经济类海藻。江蓠含有丰富的多糖、膳食纤维、维生素、矿物质等,具有降血脂[2]、抗氧化[3]、抗辐射[4]等保健功效。国内外研究表明,海藻多糖具有抗肿瘤、抗辐射、清除自由基、延缓衰老等作用[5-6],陈美珍[7]、宫春宇[8]等的研究表明江蓠属的龙须菜多糖可显著增强机体免疫活性;Fan Yanli等[9]研究发现龙须菜酸性多糖可有效抑制H22肝癌细胞的生长;Sun Liqin等[10]亦报道了红藻门的紫球藻多糖可有效抑制S180肉瘤的生长和增强机体免疫力。诱导肿瘤细胞凋亡[11-12]是海藻多糖的抗肿瘤机制之一,Sarangi[13]、Lee[14]、Zhang Mei[15]等的研究均证明了多糖可将肿瘤细胞周期阻滞于不同时期,从而诱导肿瘤细胞凋亡;此外,海藻多糖还可通过激活淋巴细胞[16]、提高荷瘤小鼠免疫器官指数[17]、激活巨噬细胞并促进相关细胞因子的分泌[18-21]等途径间接发挥抗肿瘤活性。
脆江蓠是一种新型的养殖海藻,目前已在广东省南澳沿海人工养殖成功并可大面积种植。作者前期研究发现脆江蓠含有占藻体干质量29.47%的多糖,脆江蓠多糖(Gracilaria chouae polysaccharides,GLP)对体外培养的宫颈癌细胞HeLa、人肝癌细胞HepG2、人乳腺癌细胞MCF-7和人食管癌细胞EC-109的生长抑制率分别达到49.11%、41.18%、34.98%和31.33%,并均存在剂量依赖关系[22]。在此基础上,本研究进一步探究GLP的体内抗肿瘤活性及其作用机理,以期为GLP的开发利用提供理论依据。
1 材料与方法
1.1材料、动物与试剂
GLP按照实验室前期建立的优化工艺制备:将原材料洗净、烘干、粉碎得干粉。取干粉按一定料液比热水浸提,经离心、醇沉、三氯乙酸除蛋白质、透析72 h后,冷冻干燥得多糖样品。苯酚-硫酸法[23]测得GLP样品中多糖含量为96.32%,考马斯亮蓝法[24]测得GLP蛋白质含量为0.63%。使用时用双蒸水将GLP配制成不同剂量,其中注射用样品配制后需过滤除菌。人宫颈癌HeLa细胞株由汕头大学多学科中心提供。
S P F级昆明种雄性小鼠7 0 只,体质量(23.62±1.25)g;SPF级S180腹水瘤雌性小鼠(38.25 g)。以上两种小鼠均购于厦门大学实验动物中心,生产许可证号:SCXK(闽)2004-0001。
DMEM高糖培养基 美国HyClone公司;胎牛血清 杭州四季青科技有限公司;胰酶细胞消化液、青霉素-链霉素溶液 碧云天生物技术研究所;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;阳性药物5-氟尿嘧啶(5-fluorouracil,5-FU) 上海源叶生物科技有限公司;伴刀豆球蛋白(concanavalin A,ConA) 广州市齐云生物技术有限公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫检测(enzyme-linked immunosorbent assay,ELISA)试剂盒、小鼠白细胞介素-2(interleukin-2,IL-2)ELISA试剂盒、小鼠白细胞介素-10(IL-10)ELISA试剂盒、小鼠干扰素-γ(interferon-γ,IFN-γ)ELISA试剂盒 南京建成生物工程研究所。
1.2仪器与设备
BCM-13WA超净工作台 苏州安泰空气技术有限公司;BT124S型电子分析天平 德国Sartorius公司;台式高速离心机 德国Eppendorf公司;3111型CO2细胞培养箱 美国Thermo公司;CK30倒置显微镜、普通光学显微镜 日本Olympus公司;倒置荧光显微镜 日本Nikon公司;-65 ℃超低温冰箱 中科美菱低温科技有限责任公司;全波段扫描酶标仪 瑞士Tecan公司;石蜡切片机 德国Leica公司。
1.3方法
1.3.1S180荷瘤小鼠移植瘤模型的建立
将取自S180腹水瘤小鼠的S180瘤株在昆明种小鼠体内腹水传代3 次,每次7 d。无菌条件抽取最后一次荷瘤小鼠腹水,用预冷的无菌生理盐水调整细胞浓度至1.5×107个/mL,在昆明种小鼠左前肢腋窝皮下接种0.2 mL瘤细胞悬液。
1.3.2动物分组与给药
雄性昆明小鼠适应性喂养3 d后,按体质量随机分为7 组,各组体质量无显著差异,每组10 只,即正常对照组(NM组)、模型组(TM组)、阳性对照组(5-FU组)和实验组,实验组又分为GLP灌胃给药低剂量组(L-GLP组)、中剂量组(M-GLP组)、高剂量组(H-GLP组),以及注射给药组(I-GLP组)。
实验第1天,除NM组外,各组小鼠于左前肢腋窝皮下接种0.2 mL细胞浓度为1.5×107个/mL的S180瘤细胞悬液。第2天开始按实验设计剂量给药,实验组给予GLP溶液,其中L-GLP组、M-GLP组、H-GLP组分别灌胃给予150、200、250 mg/(kg•d)(以体质量计,下同)的GLP;I-GLP组给予100 mg/(kg•d)的GLP;5-FU组腹腔注射20 mg/(kg•d)的5-FU;NM与TM组灌胃等量生理盐水。连续给药8 d,每天一次,饲养过程中,小鼠自由采食、饮水,隔日更换垫料。期间观察小鼠的精神活动、毛发改变状况、体质量变化等。
1.3.3样本采集
实验第10天,称量小鼠体质量,眼眶取血,3 800 r/min离心8 min,分离血清,无菌条件下取瘤块、肝脏、脾脏、胸腺等器官称质量,用预冷的无菌生理盐水洗涤数次,血清保存于-20 ℃冰箱;肿瘤组织于4%甲醛固定,于4 ℃冰箱保存备用。

1.3.4GLP对荷瘤小鼠免疫功能的影响
按1.3.3节方法在无菌条件下取得小鼠肝脏、脾脏、胸腺等器官称质量并进行各项免疫指标的测定。
1.3.4.1免疫器官指数的计算
按照公式(2)计算小鼠免疫器官指数。
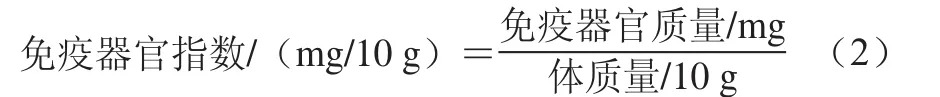
1.3.4.2荷瘤小鼠脾脏淋巴细胞增殖能力的测定
无菌条件下取小鼠脾脏制备单细胞悬液,用含有10%胎牛血清的DMEM高糖培养基稀释至2×106个/mL,得细胞悬液。细胞悬液加入到96 孔培养板,每孔200 μL,并做4 个复孔,其中3 孔加入5 μL 200 mg/L的ConA溶液(终质量浓度为5 mg/L),剩余一孔为对照。置培养箱培养3 d,于培养结束前4 h取出,吸出100 μL上清液,加入20 μL 5 mg/mL的MTT溶液,继续培养4 h。培养结束并吸出液体,每孔加入150 μL在37 ℃条件下预温的DMSO,充分振荡,酶标仪作双波长检测,检测波长570 nm,参考波长630 nm,按照公式(3)计算脾脏淋巴细胞增殖转化率[25]。

式中:A处理为ConA孔吸光度;A对照为对照孔吸光度。
1.3.4.3荷瘤小鼠自然杀伤(natural killer,NK)细胞杀伤活性的检测
采用MTT法检测小鼠NK细胞杀伤活性[26]。无菌条件下取小鼠脾脏制备单细胞悬液作为效应细胞(细胞浓度2×106个/mL),取传代培养的HeLa细胞作为靶细胞(细胞浓度2×105个/mL)。取靶细胞悬液100 μL加入96 孔板(每组4 个平行),提前培养8 h。向其中3 孔中加入等体积效应细胞,剩余孔作为靶细胞对照,并设效应细胞对照,加入等量效应细胞。将细胞于培养箱中培养4 h,结束后吸出上清液100 μL,每孔加入20 μL 5 mg/mL的MTT溶液继续孵育4 h;培养结束后吸去上清液,每孔加入150 μL DMSO溶液,充分振荡,酶标仪作双波长检测,检测波长570 nm,参考波长630 nm。按照公式(4)计算NK细胞杀伤活性。
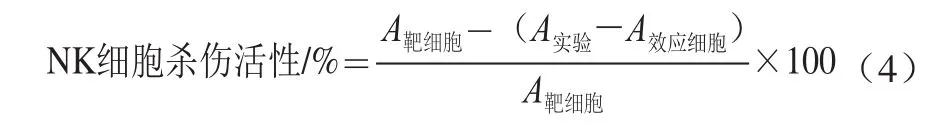
式中:A靶细胞为靶细胞孔吸光度;A实验为靶细胞与效应细胞共同作用孔吸光度;A效应细胞为效应细胞孔吸光度。
1.3.4.4荷瘤小鼠血清中TNF-α水平的测定
取1.3.3节所收集的血清,采用生物素双抗体夹心ELISA法测定小鼠血清中TNF-α的水平。具体操作按照TNF-α ELISA试剂盒说明书方法进行。
1.3.4.5荷瘤小鼠血清中IL-2、IL-10、IFN-γ水平的测定
取1.3.3节所收集的血清,应用双抗体夹心法分别测定小鼠血清中IL-2、IL-10、IFN-γ的含量,严格按照ELISA试剂盒说明书方法操作。
1.3.5小鼠肿瘤组织病理学观察
取4%甲醛固定的小鼠肿瘤组织样本,按常规方法制作切片和苏木精-伊红(hematoxylin-eosin,HE)染色,在光镜下观察肿瘤组织病理学变化,具体操作按文献[27]的方法进行。
1.4数据统计分析
采用 SPSS 17.0软件进行单因素方差分析,数据均以表示。两组间数据比较采用t检验,以P<0.05判断为差异具有显著性。
2 结果与分析
2.1GLP的抗肿瘤作用

表1 GLP对荷瘤小鼠S180肿瘤的抑制作用(x±s,n=1100)Table 1 Antitumor activity of GLP on S180 tumor-bearing mice x ,= 10)
由表1可知,GLP对S180荷瘤小鼠有显著的抑瘤作用。各实验组小鼠的瘤质量与TM组相比均呈现显著差异;其中,M-GLP组抗肿瘤效果较H-GLP组更好,说明GLP的抗肿瘤效应存在最适剂量,并非剂量越高越好。而使用低剂量注射的I-GLP组抑瘤率达34.75%,高于M-GLP组抑瘤率(31.35%),且与模型组相比呈现出极显著差异(P<0.01),说明注射给药方式更能发挥GLP的抗肿瘤作用。
2.2GLP对荷瘤小鼠免疫功能的影响
2.2.1GLP对荷瘤小鼠免疫器官指数的影响
胸腺和脾脏是机体重要的免疫器官,它们能在一定程度上反映机体免疫功能的状况[28-29],胸腺指数和脾脏指数的大小直接反映机体免疫水平的高低[30]。GLP对荷瘤小鼠免疫器官的影响如表2所示。造模后TM组小鼠的肝脏指数、脾脏指数、胸腺指数均降低,表明移植瘤对小鼠机体免疫器官产生了较强的损伤。5-FU组荷瘤小鼠的脾脏指数、胸腺指数相对于TM组均降低,意味着荷瘤小鼠免疫器官受到严重损伤,说明5-FU存在较大的副作用;而各实验组小鼠的脾脏指数、胸腺指数均有不同程度增加,表明GLP可拮抗肿瘤细胞对机体免疫器官的损伤,对免疫器官具有明显的保护作用。
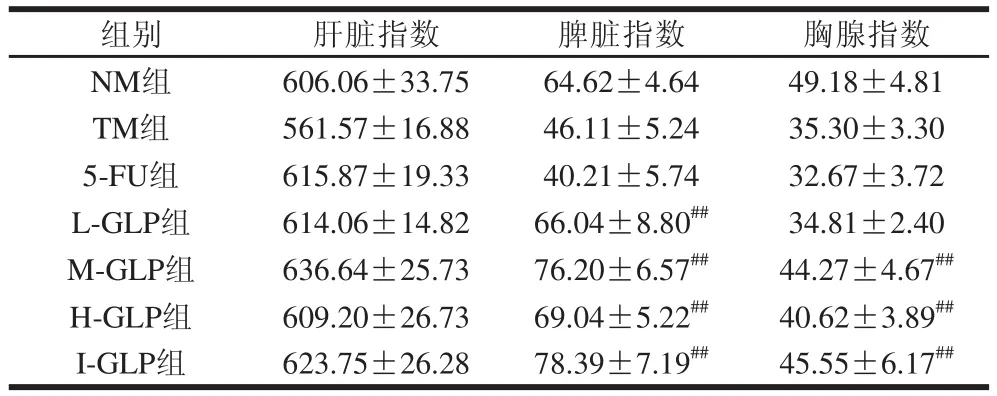
表2 脆江蓠多糖对S180荷瘤小鼠肝脏、脾脏和胸腺指数的影响(x±s,n=1100)Table 2 Effect of GLP on liver index,spleen index and thymus index of S180 tumor-bearing mice(x ,= 10)mg/10 g
2.2.2GLP对荷瘤小鼠脾脏淋巴细胞增殖能力的影响

图1 脆江蓠多糖对S180荷瘤小鼠脾脏淋巴细胞增殖能力的影响(x±s,n=1100)Fig.1 Effect of GLP on proliferation of spleen cells in S180 tumor-bearing mice(x± s,,n == 10)
由图1可知,同NM组相比,TM组小鼠脾脏淋巴增殖转化率极显著降低(P<0.01),说明移植瘤对小鼠免疫系统产生了极大的破坏作用;而各实验组均能极显著改善这一作用,使小鼠脾脏淋巴细胞的增殖转化能力增强,其中I-GLP组小鼠的脾脏淋巴细胞增殖转化率达到95.03%,与TM组相比,脾脏淋巴细胞增殖能力极显著增强(P<0.01)。
2.2.3GLP对荷瘤小鼠NK细胞杀伤活性的影响
NK细胞是机体重要的免疫细胞,在机体早期免疫监视中起重要作用[31]。如图2所示,与NM组相比,TM组及5-FU组荷瘤小鼠NK细胞杀伤活力显著或极显著降低(P<0.05或P<0.01),表明肿瘤移植后小鼠的免疫系统受到损伤,导致淋巴细胞分化为NK细胞的能力减弱;与TM组相比,I-GLP组荷瘤小鼠NK细胞杀伤活性显著提高(P<0.05),达到43.62%。以上结果表明,GLP能够促进荷瘤小鼠淋巴细胞分化为NK细胞。
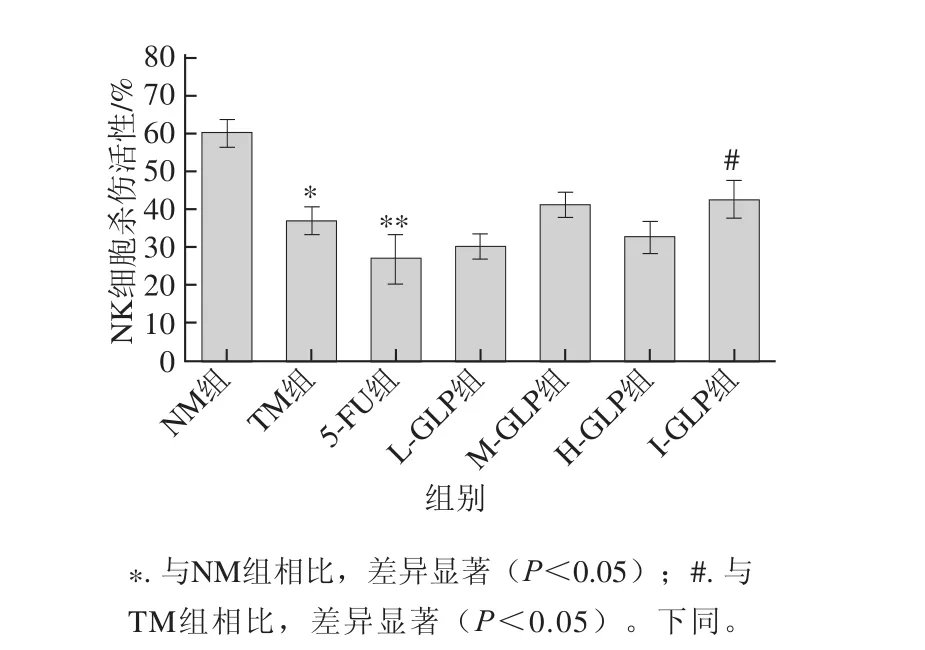
图2 GLP对S180荷瘤小鼠NK细胞杀伤活性的影响(x±s,n=1100)Fig.2 Effect of GLP on cytotoxic activity of NK cells in S180 tumor-bearing mice(x± s,,n == 10)
2.2.4GLP对荷瘤小鼠血清中TNF-α水平的影响
TNF-α是一种由单核巨噬细胞产生的低分子蛋白质,能够直接杀伤或抑制肿瘤细胞,也可通过对机体免疫功能的调节,促进T细胞和其他杀伤细胞产生对肿瘤细胞的杀伤,在免疫应答中发挥重要作用[32]。由图3可知,各实验组荷瘤小鼠脾淋巴细胞分泌TNF-α的水平较TM组均有所升高,其中I-GLP组TNF-α水平极显著升高(P<0.01),升至23.46 pg/mL;以上结果提示GLP能促进或激活脾淋巴细胞分泌TNF-α,提高机体免疫系统对肿瘤细胞的杀伤能力。

图3 GLP对S180荷瘤小鼠血清TNNFF--α水平的影响(x±s,n=1100)Fig.3 Effect of GLP on serum TNF-α level in S180 tumor-bearing mice(x± s,,n == 10)
2.2.5GLP对荷瘤小鼠血清中IL-2、IL-10、IFN-γ水平的影响
如表3所示,与TM组相比,各实验组(除L-GLP组外)荷瘤小鼠血清中IL-2水平均有不同程度升高,其中I-GLP组的IL-2水平极显著高(P<0.01)。这表明GLP可通过提高小鼠外周血IL-2水平增强小鼠的免疫功能。与TM组相比,M-GLP组、H-GLP组、I-GLP组荷瘤小鼠血清中的IFN-γ水平均呈现极显著上升的趋势(P<0.01)。与TM组相比,M-GLP组、H-GLP组、I-GLP组IL-10水平均呈现极显著下降的趋势(P<0.01)。
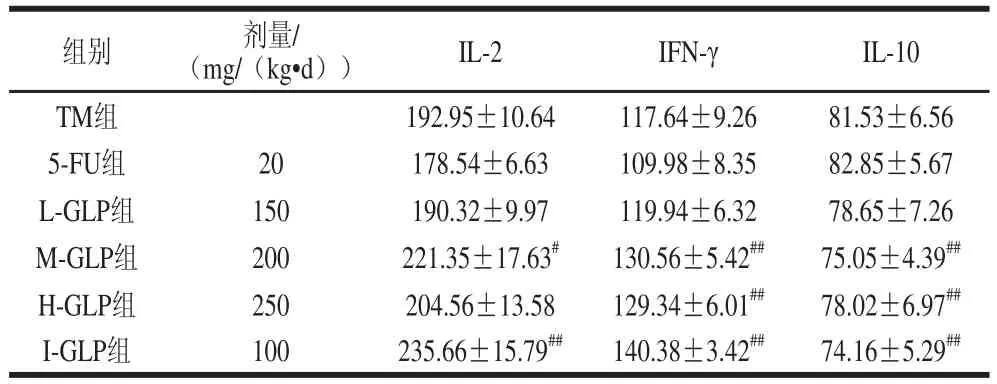
表3 GLP对S180小鼠血清中IL-2、IL-10、IFFNN--γ含量的影响(x±s,n=1100)Table 3 Effect of GLP on IL-2,lL-10 and IFN-γ in serum of S180 tumor-bearing miiccee(x ± s,,n == 10)ng/L
2.3小鼠肿瘤组织病理学观察

图4 肿瘤组织病理学特征(HE,10×2200)Fig.4 Histopathological observations of tumor tissues(HE,10 × 20)
由图4可知,TM组荷瘤小鼠的肿瘤组织细胞体积较大且排列紧密有规则、细胞核染色较深、胞浆和细胞间质少、细胞质部分染色不明显,表明造模成功。5-FU组荷瘤小鼠的肿瘤组织出现较多病灶,纤维化坏死组织面积较大;各实验组荷瘤小鼠的肿瘤组织细胞变小、细胞数量减少、排列疏松、肿瘤细胞核溶解,并出现淋巴细胞和巨噬细胞浸润现象。由于肿瘤组织细胞坏死增多,切片可观察到大量纤维状病灶,其中I-GLP组荷瘤小鼠的肿瘤出现大面积的纤维状坏死组织。以上结果表明GLP可诱导小鼠肿瘤细胞坏死,促进淋巴细胞和巨噬细胞浸润,呈现较强的抗肿瘤作用。
各实验组小鼠肿瘤组织病理学的变化结果,进一步支持了上述GLP以注射给药方式更能发挥其抗肿瘤作用的结论。
3 讨 论
体内实验结果表明,各剂量GLP灌胃组均能极显著抑制荷瘤小鼠肿瘤的生长,其中M-GLP组抗肿瘤效果比H-GLP组更好;原因可能是H-GLP组多糖剂量过高、黏度过大,影响了机体对其吸收;这也说明了多糖抗肿瘤效应存在最适剂量。I-GLP组抗肿瘤效果较灌胃给药组效果更好,说明多糖抗肿瘤效应存在最适给药方式。可能原因为腹膜密布血管和淋巴管,腹腔注射后药物通过腹膜等生物膜直接吸收,且吸收相对完全;灌胃时影响药物吸收的因素很多,如胃肠分泌的消化液、胃肠中的内容物等都会影响药物的吸收利用率。
经动物实验和临床观察表明,恶性肿瘤的发生发展过程伴随机体免疫功能的降低[28]。本实验造模成功的S180荷瘤小鼠胸腺和脾脏均出现一定程度的萎缩,致使免疫器官指数下降,证实肿瘤的发生发展会导致机体免疫功能的降低。
多糖抗肿瘤机制与其促进机体免疫系统的活力有关[33]。给药后,部分实验组小鼠的免疫器官指数、脾脏淋巴细胞增殖转化率及分泌TNF-α的能力均明显提高,说明GLP可通过促进脾淋巴细胞增殖分化增强细胞免疫功能。
IL-2,又名T细胞生长因子(T cell growth factor,TCGF),不仅能活化T细胞、促进细胞因子产生,还可刺激NK细胞增殖、增强NK细胞杀伤活性,进而促进B细胞增殖及免疫应答[34]。IFN-γ与IL-2同来源于活化的Thl细胞,IFN-γ不仅能活化NK细胞,还可抑制Th2细胞分化[35]。IL-10主要由Th2细胞分泌,抑制Thl型细胞合成分泌IL-2、IFN-γ等细胞因子。IL-10水平升高将使机体处于免疫抑制状态,使病情加重。本实验结果表明,各实验组小鼠血清中细胞因子IL-2、IFN-γ水平升高,IL-10水平降低。这说明GLP可通过促进Thl细胞因子分泌、抑制Th2细胞因子分泌、增强机体免疫功能,从而达到抗肿瘤的目的。
综上所述,GLP具有较强的抗肿瘤活性,其抗肿瘤机制与提高机体免疫功能关系密切。本实验结果可为进一步研究GLP生理活性提供理论基础。
参考文献:
[1]张峻甫,夏邦美.中国江蓠属海藻的分类研究[J].海洋科学集刊,1976(11):91-163.
[2]叶静,肖美添,汤须崇.江蓠藻膳食纤维吸附脂肪、胆固醇和胆酸钠的研究[J].食品与机械,2010,26(1):92-94.
[3]肖美添,叶静,汤须崇,等.江蓠藻膳食纤维的降血糖及抗氧化作用[J].华侨大学学报(自然科学版),2009,30(6):665-667.
[4]王亚飞,孟庆勇.粗江蓠多糖对辐射损伤小鼠NK细胞的影响[J].放射免疫学杂志,2009,22(6):557-559.DOI:10.3969/j.issn.1008-9810.2009.06.003.
[5]DIAS P F,SIQUEIRA J M,VENDRUSCOLO L F,et al.Antiangiogenic and antitumoral properties of a polysaccharide isolated from the seaweed Sargassum stenophyllum[J].Cancer Chemotherapy and Pharmacology,2005,56(4):436-446.DOI:10.1007/s00280-004-0995-7.
[6]DAMONTE E B,MATULEWICZ M C,CEREZO A S.Sulfated seaweed polysaccharides as antiviral agents[J].Current Medicinal Chemistry,2004,11(18):2399-2419.DOI:10.2174/0929867043364504.
[7]陈美珍,余杰,龙梓洁,等.龙须菜多糖硫酸化对免疫功能的影响[J].食品科学,2010,31(15):278-282.
[8]宫春宇,张劲松,唐庆九,等.龙须菜多糖脱硫酸化及免疫活性研究[J].中国生物工程杂志,2009,29(3):47-50.
[9]FAN Y L,WANG W H,SONG W,et al.Partial characterization and anti-tumor activity of an acidic polysaccharide from Gracilaria lemaneiformis[J].Carbohydrate Polymers,2012,88:1312-1318.DOI:10.1016/j.carbpol.2012.02.014.
[10]SUN L,WANG L,ZHOU Y.Immunomodulation and antitumor activities of different-molecular-weight polysaccharides from Porphyridium cruentum[J].Carbohydrate Polymers,2012,87(2):1206-1210.DOI:10.1016/j.carbpol.2011.08.097.
[11]谢好贵,陈美珍,张玉强.多糖抗肿瘤构效关系及其机制研究进展[J].食品科学,2011,32(11):329-333.
[12]龚非力.医学免疫学[M].北京:科学出版社,2001:271-272.
[13]SARANGI I,GHOSH D,BHUTIA S K,et al.Anti-tumor and immunomodulating effects of Pleurotus ostreatus mycelia-derived proteoglycans[J].International Immunopharmacology,2006,6(8):1287-1297.DOI:10.1016/j.intimp.2006.04.002.
[14]LEE C L,YANG X,WAN J M F.The culture duration affects the immunomodulatory and anticancer effect of polysaccharopeptide derived from Coriolus versicolor[J].Enzyme and Microbial Technology,2006,38(1):14-21.DOI:10.1016/j.enzmictec.2004.10.009.
[15]ZHANG M,CHEUNG P C K,CHIU L C M,et al.Cell-cycle arrest and apoptosis induction in human breast carcinoma MCF-7 cells by carboxymethylated β-glucan from the mushroom sclerotia of Pleurotus tuber-regium[J].Carbohydrate Polymers,2006,66(4):455-462.DOI:10.1016/j.carbpol.2006.03.031.
[16]ZHANG Y Y,LI S,WANG X H,et al.Advances in lentinan:isolation structure,chain conformation and bioactivities[J].Food Hydrocolloid,2011,25(2):196.DOI:10.1016/j.foodhyd.2010.02.001.
[17]QIU S,HUANG S,HUANG J,et al.Antitumor activity of the water-soluble polysaccharide from Hyriopsis cumingii in vitro[J].Toxicology and Industrial Health,2010,26(3):151-161.DOI:10.1177/0748233710362376.
[18]BAI Y,ZHANG P,CHEN G,et al.Macrophage immunomodulatory activity of extracellular polysaccharide(PEP)of Antarctic bacterium Pseudoaltermonas sp.S-5[J].International Immunopharmacology,2012,12(4):611-617.DOI:10.1016/j.intimp.2012.02.009.
[19]LIU Y H,LIU C H,TAN H N,et al.Sulfation of a polysaccharide obtained from Phellinus ribis and potential biological activities of the sulfated derivatives[J].Carbohydrate Polymers,2009,77(2):370-375.DOI:10.1016/j.carbpol.2009.01.008.
[20]HE P X,GENG L J,WANG Z,et al.Fermentation optimization,characterization and bioactivity of exopolysaccharides from Funalia trogii[J].Carbohydrate Polymers,2012,89(1):17-23.DOI:10.1016/j.carbpol.2012.01.093.
[21]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):5-7.
[22]陈美珍,余杰,曹纯洁,等.脆江蓠多糖对肿瘤细胞增殖和凋亡的影响[C]//全国第二届海洋与陆地多糖多肽及天然创新药物研发学术会议论文集.上海:中国生物化学与分子生物学会,2015:171-174.
[23]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279.
[24]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.DOI:10.1021/ac60111a017.
[25]于红,张学成.螺旋藻多糖对小鼠S180肉瘤的免疫抑制作用[J].海洋科学,2003,27(5):58-60.
[26]徐叔云.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1435-1457.
[27]PAN Q W,CHEN M Z,LI J.Antitumor function and mechanism of phycoerythrin from Porphyra haitanensis[J].Biological Research,2013,46(1):87-95.DOI:10.4067/S0716-97602013000100013.
[28]CHEN X M,NIE W J,YU G Q,et al.Antitumor and immunomodulatory activity of polysaccharides from Sargassum fusiforme[J].Food and Chemical Toxicology,2012,50(3):695-700.DOI:10.1016/j.fct.2011.11.015.
[29]梁永林,吴玉泓,殷银霞,等.久泻灵对小鼠胸腺、脾脏重量及单核细胞吞噬功能影响的实验研究[J].中国老年学杂志,2006,26(1):85-86.DOI:10.3969/j.issn.1005-9202.2006.01.042.
[30]KIM J W,FERRIS R L,WHITESIDE T L.Chemokine C receptor 7 expression and protection of circulating CD8+T lymphocytes from apoptosis[J].Clinical Cancer Research,2005,11(21):7901-7910.DOI:10.1158/1078-0432.CCR-05-1346.
[31]FARAG S S,CALIGIURI M A.Human natural killer cell development and biology[J].Blood Reviews,2006,20(3):123-137.DOI:10.1016/j.blre.2005.10.001.
[32]CHEN L,PAN J Z,LI X,et al.Endo-polysaccharide of Phellinus igniarius exhibited anti-tumor effect through enhancement of cell mediated immunity[J].International Immunopharmacology,2011,11(2):255-259.DOI:10.1016/j.intimp.2010.11.033.
[33]汪谦.现代医学实脸方法[M].北京:人民卫生出版社,1998:1094.
[34]WALDMANN T,TAGAYA Y,BAMFORD R.Interleukin-2,interleukin-15,and their receptors[J].International Reviews of Immunology,1998,16(3/4):205-226.DOI:10.3109/08830189809042995.
[35]AULITZKY W,GASTL G,AULITZKY W E,et al.Successful treatment of metastatic renal cell carcinoma with a biologically active dose of recombinant interferon-gamma[J].Journal of Clinical Oncology,1989,7(12):1875-1884.
Antitumor Activity in Vivo and Mechanism of Action of Gracilaria chouae Polysaccharides
JU Yaoyao,YE Tianwen,XIE Fei,CHEN Meizhen*
(College of Science,Shantou University,Shantou 515063,China)
Abstract:Objective:To investigate the antitumor activity of polysaccharides from Gracilaria chouae(GLP)in vivo.Methods:S180 sarcoma mouse model was established and used for the determination of antitumor activity of GLP in vivo.In addition,the underlying mechanism was explored by measuring biochemical parameters of immune system in the mice.Results:GLP definitely had inhibitory effect on S180 sarcoma in vivo.An inhibition rate of 34.75% was obtained with intraperitoneal injection at a dose of 100 mg/(kg·d),higher than that(31.35%)of the medium-dose intragastric administration group(200 mg/(kg·d)).Immune organ indices of tumor-bearing mice significantly increased(P < 0.01).Additionally,the proliferation and the differentiation of lymphocytes was activated by GLP administration.The levels of IL-2 and IFN-γ significantly increase(P < 0.01),while the level of IL-10 significantly decreased(P < 0.01).GLP showed good protection on the immune system.Conclusion:GLP had strong anti-tumor activity and was more effective when given by intraperitoneal injection than by intragastric administration.The anti-tumor effect of GLP was mainly achieved by improving immune function in mice.
Key words:Gracilaria chouae polysaccharides(GLP); antitumor; immunological effect
中图分类号:R931
文献标志码:A
文章编号:1002-6630(2016)05-0208-06
DOI:10.7506/spkx1002-6630-201605037
*通信作者:陈美珍(1956—),女,教授,本科,主要从事活性物质研究与开发。E-mail:chenmz@stu.edu.cn
作者简介:鞠瑶瑶(1988—),女,硕士研究生,主要从事活性物质研究与开发。E-mail:12yyju@stu.edu.cn
基金项目:广东省科技计划项目(2013B0203012005);2013年汕头大学实验教学示范中心项目(生物学实验教学中心);2013年广东省高等学校教学质量与教学改革工程本科类立项建设项目(汕头大学生物学实验教学示范中心)
收稿日期:2015-04-27
