人乳头瘤病毒L2蛋白的病毒样颗粒疫苗研究
2016-04-15李军强杨鸣鸣宇学锋邵忠琦
蒋 蓉 李军强 杨鸣鸣 朱 涛 宇学锋 邵忠琦
(天津康希诺生物技术有限公司,天津市呼吸道细菌重组及结合疫苗企业重点实验室,天津300457)
人乳头瘤病毒L2蛋白的病毒样颗粒疫苗研究
蒋蓉李军强杨鸣鸣朱涛宇学锋邵忠琦
(天津康希诺生物技术有限公司,天津市呼吸道细菌重组及结合疫苗企业重点实验室,天津300457)
[摘要]目的:构建乙肝病毒核心抗原(HBcAg)与人乳头瘤病毒(HPV)L2抗原的融合蛋白,在大肠杆菌中重组表达形成病毒样颗粒结构;通过小鼠模型检测HBc-L2融合蛋白的免疫原性,并研究免疫后获得的小鼠血清对HPV假病毒的中和效力。方法:通过DNA合成构建16型人乳头瘤病毒L2基因片段与HBcAg基因的融合基因,将其克隆至表达载体pET9a并在大肠杆菌中进行HBc-L2融合蛋白表达;将经纯化、鉴定后的融合蛋白免疫BALB/c小鼠,用间接ELISA方法检测小鼠血清中针对L2抗原的抗体效价,并分别研究小鼠血清对16型和18型HPV假病毒的中和效力。结果:HBc-L2融合基因经大肠杆菌系统表达形成可溶性蛋白,经硫酸铵沉淀和CL-4B凝胶分离纯化后获得纯度>80%的HBc-L2蛋白;分子筛高效液相色谱-多角度激光光散射(SEC-MALS)联用技术和透射电子显微镜的分析结果表明,HBc-L2融合蛋白在表达过程中自动组装形成稳定的病毒样颗粒;将纯化后的HBc-L2蛋白免疫BALB/c小鼠可获得针对L2抗原的高滴度抗体,且小鼠血清具有中和16和18型两种假病毒的中和抗体活性。结论:HBc-L2病毒样颗粒可以有效地增强L2抗原的免疫原性,并可刺激机体产生针对多型HPV的免疫保护力,是一个具有潜力的新型广谱HPV疫苗。
[关键词]人乳头瘤病毒;L2抗原;乙肝病毒核心抗原;病毒样颗粒;免疫原性;中和抗体
人乳头瘤病毒(Human papillomavirus,HPV)是一种无包膜双链DNA病毒,能引起子宫颈癌、生殖器疣等肿瘤疾病或癌症[1]。宫颈癌在妇女中发生率位列第二,在发展中国家发生率明显高于发达国家。统计表明,我国每年新增宫颈癌患者约15万人左右,且年轻患者比例上升明显[2]。
近年来,运用重组DNA技术制备基因工程HPV疫苗的研究获得了突破性进展[3]。L1与L2基因分别编码HPV的主要及次要衣壳蛋白,L1蛋白约占衣壳蛋白80%以上,能自动组装成病毒样颗粒(Virus-like particle,VLP);L2蛋白在衣壳蛋白中含量少于20%,且无法单独形成VLP[4]。国外已上市或获批的产品,如默沙东四价、九价加德西(Gardasil,HPV6,11,16,18;HPV6,11,16,18,31,33,45,52,58)与葛兰素史克二价卉妍康(Cervarix,HPV16,18)均利用L1自身形成VLP结构的原理进行研制[5]。但这些疫苗生产工艺复杂、价格昂贵,无法广泛满足市场,尤其是发展中国家低收入人群的需求[6]。研究表明,接种氨基酸序列较为保守的L2蛋白能诱导产生涵盖多种血清型HPV的保护力,但L2蛋白或L2多肽本身免疫原性较低[7]。通过将L2与Toll样受体2 (TLR2) 融合、在腺伴随病毒颗粒骨架中插入L2多肽抗原或将经修饰的细菌鞭毛蛋白(Fha)与L2融合等方法均可以提高L2的免疫原性,并获得具有中和多种血清型HPV的免疫血清[8-10]。本研究选用的两个L2蛋白的N-端多肽在不同型的HPV间具有较强保守性,并在早期研究中被证实对HPV16、18、31具有一定交叉保护活性[11]。
重组的乙肝病毒核心抗原(Hepatitis B virus core antigen,HBcAg或HBc)可在大肠杆菌中高效表达,易纯化,并能自身组装形成VLP。构建合适的HBc与目标抗原融合蛋白,将目标抗原展示在HBc形成的VLP表面,能有效地提高目标抗原的免疫原性[12]。ACAMBIS公司将流感M2e蛋白插入HBc制备了ACAM-FLU-A的新型通用型抗流感疫苗,该疫苗具有较好的免疫原性及保护性,并已经进入临床研究阶段。除病毒疫苗之外,HBc载体还被广泛运用于细菌、寄生虫等多种病原疫苗研究[13]。
本研究将两段16型人乳头瘤病毒L2抗原多肽(13~47位与65~81位氨基酸) 偶联后作为抗原片段插入到HBc蛋白中,在大肠杆菌中表达融合蛋白并自动组装成VLP。研究结果显示,HBc-L2病毒样颗粒显著增强了L2多肽抗原的免疫原性,所获得的小鼠血清具有中和16型与18型HPV的能力。此项研究为开发广谱、低成本的宫颈癌疫苗提供了一个新途径。
1材料与方法
1.1材料
1.1.1假病毒、细胞、菌株与动物HPV16、HPV18假病毒与阳性血清由北京微谷生物医药有限公司馈赠;293FT细胞由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠;感受态BL21(DE3)、DH5α与T载体购自全式金生物技术有限公司;SPF级BALB/c小鼠购自北京维通利华实验动物技术有限公司;pET9a载体、pFN2K (GST) Flexi Vector购自Promega公司。
1.1.2试剂和仪器DMEM培养基、0.25%胰酶、胎牛血清购自Gibco公司;HRP-羊抗鼠IgG购自武汉三鹰生物技术有限公司;T4连接酶、限制性核酸内切酶BamHⅠ、NdeⅠ、PmeⅠ与AsiSⅠ购自New EnglandBiolabs公司;质粒小量提取试剂盒购自天根生化科技有限公司,胶回收试剂盒购自全式金生物技术有限公司;Sepharose CL-4B购自GE公司,GST SEPHAROSE购自索莱宝公司;蛋白纯化仪为Akta Prime Plus(GE公司);流式细胞仪为Millipore guava easyCyte HT,荧光显微成像系统为尼康TE2000U,透射电子显微镜为FEI Tecnai 20。
1.2方法
1.2.1表达载体的构建本研究中采用的HBc蛋白为去掉C-端164~183位氨基酸的截短蛋白,取而代之的是一个半胱氨酸。在HBc蛋白178位置上插入了两个抗原片段,分别为L2蛋白13~47位和65~81位氨基酸片段。插入到HBc的L2多肽序列为ASATQLYKTCKQAGTCPPDIIPKVEGKTIA-DQILQ和GTGGRTGYIPLGTRPPT。
融合基因(包括两端的BamHⅠ和NdeⅠ酶切位点)委托Life Technology公司合成构建。将扩增的DNA片段经BamHⅠ和NdeⅠ双酶切后回收目的基因,然后与经同样酶切的载体质粒pET9a连接。连接产物转化DH5α,挑取并纯化卡那霉素抗性菌落;阳性克隆经LB培养基扩增后提取质粒进行酶切鉴定,将获得的HBc-L2融合基因的表达质粒命名为pET9a-HBc-L2。
委托Invitrogen公司合成以下两个DNA引物:5′-GCGATCGCTCAACTTTATAAAACATGCAAACAG-3′与5′-GTTTAAACTTAAACCTTAGGTATAATGTC-AGGT-3′。以L2融合基因的表达质粒pET9a-HBc-L2为模板,加入上述引物,PCR扩增L2抗原编码片段。将PCR产物与T载体连接,对获得的质粒进行AsiSⅠ和PmeⅠ双酶切,胶回收L2目的条带,将其与经同样酶切的载体质粒pFN2K (GST) Flexi Vector连接。连接产物转化DH5a,挑取卡那霉素抗性菌落,阳性克隆经LB培养基扩增后提取质粒进行酶切鉴定,将获得的表达质粒命名为pGST-L2。
1.2.2重组融合蛋白的表达与纯化将表达质粒pET9a-HBc-L2转化BL21(DE3),挑取卡那霉素抗性菌落,纯化后接种LB培养基进行扩增,在培养液中加入20%甘油,分装后于-80℃保存菌种。取冻存菌种接种至10 ml LB培养基,37℃摇菌过夜复苏;转接入400 ml新鲜培养基扩大培养至OD600约0.6~0.7时,加入1 mmol/L IPTG,25℃诱导4 h;离心收集菌体,用TGE buffer(50 mmol/L Tris,0.5 mmol/L EDTA,50 mmol/L NaCl,5%甘油)重悬细胞;超声破碎后离心收集上清,加入10% w/v (NH4)2SO4沉淀蛋白,用TGE buffer重悬沉淀,收集重悬液并用0.22 μm滤膜过滤,然后用100 kD膜包超滤浓缩。用CL-4B凝胶对浓缩液进一步分离纯化,收集目的蛋白。
将表达质粒pGST-L2转化BL21(DE3)感受态细胞获得GST-L2表达菌株。取冻存菌种接种10 ml LB培养基,37℃摇菌过夜复苏;转接入400 ml新鲜培养基扩大培养至OD600约0.6~0.7时,加入1 mmol/L IPTG,37℃诱导4 h;离心收集菌体,用PBS重悬细胞;超声破碎后离心收集沉淀。加入200 ml 8 mol/L尿素过夜溶解包涵体,离心收集上清,浓度梯度透析至PBS中,经GST SEPHAROSE柱纯化,收集目的蛋白。
1.2.3病毒样颗粒大小和形态的分析鉴定采用分子筛高效液相色谱(SEC-HPLC)及HPLC-多角度激光光散射(MALS)联用技术鉴定蛋白纯度和VLP颗粒大小。激光散射仪与色谱分离系统连接,将泵头放入经0.22 μm过滤并超声后的流动相后,流速调至0.1 ml/min,柱体平衡后分别对BSA和待测样品进行检测。
委托中国科学院生物物理研究所蛋白质实验平台生物成像中心采用透射电子显微镜进行VLP形态观察。
1.2.4小鼠免疫与血清样本制备分别对两个批次HBc-L2(HBc-L2-1与HBc-L2-2)病毒样颗粒样品和一批GST-L2融合蛋白样品进行免疫原性研究。实验动物为体重10~12 g的BALB/c小鼠,共104只。每批HBc-L2 VLP样品设四个浓度组,分别为20、10、5、1 μg/只,每组10只小鼠;GST-L2样品设两个浓度,分别为20、10 μg/只,每组7只;另设阴性对照组,10只小鼠,注射生理盐水。所有组别均在0天皮下注射500 μl对应样品,第14天、28天分别进行第二和第三次免疫。分别在免疫第28、42天采血,6 000 r/min离心8 min,分离血清,-20℃暂存。
1.2.5间接ELISA检测抗体效价配制5 μg/ml GST-L2蛋白溶液,100 μl/孔包被酶标板,4℃过夜。0.05%Tween PBS 洗3次,加入1%BSA 200 μl/孔,37℃孵育2 h;PBST洗3次,加入待检血清(HBc-L2实验组)100 μl/孔,37℃孵育1 h;PBST洗3次,加入HRP-羊抗鼠IgG 100 μl/孔,37℃孵育1 h;PBST洗5次,加入TMB底物显色10~15 min;每孔加入50 μl的2 mol/L H2SO4终止显色反应,酶标仪检测OD450读数。检测GST-L2融合蛋白免疫后获得的血清时,采用HBc-L2包被酶标版,检测步骤同上。
1.2.6HPV中和抗体检测在96孔细胞板每孔中加入100 μl 293FT细胞悬浮液,含1.5×104个细胞,37℃,5%CO2培养6 h。待测血清(HBc-L2三免血清)经56℃灭活30 min后按1∶15、1∶30、1∶60、1∶120进行系列稀释,阴性血清(未免疫小鼠血清)处理后仅进行1∶15稀释。根据假病毒提供方的研究数据,分别对PsV16和PsV18进行1∶200和 1∶100稀释。将假病毒和血清按1∶1进行混合,置于4℃共孵育60 min,再将混合液加入已培养6 h的细胞板中,37℃、5%CO2继续培养[14]。72 h培养结束后用荧光显微镜观察EGFP荧光表达。观察结束后,弃去培养基,每孔加入0.25%胰酶20 μl,37℃消化5 min,每孔加入200 μl 10%FBS的DMEM培养基,重悬细胞并转移至新的96孔板,用Millipore guava easyCyte HT 流式细胞仪进行分析。
1.3统计学分析组间差异选用t检验进行分析,P<0.05为差异具有显著性。
2结果
2.1表达质粒的构建编码HBc-L2的融合基因长度为663 bp,表达出的融合蛋白大小约为24 kD。如图1A所示,将构建的HBc-L2表达载体pET 9a-HBc-L2进行BamHⅠ和NdeⅠ双酶切,得到两个大小分别约为670 bp和4 300 bp DNA片段,与融合基因编码片段和pET9a载体大小相符。经验证,GST-L2的表达载体经AsiSⅠ和PmeⅠ双酶切后进行电泳,条带大小分别约为107 bp和3 765 bp,也与预期的质粒大小及基因片段一致(图1B)。
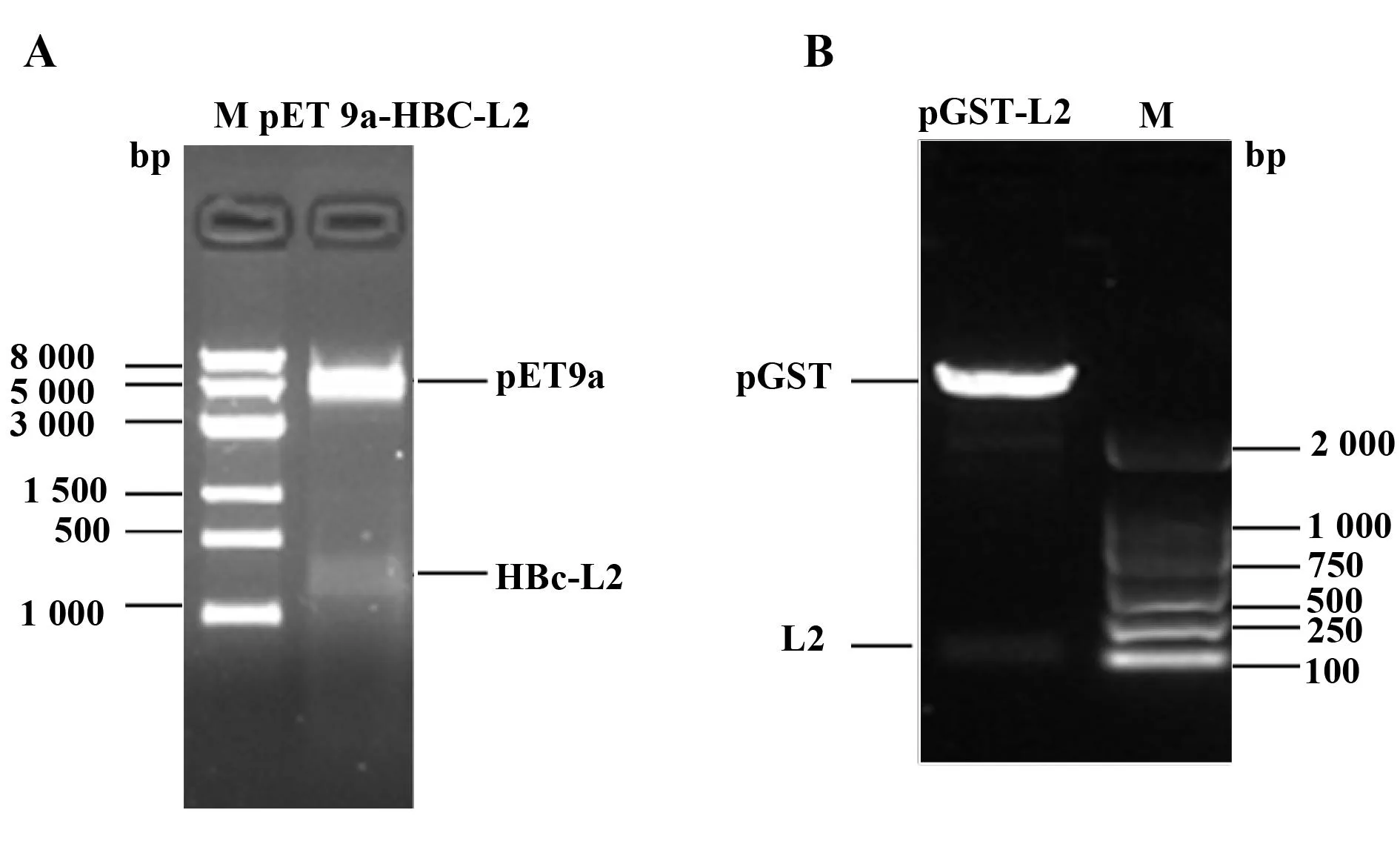
图1 表达载体双酶切鉴定图Fig.1 Restriction digestion of expression plasmids Note: A.Digestion of pET9a-HBc-L2 with BamHⅠ and NdeⅠ;B.Digestion of pGST-L2 with AsiSⅠ and PmeⅠ.
2.2HBc-L2重组蛋白的表达IPTG诱导表达结束后,离心收集菌体;超声破碎细胞后分别对上清和沉淀中的蛋白进行SDS-PAGE分析。电泳结果(图2)显示,IPTG诱导后上清和沉淀样品中均出现了一条约为24 kD的明显蛋白条带,与HBc-L2融合蛋白的理论分子量相符。因此,HBc-L2融合基因可在大肠杆菌有效表达,获得产物主要为可溶性蛋白,少部分形成包涵体。
2.3蛋白纯化与病毒样颗粒的鉴定对细胞破碎上清进行硫酸铵沉淀处理(图3A),复溶并超滤浓缩,并用CL-4B分子筛层析进一步纯化,在外水体积收集到蛋白峰(图3B,峰1);对所获样品进行蛋白电泳,结果如图3C所示,样品中目的蛋白纯度大于80%,主要杂质为分子量约30 kD的蛋白。
用SEC-HPLC方法对纯化的HBc-L2融合蛋白进行分析。HBc-L2分子量约为24 kD,而结果显示HBc-L2蛋白的出峰时间远早于66 kD的BSA(出峰时间约23 min),表明该蛋白并不以单体形式存在,而是自组装成大分子结构(图4A);SEC-HPLC-MALS联用技术分析结果进一步表明,获得的HBc-L2融合蛋白分子量大,且分布集中、结构均一(图4B)。
通过透射电子显微镜对两批纯化的HBc-L2进行观察(图5),镜下可见大量均一分布、直径约为30 nm的圆形颗粒,与报道的HBc病毒样颗粒相符,表明构建的融合蛋白HBc-L2能有效自动包装形成大分子病毒样颗粒。
2.4血清抗体效价对小鼠二次与三次免疫后的血清进行抗L2抗体效价检测,结果如图6所示。二次免疫后,低剂量组(1或5 μg)血清中滴度达到104左右,而高剂量组(10或20 μg)抗体滴度已接近或超过105(图6A);三次免疫后,各剂量组抗体滴度较二免结果略有增加(图6B),但没有显著差异(P>0.05)。比较不同批次的样品,HBc-L2-2较HBc-L2-1的免疫原性似乎更强,但两批间差异不显著(P>0.05)。上述结果表明,HBc-L2具有良好的免疫原性,二次免疫即可刺激机体产生高滴度的抗L2抗体,且不同批次样品的结构和免疫原性较一致。
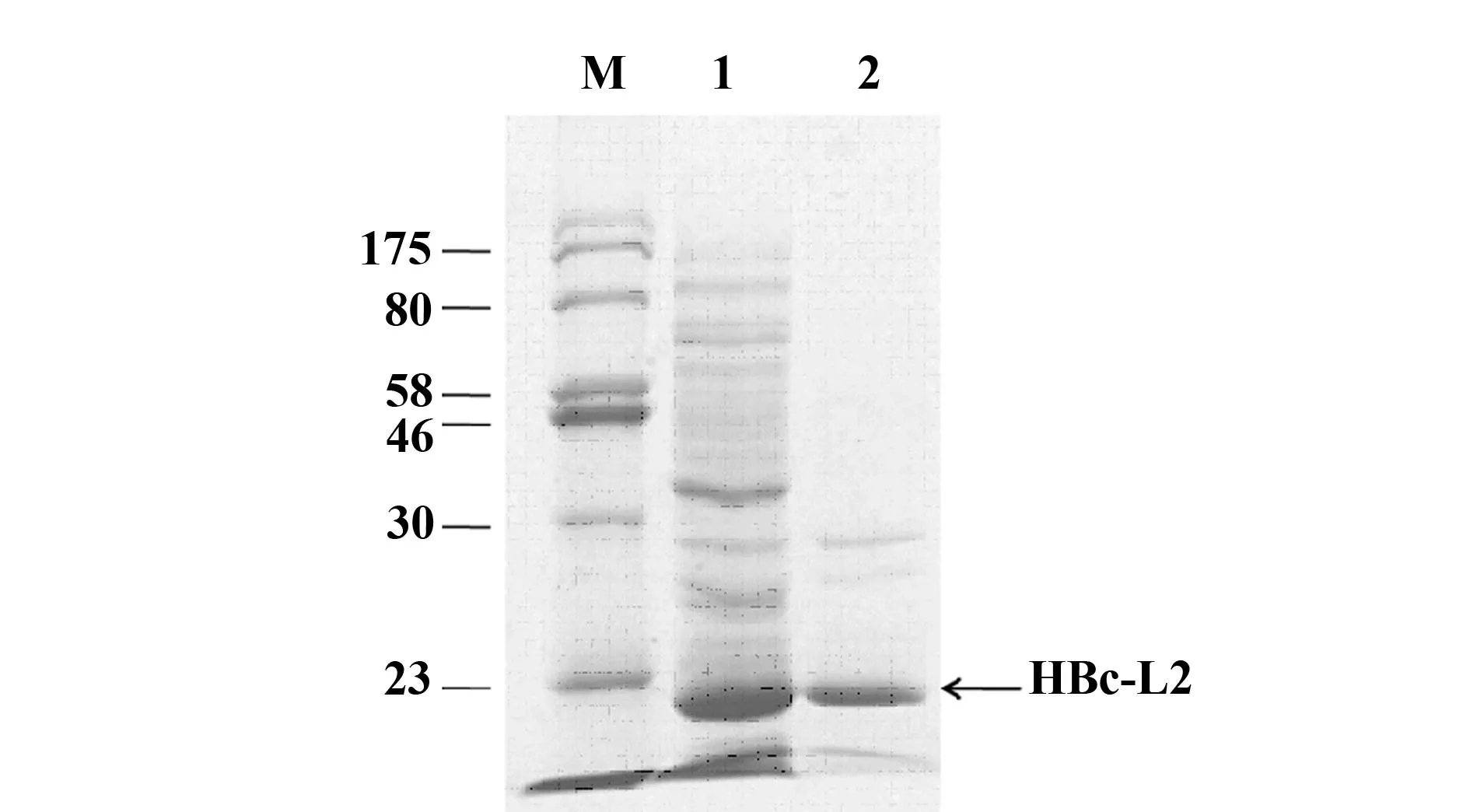
图2 HBc-L2诱导表达鉴定Fig.2 Expression of HBc-L2 after inductionNote: M.Marker;Lane 1.Soluble fraction of cell lysate;Lane 2.Insoluble fraction of cell lysate.
图6C为GST-L2融合蛋白免疫小鼠所得结果。高剂量(10和20 μg)GST-L2蛋白三次免疫后,血清中抗L2的抗体效价分别为102或103,远低于HBc-L2的免疫效果。因此,HBc-L2形成的VLP可有效地增强L2抗原的免疫原性。
2.5HPV中和抗体检测小鼠免疫血清对两种HPV假病毒(PsV16与PsV18)的中和效力,初步评价HBc-L2疫苗的保护性和广谱性。如图7所示,PsV16与PsV18能有效感染293FT细胞,阴性对照血清(1∶15倍稀释)对假病毒感染效力无影响,镜下可观察到大量感染后表达荧光的细胞。当将小鼠免疫血清(1∶15倍稀释)与PsV16、PsV18分别共孵育72 h后,PsV16与PsV18的感染能力明显被抑制,镜下仅能找到极少表达荧光的细胞。1∶30、1∶60和1∶120 稀释度的免疫血清与PsV16或PsV18共孵育后,也对两个假病毒的感染效力有不同程度的抑制(结果未显示)。
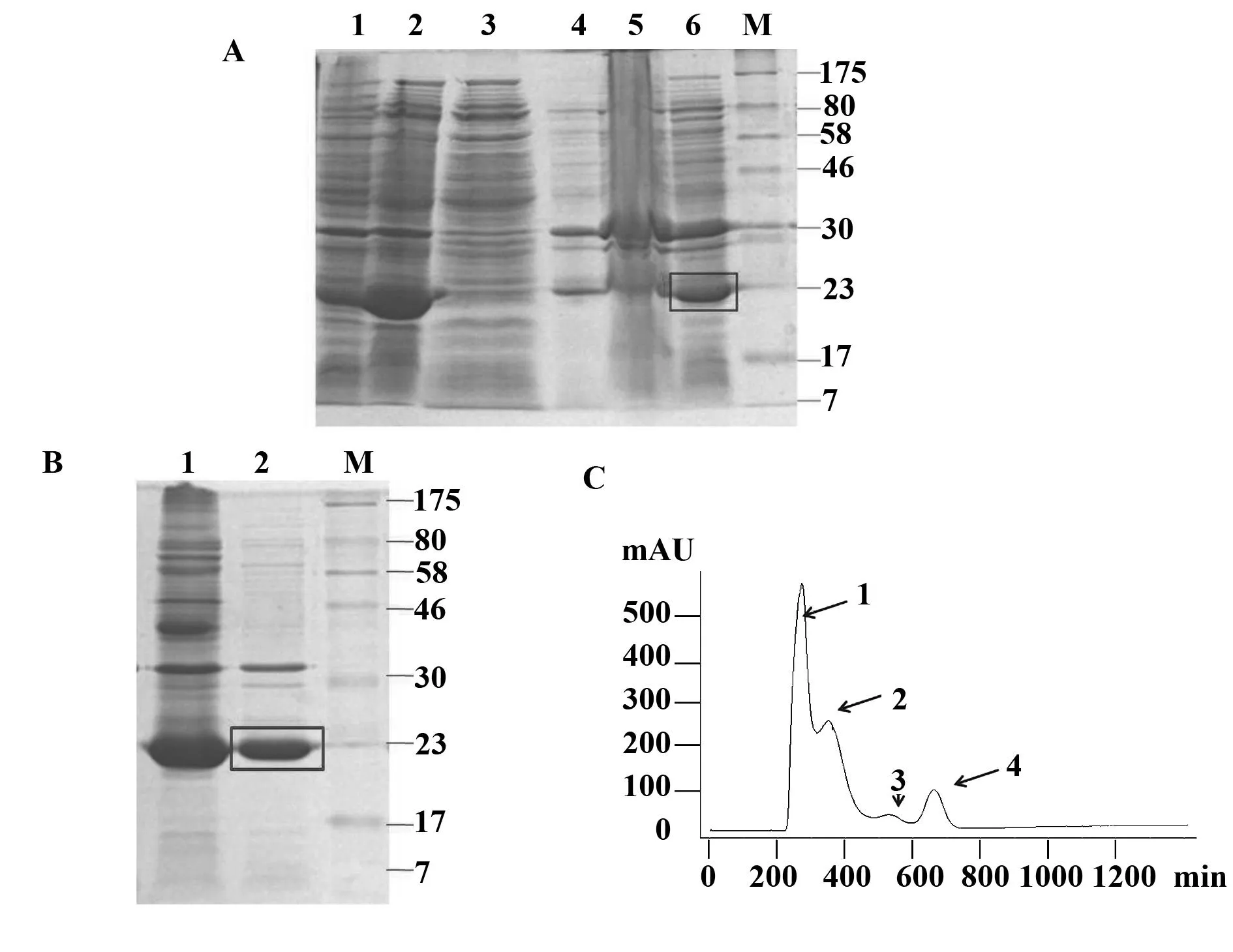
图3 HBc-L2融合蛋白纯化Fig.3 Purification of HBc-L2 fusion proteinNote: A.SDS-PAGE analysis of samples before and after ammonia sulfate precipitation;B.SDS-PAGE analysis of samples before and after CL-4B gel filtration;C.Purification of HBc-L2 by CL-4B gel filtration chromatography;A:M.Marker;1.Cell lysate before induction;2.Cell lysate after induction;3.supernatant after Ammonium sulfate precipitation;4.TGE suspension of Ammonium sulfate precipitation;5.Precipitate after centrifugation;6.Supernatant after centrifugation;B:M.Marker;1.HBc-L2 before CL-4B gel filtration;2.HBc-L2 after CL-4B gel filtration.

图4 HBc-L2融合蛋白分子大小分析Fig.4 Analysis of size of HBc-L2 fusion protein Note: A.SEC-HPLC analysis of HBc-L2;B.SEC-HPLC-MALS analysis of HBc-L2.
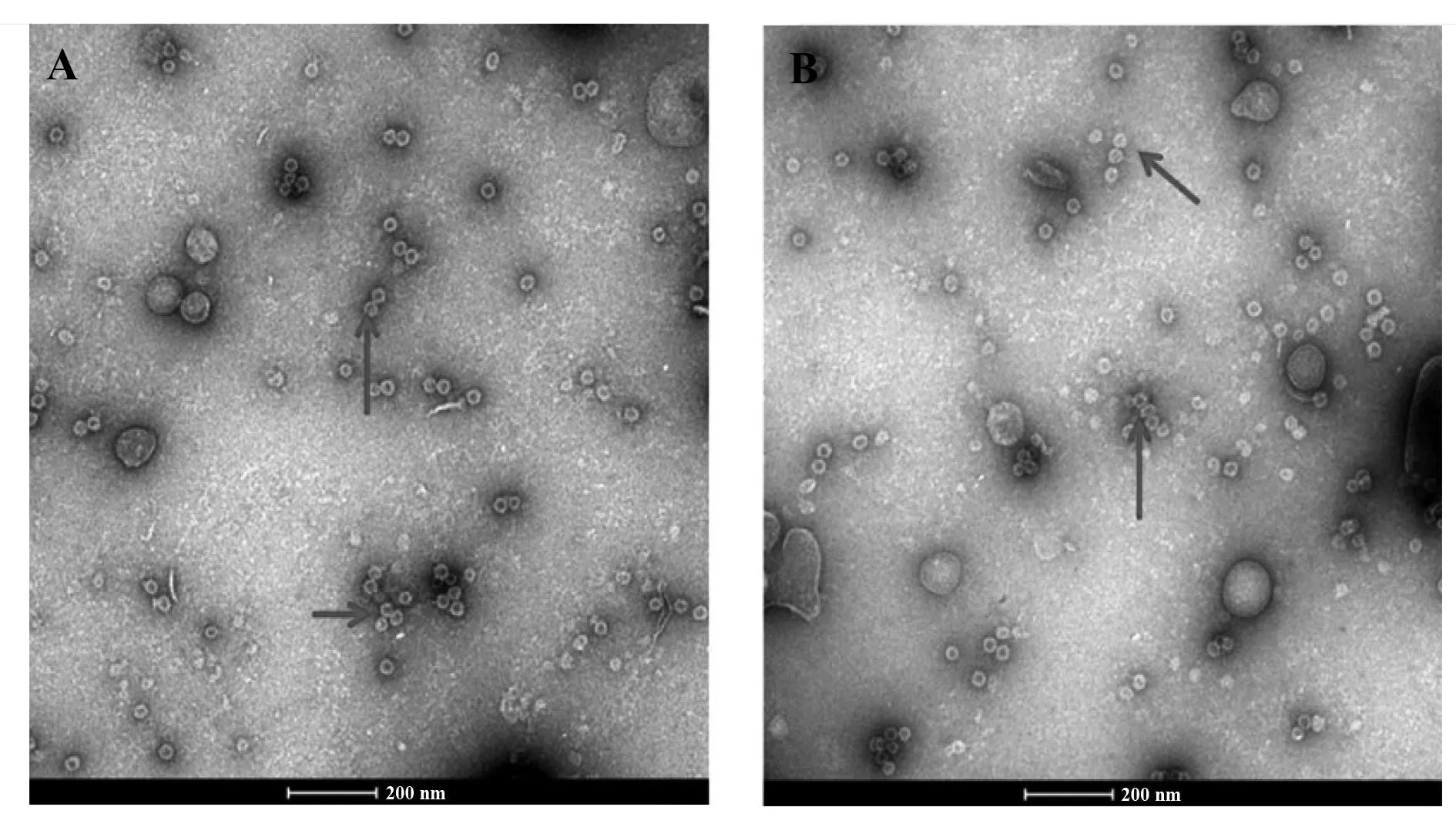
图5 HBc-L2 病毒样颗粒电子透镜鉴定Fig.5 Observation of HBc-L2 virus-like particles by TEMNote: A.HBc-L2-1;B.HBc-L2-2.

图6 血清中抗L2抗体滴度检测Fig.6 Anti-L2 antibody titers in mouse seraNote: A.After two injections with HBc-L2;B.After three injections with HBc-L2;C.After three injections with GST-L2.
将细胞消化转移后进行流式分析,结果显示阴性对照血清对假病毒无中和作用,PsV16与其共孵育后感染细胞,约有16%细胞表达荧光。当PsV16与1∶15、1∶30、1∶60、1∶120 四个梯度稀释的小鼠免疫血清共孵育后,检测出感染荧光细胞比例分别下降至4.48%、7.54%、9.32%与11.23%。PsV18与阴性血清反应后感染细胞,可以检测到约11%的细胞表达荧光。当PsV18与4个梯度稀释的小鼠免疫血清共孵育后感染细胞,所检测荧光细胞比例分别为3.46%、4.81%、9.61%、11.96%。

图7 HPV假病毒中和试验荧光采集Fig.7 Fluorescence assay of HPV pseudovirion neutralization
综合显微镜观察和流式细胞仪分析结果,HBc-L2免疫小鼠后获得的血清具有中和16型HPV的能力,并对18型HPV病毒也有较强交叉中和活性。
3讨论
引发宫颈癌的人乳头瘤病毒主要包括HPV6、11、16、18、31、33、45、52与58等血清型[15]。国外已上市的疫苗均采用主要衣壳蛋白L1作为抗原主要成分,但L1蛋白具有较强型特异性,不能覆盖其他血清型的病毒[16,17],需分别制备不同型的疫苗组分以形成多价制剂。L1蛋白在昆虫细胞与酵母细胞中表达量低,制备工艺复杂,生产成本高[18]。而世界上约有80%的宫颈癌病例发生于发展中国家,昂贵的HPV疫苗无法使这些地区的人群完全受益[19]。因此,开发更广谱、更经济的宫颈癌疫苗势在必行。
研究表明,次要衣壳蛋白L2虽不属于维持病毒结构的主要蛋白,在病毒表面含量相对较少,但能与次级病毒受体结合从而促进病毒基因组从胞内体向核内转移,与乳头瘤病毒感染有重要联系[20]。但L2免疫原性相对较弱,极大限制了基于L2抗原的疫苗开发。近年来,人们开展了大量的研究以增强L2抗原的免疫原性和保护性。Tumban等[21]将HPV16的L2短肽插入到编码MS2病毒样颗粒的质粒后,小鼠模型免疫原性得到明显提高。Tyler等[22]将含有L2蛋白整合到Qβ噬菌体VLP上,免疫小鼠血清能有效中和PsV16、18、31、45、58多种血清型假病毒,证实了以L2制备的HPV疫苗具有更广泛的中和保护力。
本研究中,我们将两个16型HPVL2蛋白N-端具有交叉保护功能的多肽抗原插入到HBc蛋白中,在大肠杆菌中表达获得HBc-L2融合蛋白,并证明经纯化的HBc-L2自动组装形成了VLP结构。由于HBc-L2可在细菌中高效表达,VLP纯化过程简单且收率高,生产成本将能得到有效控制。在小鼠试验中,HBc-L2二免及三免血清中针对L2的特异性抗体滴度能达到105~106,免疫效果远高于不能形成VLP结构的GST-L2融合蛋白。因此,将L2抗原多肽展示在HBc形成的VLP表面上能有效增强L2抗原的免疫原性。通过假病毒中和试验,进一步证实了HBc-L2 VLP免疫后血清不仅可以显著地中和16型HPV的感染效力,对18型HPV也有较强中和活性。综上,HBc-L2 VLP可能成为一个生产成本低,且对不同血清型有广泛覆盖率的新型HPV疫苗。
HPV外壳表面主要是L1蛋白,L2蛋白数量相对较少,因此,基于L2抗原的HPV疫苗能否达到足够保护性是一个需要在临床试验中回答的关键问题。HBc-L2 VLP良好的免疫原性,以及获得的免疫血清对HPV16和HPV18具有交叉中和活性,无疑为该疫苗的进一步开发打下了坚实基础,也为基于L2蛋白的疫苗开发提供了有力支持。我们将在后续试验中对添加佐剂是否会增强HBc-L2VLP的免疫原性,以及体内动物模型中该疫苗是否能有效降低HPV的感染率等问题进行研究。我们也将进一步改进HBc-L2的组成和结构,增强其免疫原性,使该疫苗可以覆盖更多血清型的HPV。
参考文献:
[1]姜志欣,吴玉磷.HPV感染及预防性HPV疫苗研究[J].中国计划生育学杂志,2008,16(5):315-317.
[2]Yu DY,Xuexinchun.The relation between human papilloma virus and cervical cancer[J].Port Health Control,2003,8(1):40-45.
[3]Gong YL,Su DM,Liu YA.Construction of prophylactic HPV vaccines using genetic engineering technology[J].China Biotechnol,2008,28(9):130-134.
[4]Wang D,Li Z,Xiao J,etal.Identification of broad-genotype HPV L2 neutralization site for Pan-HPV vaccine development by a cross-neutralizing antibody[J].PLoS One,2015,10(4):e0123944.
[5]Printz C.FDA approves Gardasil 9 for more types of HPV[J].Cancer,2015,121(8):1156-1157.
[6]Cladel NM,Budgeon LR,Balogh KK,etal.A novel pre-clinical murine model to study the life cycle and progression of cervical and anal papillomavirus infections[J].PLoS One,2015,10(3):e0120128.
[7]Chen X,Liu H,Zhang T,etal.A vaccine of L2 epitope repeats fused with a modified IgG1 Fc induced cross-neutralizing antibodies and protective immunity against divergent human papillomavirus types[J].PLoS One,2014,9(5):e95448.
[8]Alphs HH,Gambhira R,Karanam B,etal.Protection against heterologous human papillomavirus challenge by a synthetic lipopeptide vaccine containing a broadly cross-neutralizing epitope of L2[J].Proc Natl Acad Sci USA,2008,105(15):5850-5855.
[9]Nieto K,Weghofer M,Sehr P,etal.Development of AAVLP(HPV16/31L2) particles as broadly protective HPV vaccine candidate[J].PLoS One,2012,7(6):e39741.
[10]Kalnin K,Tibbitts T,Yan Y,etal.Low doses of flagellin-L2 multimer vaccines protect against challenge with diverse papillomavirus genotypes[J].Vaccine,2014,32(28):3540-3547.
[11]Conway MJ,Cruz L,Alam S,etal.Cross-neutralization potential of native human papillomavirus N-terminal L2 epitopes[J].PLoS One,2011,6(2):e16405.
[12]Paul Pumpens,Urich R,Sasnauska K,etal.Medicinal protein engineering[M].Boca Raton London New York:CPC Press,2008:205-248.
[13]杨星钰,薄洪,舒跃龙.乙肝病毒核心抗原作为载体用于病毒样颗粒疫苗研究的主要进展[J].病毒学报,2012,28(3):311-316.
[14]吴雪伶,聂建辉,张春涛,等.人乳头瘤病毒(HPV)58型DNA疫苗免疫原性的初步分析[J].病毒学报,2008,24(3):36-41.
[15]Munoz N,Bosch FX,De Sanjose S,etal.Epidemiologic classification of human papillomavirus types associated with cervical cancer[J].N Engl J Med,2003,348(6):518-527.
[16]Wheeler CM,Kjaer SK,Sigurdsson K,etal.The impact of quadrivalent human papillomavirus (HPV;types 6,11,16,and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in sexually active women aged 16-26 years[J].J Infect Dis,2009,199(7):936-944.
[17]Kemp TJ,Hildesheim A,Safaeian M,etal.HPV16/18 L1 VLP vaccine induces cross-neutralizing antibodies that May mediate cross-protection[J].Vaccine,2011,29(11):2011-2014.
[18]Roden R,Wu TC.How will HPV vaccines affect cervical cancer?[J].Nat Rev Cancer,2006,6(10):753-763.
[19]Karanam B,Jagu S,Huh WK,etal.Developing vaccines against minor capsid antigen L2 to prevent papillomavirus infection[J].Immunol Cell Biol,2009,87(4):287-299.
[20]Yang R,Day PM,Yutzy WH,etal.Cell surface-binding motifs of L2 that facilitate papillomavirus infection[J].J Virol,2003,77(6):3531-3541.
[21]Tumban E,Muttil P,Escobar CA,etal.Preclinical refinements of a broadly protective VLP-based HPV vaccine targeting the minor capsid protein,L2[J].Vaccine,2015,33(29):3346-3353.
[22]Tyler M,Tumban E,Dziduszko A,etal.Immunization with a consensus epitope from human papillomavirus L2 induces antibodies that are broadly neutralizing[J].Vaccine,2014,32(34):4267-4274.
[收稿2015-08-25修回2015-09-28]
(编辑倪鹏)
Study of a virus-like particle vaccine containing N-terminal epitopes of human papilloma virus L2 protein
JIANGRong,LIJun-Qiang,YANGMing-Ming,ZHUTao,YUXue-Feng,SHAOZhong-Qi.TianjinCanSinoBiotechnologyInc.
TianjinCorporateKeyLaboratoryofRespiratoryBacterialRecombinantandConjugateVaccine,Tianjin300457,China
[Abstract]Objective:To prepare a virus-like particle (VLP),containing Hepatitis B virus core antigen (HBcAg) and N-terminal peptides of the L2 protein of human papilloma virus (HPV),and investigate the immunogenicity of the VLP in mice and the protection against different strains of HPV.Methods: A fusion gene was synthesized to insert a DNA fragment,coding for the N-terminal epitopes of the L2 protein of HPV16,into the HBcAg coding sequence;HBc-L2 fusion protein was highly expressed in E.coli using the pET9a and BL21(DE3) expression system;the purified fusion protein was used to immunize BALB/c mice and antibody titers against the L2 epitopes in mouse sera were determined by indirect ELISA;the levels of neutralizing antibodies against both HPV16 and 18 were also analyzed.Results: HBc-L2 fusion protein was expressed in E.coli and purified,with the purity >80%,by ammonium sulfate precipitation and CL-4B gel filtration;analysis of the purified fusion protein,using size exclusion chromatography with multi-angle laser light scattering detection (SEC-MALS) and electron microscope,revealed that HBc-L2 was assembled into a stable VLP structure automatically following its expression;immunization of BALB/c mice with the purified VLPs resulted in high antibody titers in mouse sera against the L2 epitopes;furthermore,it was demonstrated that the sera from the immunized mice had neutralization activities against both HPV16 and HPV18.Conclusion: The immunogenicity of the L2 epitopes was highly enhanced by the construction of HBc-L2 fusion protein and the formation of the VLP structure;the fusion protein was also capable of inducing protections against different serotypes of HPV,therefore,it could be a potential HPV vaccine with a broad coverage and low production cost.
[Key words]Human papillomavirus;L2 peptide;Hepatitis B virus core antigen;Virus-like particles;Immunogenicity;Neutralization antibody
中图分类号R373.9R392-33
文献标志码A
文章编号1000-484X(2016)03-0366-06
作者简介:蒋蓉(1986年-),女,硕士,高级技术员,主要从事病原微生物免疫学方面研究,E-mail:rong.jiang@cansinotech.com。通讯作者及指导教师:邵忠琦(1962年-),男,博士,研发总监,主要从事疫苗研发方面研究,E-mail:zhongqi.shao@cansinotech.com。
doi:10.3969/j.issn.1000-484X.2016.03.016
