恒温PCR双通道荧光读数仪的系统设计
2016-04-14单秋霞李建杰杜与冲袁旭军
单秋霞,李建杰,吴 晓,杜与冲,袁旭军
(1.上海理工大学 光电信息与计算机工程学院,上海 200093;2.上海科源电子科技有限公司,上海 201101)
恒温PCR双通道荧光读数仪的系统设计
单秋霞1,李建杰1,吴晓2,杜与冲2,袁旭军2
(1.上海理工大学 光电信息与计算机工程学院,上海200093;2.上海科源电子科技有限公司,上海201101)
摘要针对传统PCR检测仪在检测速度和精度上存在的问题,文中设计了恒温PCR双通道荧光读数仪系统,系统采用实时荧光核酸恒温扩增检测技术(SAT),大幅提高了扩增反应时间。然而考虑到SAT技术仍无法避免假阴性,文中在此基础上提出了双通道的光学系统设计,在检测样品阴阳性的同时对阴性样品进行实时监控。结果表明,该系统最快可在30 min内完成检测,可有效指示假阴性现象的出现,并具有检测速度快、精确度高、且稳定性好等优点。
关键词PCR仪;恒温扩增;双通道荧光检测
System Design of Constant Temperature Dual-channel PCR Fluorescent Reader
SHAN Qiuxia1,LI Jianjie1,WU Xiao2,DU Yuchong2,YUAN Xujun2
(1.School of Optical-Electrical and Computer Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China;2.Shanghai Cohere Electronics Technology Co.,Ltd,Shanghai 201101,China)
AbstractA system of constant temperature dual-channel fluorescent reader is designed to improve the detection speed and accuracy of traditional ones.The system is based on the technology of real-time simultaneous amplification and testing (SAT),with which the time of amplification reaction can be greatly reduced.Since the technology of simultaneous amplification and testing still cannot avoid the false negative results,a dual-channel optical system is designed based on the technology to offer accurate detection of the characteristics of sample.Real-time monitoring of negative ones is also achieved.Experiments demonstrate that the system can indicate false negative results effectively within 30 minutes with high accuracy and good stability.
KeywordsPCR instrument;isothermal amplification;dual-channel fluorescence detection
聚合酶链反应(Polymerize Chain Reaction,PCR),是一种基于特定的DNA片段在体外进行快速扩增的方法,其是生物医学领域中的一次重大革命,使生物医学研究从宏观水平和细胞水平发展到分子水平,广泛应用于病原体测定、免疫分析、基因表达、多态性研究以及评价临床治疗效果等各个方面[1-3]。然而,PCR技术主要由高温变性(约95 ℃)、低温退火(通常50~60 ℃)和适温延伸(72 ℃)3个步骤反复的热循环构成。这给PCR仪的温控系统带来了一个难题,目前国内常规PCR仪还难以达到快速升温、快速降温的要求,导致基因扩增速度没有预计的时间快,一般需要5~6小时的反应时间,且控制温度的精确度较低,以至于扩增反应体系易受检测样品中DNA、肝素、血红蛋白、EDTA、脂质等污染因子的影响,降低了检测的稳定性和结果的精确性。
自从PCR技术应用以来,其他的核酸扩增技术,尤其是众多恒温扩增技术,已被陆续发明。恒温扩增检测技术的主要特点是扩增反应的全过程均在单一温度下进行,而不像常规PCR,需要经历几十个温度变化的循环过程,由此大幅缩短了检测时间。其中像NASBA(Nucleic Acid Sequence-Based Amplification)、SDA(Strand Displacement Amplification)以及TMA(Transcription Mediated Amplification)等恒温技术均已在特定的病原体检测上得到相应的应用,并显示出了良好的特性[4]。
本文提出了恒温PCR双通道荧光读数仪的系统设计,其采用了实时荧光核酸恒温扩增检测技术(Simultaneous Amplification and Testing,SAT)[5]。SAT技术是国内企业自主研发的专利技术,其是基于TMA恒温扩增技术发展起来的,相比于传统的PCR技术,其扩增产物是RNA,RNA容易降解,可大幅减少污染,降低了假阴性和假阳性的发生率;同时,SAT还具备恒温扩增技术的优点,并采用实时荧光检测技术,从而提高了检测结果的精确度。本文拓展了SAT技术的检测部分,自主设计了一套双通道荧光检测装置,不仅可实时监测基因扩增的情况,且通过双通道的检测,可有效指示假阴性现象的出现,满足了更高的精度需要。因此,本文所设计的恒温PCR双通道荧光读数仪的系统,在真正意义上实现了快速检测,并具有较高的稳定性和精确性,在病原体检测,血液病毒筛查,环境微生物检测等领域具有广泛的应用前景。
1SAT核酸恒温扩增原理
系统采用实时荧光核酸恒温扩增检测技术(Simultaneous Amplification and Testing,SAT),其是将新一代的核酸恒温扩增技术和实时荧光检测技术相结合的一种新型核酸检测技术。其检测原理是在42 ℃恒定温度下,首先通过M-MLV反转录酶产生靶标核酸(RNA)的一个双链DNA拷贝,然后利用T7 RNA多聚酶从该DNA拷贝上产生多个(100~1 000个)RNA拷贝。此外,每个RNA拷贝再从反转录开始进入下一个扩增循环。与此同时,带有特定荧光标记的荧光染料和这些RNA拷贝特异结合,产生对应波长的荧光。最后由光电倍增管来实时捕获荧光信号,实时反映扩增循环情况[6]。

表1 荧光染料的激发、发射波长
SAT技术的基因扩增效率较高,每一个循环可扩增100~1 000倍的模版,15~30 min即可将模板扩增109倍,比常规PCR法高出1 000倍。检测灵敏度也远高于其他核酸检测技术,并可大幅降低假阴性和假阳性的发生几率。在血液病毒筛查领域中,其灵敏度的优势显得尤为重要,同为恒温扩增技术的TMA技术在欧美已有良好的应用证明[7-8]。
2光学系统设计
系统设计了双通道检测光路进行同步检测,分别采用470 nm蓝光(FAM的激发波长)和525 nm绿光(HEX的激发波长)作为激发光源,具体光路如图1所示。激发光由发光二极管产生,经过470 nm 的滤光片滤光,再经过多层介质膜反射,最后对待测样品进行照射;同时,经过扩增反应产生的荧光通过多层介质膜透射,最后被光电倍增管探测。
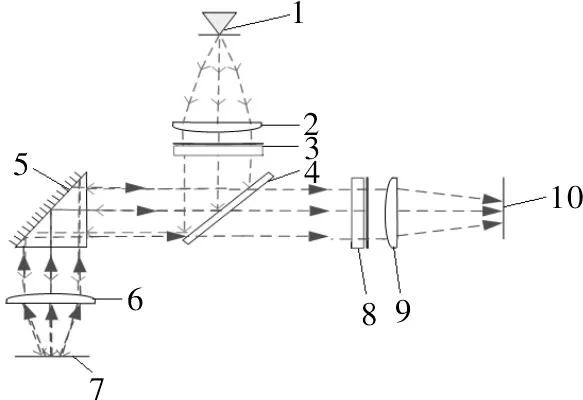
注:1.LED光源;2、6、9.光澜;3.470 nm滤光片;4.多层介质膜(反470 nm透520 nm);5.三角棱镜;7.待测物面;8.520 nm滤光片;10.接收器(520 nm)。图1 FAM通道测试光路设计
虽然FAM通道和HEX通道的光路设计相同,但其在系统上发挥着各自不同的作用。FAM通道的作用是为了检测样品中是否存在目的基因,若存在目的基因则FAM通道检测结果为阳性,否则为阴性。但由于采集的样品在反应过程中难免受到各种因素的影响,会检测出假阴性结果,故该模块添加了HEX通道。HEX通道的作用是对阴性样品进行实时监控,在PCR体系中加入扩增内标,通过HEX通道检测可有效指示假阴性现象的出现[9-10]。当FAM通道检测的样品为阴性时,若HEX通道的检测结果为阳性,则说明此样品是阴性;反之,该样品被指示为假阴性,有可能被污染,需要重新提取样品检测。所以,HEX通道可有效指示假阴性现象的出现,确保结果的准确性。
3系统硬件和软件设计
硬件部分以PIC32处理器作为主控芯片来控制光学模块、温度控制模块、电机模块和上位机4个模块的运行,其结构如图2所示。

图2 系统整体框图
电机模块采用了两个TMC260驱动芯片,一个以x轴方向控制样品孔位置,另一个以y轴方向控制光学模块位置,从光学模块发出两个入射光,依次对48个样品进行照射,一个循环大约需1 min。温度控制模块是本系统的重要部分,在该模块中的样品槽下面,放有一个48孔均匀的加热板与之对应,在其上方,设计了一个样品槽热盖,利用C8051单片机对加热板和热盖进行温度控制;同时,通过PT100来检测48个样品孔温度,将其与设置的温度做对比,利用P.I.D控制算法来达到精准控温的目的[11-12]。在光学模块中,发射光光强大小是由发光二极管的电流大小决定的,通过调节电位器的阻值对电流进行控制,从而调节发射光光强大小。发射光的周期和频率则通过调节PWM来控制;而发射出的荧光是通过光电倍增管进行探测,将探测到信号进行放大处理,最终传送给控制芯片。
软件设计包括人机交互模块、测温模块、电机驱动模块、光学模块及控制器的程序设计等。整体控制流程图,如图3所示。

图3 系统软件流程图
系统上电后,进行初始化,通过在触摸屏上入相关参数,主控板读取相应的控制指令,将读取到的数值存储至EEPROM,通过温度采集模块采集PT100上的电压差从而计算出当前温度值,并根据PID控制信号调节PWM脉宽调制信号的输出,最终将温度和时间实时显示在显示屏上。当温度到达设定值时,样品中的核酸片段开始进行特异性扩增,扩增片段与荧光染料结合。
扩增开始后主控板发出控制指令,驱动电机快速运转,带动光学模块到达规定的样品组下方。光学模块到达指定位置后,主控板发出指令,驱动光学模块激发470 nm的蓝光和523 nm的绿光,投射到样品中,由样品反射回525 nm和564 nm的荧光,由于有48组样品同时进行检测,因此电机驱动模块和光学检测模块进入循环程序。
光学模块将采集到的光谱输入到主控板,经主控板芯片处理,并通过串口通讯上传至上位机。由高性能安卓操作系统,利用实验软件实时绘制扩增曲线,并根据设置的阈值自动判断测量结果为阴性或阳性。
4样品检测及结果分析
为验证这种恒温PCR双通道荧光读数仪是否达到了设计要求,设计了以下验证实验。
以6个阴性样品与6个阳性样品为例进行扩增检测。首先向12个样品中添加适量的FAM、HEX荧光染料和扩增内标物,然后将该样品放入仪器的样品槽中进行检测(A5~F5号样品槽放的是阴性样品,A6~F6号样品槽放的是阳性样品),其中样品槽分为8行6列共48孔,可同时检测48个不同样品。实验时间设置为60 min,实验结果如图4所示。

图4 两个通道检测样品的荧光扩增曲线图
图4(a)和图4(b)为FAM通道检测样品的扩增曲线图,图4(c)为HEX通道检测阴性样品的扩增曲线图,HEX通道是用来验证FAM通道阴性样品的检测结果。实验现象表明,所有扩增曲线基本在30 min后达到了扩增的平台期,这说明该系统最快可在30 min内检测到结果。FAM通道阴性样品的扩增曲线没有扩增的迹象,而阳性样品全部有明显扩增,足以看出FAM通道已经准确检测出样品的阴阳特性。HEX通道阴性样品扩增曲线如图3所示,所有阴性样品的扩增曲线有明显扩增,说明这6个阴性样品均有效,确保了阴性样品检测的准确性。系统实验最终结果为:A5~F5位置的6个样品为阴性,A6~F6位置的6个样品为阳性。
5结束语
设计的恒温PCR双通道荧光读数仪以SAT恒温技术为原理,理论上减少了假阴性和假阳性结果的发生机率;同时通过采用独特的双通道光学设计和温控系统,最快可在30 min内完成整个检测,有效指示检测过程中出现的假阴性现象,提高系统的检测准确率。因此,本系统具有检测速度快,稳定性好、精确度高等优点,在病原体检测、血液病毒筛查、环境微生物检测等领域有着广泛的应用前景。
参考文献
[1]Yang J N,Liu Y J,Cory B.High sensitivity PCR assay inplastic micro reactors[J].Lab on a Chip,2002,2(4):179-187.
[2]Lee D S,Park S H,Yang H,et al.Bulk-micromachined submicroliter-volume PCR chip with very rapid thermal response and low power consumption[J].Lab on a Chip,2004(4):401-407.
[3]Watkins-Riedela T,Woegerbauerb M,Hollemanna D,et al.Rapid diagnosis of enterovirus infections by real-time PCR on the light cycler using the Taq man format[J].Diagnostic Microbiology and Infectious Disease,2002,42(2):99-105.
[4]Monis P T,Giglio S.Nucleic acid amplification-based techniques for pathogen detection and identification[J].Infection,Genetics and Evolution,2006,6(1):2-12.
[5]Hill C S.Molecular diagnostic testing for infectious diseases using TMA technology[J].Expert Review of Molecular Diagnostics,2001,1(4):445-455.
[6]Cui Z L,Wang Y Z,Fang L,et al.Novel real-time simultaneous amplification and testing method to accurately and rapidly detect mycobacterium tuberculosis complex[J].Journal of Clinical Microbiology,2012,50(3):646-650.
[7]高闪电,常惠芸,独军政,等.转录介导的扩增技术及其在诊断中的应用[J].中国生物工程杂志,2010,30(4):120-124.
[8]Wu H C,Shieh J,Wright D J,et al.DNA sequencing using rolling circle amplification and precision glass syringes in a high-through put liquid handling system[J].Biology Techniques,2003,34(1):204-207.
[9]杨晋,曾庆梅,张笛,等.添加扩增内标的沙门氏菌PCR检测方法[J].生物技术通报,2014(7):54-59.
[10]何晓华,史贤明.扩增内标及其在食源性致病菌PCR检测中的应用[J].微生物学报,2010,50(2):141-147.
[11]范振瑞.基于Matlab的PID温度控制系统设计[J].电子科技,2013,26(8):164-167.
[12]王冬,张新磊,冯继宏,等.基于PID算法的PCR仪温度控制系统设计方案[J].北京生物医学工程,2011,30(5):502-505.
欢 迎 刊 登 广 告
请访问:www.dianzikeji.orgE-mail:dzkj@mail.xidian.edu.cn
联系电话:029-88202440传真:029-88202440
中图分类号TH776
文献标识码A
文章编号1007-7820(2016)03-110-04
doi:10.16180/j.cnki.issn1007-7820.2016.03.028
作者简介:单秋霞(1990—),女,硕士研究生。研究方向:光学工程,生物电子。李建杰(1981—),男,博士,硕士生导师。研究方向:电磁场与微波技术。
基金项目:上海市高校青年教师培养资助计划基金项目(ZZslg15015)
收稿日期:2015- 07- 21
