千岛湖岛屿社鼠的扩散特征
2016-04-13张新玉鲍毅新王艳妮
张新玉, 王 华, 鲍毅新, 王艳妮, 叶 彬
浙江师范大学生态研究所, 金华 321004
千岛湖岛屿社鼠的扩散特征
张新玉, 王华, 鲍毅新*, 王艳妮, 叶彬
浙江师范大学生态研究所, 金华321004
摘要:2009年7月—11月,2010年3月—11月对千岛湖两个岛屿上的社鼠(Niviventer confucianus)种群进行标志重捕,通过分析扩散个体的性别、年龄及扩散距离等,探讨陆桥岛屿环境下社鼠的扩散特征。研究结果显示:岛屿环境下社鼠的扩散率为37.96%,不同季节社鼠的扩散率存在差异,社鼠倾向于在春季发生扩散,尤其是3月份,社鼠扩散个体数最多;对于整个捕获史而言,雌雄扩散个体数存在极显著的差异(2=12.542,df=1,P<0.001),雄性个体更倾向于发生扩散;而在繁殖高峰期,当怀孕鼠存在时,雄性扩散数亦大于雌性,两者存在显著差异(2=4.504,df=1,P=0.034)。扩散个体体重的季节差异不显著;扩散与社鼠的年龄密切相关,社鼠更加倾向于在亚成年阶段发生扩散;另外,家群大小对社鼠扩散个体数量也有显著影响,家群越大,扩散个体越多;对扩散距离进行分析发现存在显著的性别差异(t=-9.229,df=50,P<0.001),雌性个体的平均扩散距离为(282.97±16.14) m,显著大于雄性的(146.70±6.80) m,而扩散距离与年龄、体重、最大活动距离均无显著相关性。
关键词:社鼠;扩散;婚配制度;千岛湖岛屿
扩散是生物物种生活史中一个最基本的阶段或过程[1],是指生物通过某种方式在某个时间尺度从一个地点向另一地点的被动或主动的运动,并在后一地点可能繁殖后代[2]。扩散不仅有利于生物个体扩展其分布区,还避免了近交、种内竞争以及近缘个体之间的竞争[3]。但也面临着巨大的成本,如死亡率提高[4]、捕食风险增加和遭遇新的疾病的风险提高[5]等。在动物扩散过程中婚配制度与其扩散策略密切相关,在一夫多妻婚配制度中雌性往往表现为恋巢,雄性为寻找配偶资源更倾向于扩散即性别偏倚性扩散。在国内对开放生境或人为围栏条件下的布氏田鼠(Microtusbrandti)[6]、东方田鼠(Microtusfortis)[7]、达乌尔鼠兔(Ochtonadaurica)[8]等小型兽类的扩散研究较多,但是在岛屿环境下的扩散研究较少。
社鼠(Niviventerconfucianus)隶属哺乳纲(Mammalia)、啮齿目(Rodentia)、鼠科(Muridae)、白腹鼠属(Niviventer),为东洋界常见啮齿动物,主要栖息环境包括灌木草丛、荒坡、农田等。在我国除宁夏、新疆、黑龙江外其他各省均有分布[9]。以往对社鼠的种群年龄结构[10- 12],种群数量和最大活动距离[13- 14]、繁殖生态、巢区和领域[15- 16]等进行了相关研究,但对该鼠的扩散问题尚未涉及。本文选取天然围栏千岛湖岛屿的社鼠为研究对象,对其扩散的性别差异、季节差异、年龄差异和扩散距离等进行分析,旨在验证假设:(1)千岛湖岛屿环境下的社鼠的扩散表现出偏雄性。(2)社鼠的扩散存在季节差异性。(3)社鼠更倾向于在未成年阶段发生扩散。(4)社鼠的扩散距离与社鼠性别、体重、年龄及最大活动距离存在一定的相关性。
1研究地区概况及研究方法
1.1研究地区概况
研究样地位于浙江省淳安县千岛湖境内,是因修建新安江水库而形成的人工湖泊,面积为2500 m2以上的岛屿有1078个,是典型的陆桥岛屿化生境。研究样地选取桐子坞乡范围内的A岛(29°33′27.37″N,118°52′51.55″E)和B岛(29°33′56.96″N,118°53′30.43″E),面积分别为55400 m2和58000 m2。两岛屿上植被均由阔叶林、针叶林及灌木等组成[17- 18]。
1.2野外种群标志重捕
2009年7—11月及2010年3—11月进行了社鼠的标志重捕[13],使用捕鼠笼(24 cm×12 cm×12 cm)分别对A岛、B岛的社鼠个体进行标志重捕。每月标志重捕10 d,以足够量的红枣为饵料,当日下午将捕鼠笼按桩号放置,次日上午检查捕获状况。对首次捕获的社鼠个体采用改进的切趾法(Toe-clipping)进行标记并编号[19],作为鉴别每只社鼠个体的身份依据。将切趾肌肉样本保存于无水乙醇,用于遗传分析。同时记录捕获位置桩号、捕获日期、社鼠切趾编号、性别、体重(精确到0.1 g)、雄鼠睾丸是否下降、雌鼠是否怀孕(检查阴道开闭状况、有无分泌物及乳头特征)和其他形态特征(如体长、尾长、后足长以及受伤、体毛脱落等,可作为个体身份鉴别的辅助依据)[13, 17, 20]。根据社鼠的睾丸下降和怀孕等繁殖特征,判断社鼠的繁殖状况。
在A岛共捕获96只社鼠,其中在多个捕获期被捕获的有73只,已确定亲缘关系的有71只,共分为12个家群;在B岛共捕获81只社鼠,多个捕获期被捕获的有64只,已确定亲缘关系的有49只,共分为11个家群[19]。
1.3季节和年龄组划分
根据千岛湖地区气候特点,将每年的3—5 月划分为春季,6—8 月划分为夏季,9—11 月划分为秋季。将每月捕获的社鼠个体按体重划为幼年组、亚成年组、成年组和老年组[10],其中体重≤35.0 g为幼年组,35.0 g<体重≤50.0 g为亚成年组、50.0 g<体重≤80.0 g为成年组,体重>80.0 g为老年组[10- 11],参考后足长为第二指标进行纠正。
1.4数据处理及统计分析
扩散个体确定:当一个个体离开自己家群的巢区范围,扩散到其它家群或在新地域建立自己的巢区,并在新的栖息地定居(在新栖息地连续2个或2个以上捕获期捕获)时,将其定义为扩散个体;根据所确定的亲缘关系,若亲本已确定为未扩散个体,而子代在重捕时未观察到扩散行为,但在远离母本的新栖息地连续2个或2个以上捕获期被捕获时,也将其定义为扩散个体。
各季节扩散个体的确定:当某个体在新栖息地首次捕获时,则作为该季节的扩散个体,在下一季节该个体不作为扩散个体而作为定居个体。
扩散距离的确定:为扩散个体新巢区中心与原巢区中心之间的距离,并运用Biotas 2.0[21]中的标尺进行计算测量。由于所选岛屿形状无规则并呈突出的半岛状,某些个体活动时会绕过半岛水湾,因此岛屿内连续区域(新巢区中心与原巢区中心之间无水湾隔离),扩散距离为两个巢区中心的直线距离;非连续区域(新巢区中心与原巢区中心之间有水湾隔离),扩散距离按折线距离[14]计算。
家群大小的确定:将在一个世代周期内,同一母本所产后代与其两亲本一并视为一个家群(family group)[22],家群大小按扩散前家群内个体数计算。
扩散的性别差异:整个捕获史中雄性扩散个体数与雌性扩散个体数的差异。扩散的季节差异分析:扩散个体为发生在该季节扩散的个体,未扩散的个体为该季节中未发生扩散的个体;按月份进行作图时,扩散个体数为在该月发生扩散的个体数。扩散的年龄差异:划分为幼年、亚成年、成年3个年龄阶段,由于老年个体发生扩散极少,差异分析时将其划为成年。发生扩散的个体为社鼠在该年龄阶段发生扩散的个体,未发生扩散的个体为整个捕获史中经历过该年龄阶段而未发生扩散的社鼠。按月份进行作图时,扩散个体比率为该月捕获不同年龄阶段发生扩散的个体数与该月捕获不同年龄阶段的个体数的比值。
采用SPSS 21.0数据分析软件[23]对数据进行统计分析。其中扩散的性别差异,季节差异,年龄差异采用卡方检验进行分析。扩散个体体重的季节差异以及扩散距离与年龄组的差异采用单因素方差分析。两岛相同季节扩散个体的平均体重的差异以及扩散距离与性别的关系采用独立样本T检验分析。相关性分析均采用线性回归分析;利用 Kolmogorov-Smirnov检验数据是否符合正态分布,若不符合,则对数据进行自然对数转换进而使用独立样本T检验或单因素方差分析,若仍不符合方差分析条件,则使用 Mann-Whitney U test 进行非参数检验。显著和极显著水平分别为P≤0.05和P≤0.01。用Origin 9.0[24]进行作图。
2结果2.1扩散个体的数量和性别差异
在A、B两岛共有多个捕获期的社鼠137只,其中扩散个体为52只,扩散率为37.96%。其中A岛为73只(♂40只,♀33只),扩散个体为32只,扩散率为43.84%;B岛为64只(♂31,♀33),扩散个体为20只,扩散率为31.25%。
A岛扩散的雄鼠占扩散个体数的71.88%(23/32),雌鼠占28.12%(9/32),雌雄扩散个体数存在极显著差异(2=6.711,df=1,P=0.01);B岛扩散的雄鼠占70.00%(14/20),雌鼠占30.00%(6/20),亦存在显著差异(2=5.416,df=1,P=0.02)。将A、B岛合并经卡方检验雌雄扩散个体数存在极显著的差异(2=12.542,df=1,P<0.001)。
2.2扩散的季节差异
A,B两岛屿的数据合并统计分析,春季捕获90只,其中扩散个体38只;夏季捕获68只,扩散个体9只;秋季捕获37只,扩散个体5只。不同季节之间存在极显著差异(2=20.683,df=2,P<0.001),其中春季与夏季(2=15.574,df=1,P=0.001)和春季与秋季之间(2=9.650,df=1,P=0.002) 存在极显著差异,而夏季和秋季之间不存在差异(2=0.002,df=1,P=0.968)。
在A 岛,春季捕获52只,其中扩散个体23只;夏季捕获43只,扩散个体6只;秋季捕获23只,扩散个体3只。不同季节的扩散个体数之间存在极显著差异(2=13.780,df=2,P=0.001),其中春夏两季(2=10.174,df=1,P=0.001)和春秋两季之间(2=6.848,df=1,P=0.009)均存在极显著差异,而夏秋两季之间无显著差异(2=0.011,df=1,P=0.918)。
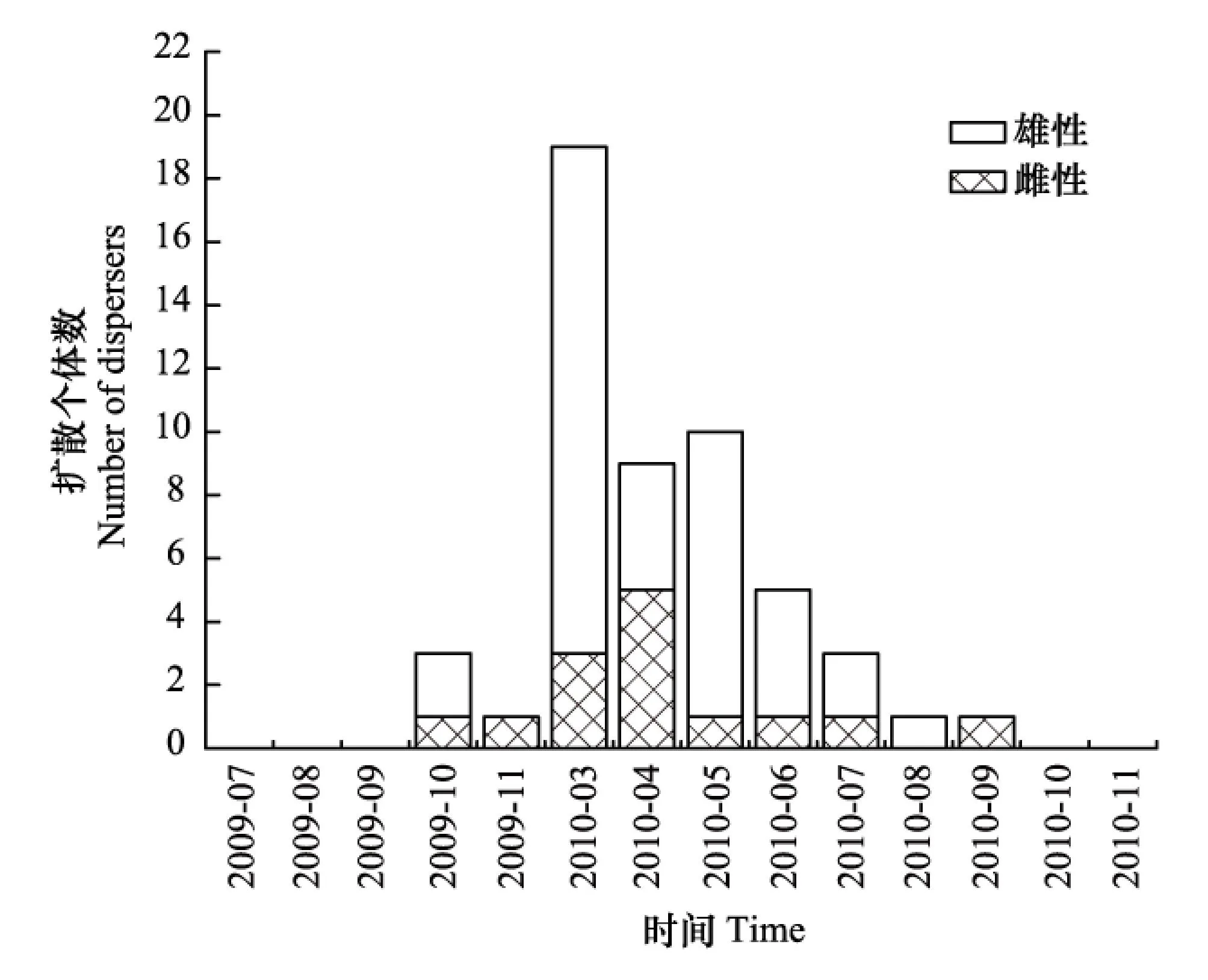
图1 扩散个体数的季节变化Fig.1 Seasonal variation in number of dispersers
在B岛,春季捕获38只,扩散个体15只;夏季捕获25只,扩散个体3只;秋季捕获14只,扩散个体2只。不同季节间存在差异(2=7.135,df=2,P=0.028),其中春夏两季存在极显著差异(2=5.557,df=1,P=0.018),春秋两季(2=2.950,df=1,P=0.086)和夏秋两季之间(2=0.042,df=1,P=0.838)均无显著差异。
分析结果可见,社鼠倾向于在春季发生扩散。将A,B两岛扩散数据合并后作图,其中横坐标为捕鼠月份,纵坐标为扩散个体数。由图可知,尤其是3月份,社鼠扩散个体数最多(图1)。
2.3扩散个体体重的季节差异
A岛春、夏、秋3个季节扩散个体的平均体重分别为(44.24±2.04) g、(39.10±5.97) g和(41.90±6.26) g,单因素方差分析表明不同季节之间扩散个体的平均体重无显著差异(F2,29=0.557,P=0.579),两两比较结果表明春夏季(P=0.308)、春秋季(P=0.726)和夏秋季之间(P=0.717)均无显著差异。B岛不同季节扩散个体的平均体重分别为(44.11±1.55) g、(47.65±3.02) g和(77.37±0.86) g,单因素方差分析表明季节之间扩散个体的平均体重存在差异(F2,17=5.226,P=0.017),两两比较结果表明春夏两季之间不存在显著差异(P=0.294),而在春秋两季(P=0.006)和夏秋两季之间(P=0.008)存在极显著差异。
对A、B两岛相同季节扩散个体的平均体重进行独立样本t检验,结果显示两岛之间春季(t=-0.584,df=36,P=0.563)、夏季(t=1.097,df=7,P=0.309)扩散个体的平均体重均无显著差异,而在秋季有极显著差异(t=-25.4,df=3,P<0.001)。秋季的体重差异可能受到A、B岛扩散个体样本数偏少的影响。
2.4扩散个体的年龄差异
将A,B两岛屿的数据合并进行统计分析,历经幼年阶段的共有75只,其中扩散个体14只(♂9,♀5);历经亚成年阶段有97只,扩散个体30只(♂21,♀9);历经成年阶段有107只,其中扩散个体8只(成年♂7,老年♂1)。不同年龄阶段之间存在极显著差异(2=18.452,df=2,P<0.001),其中幼年与亚成年之间无差异(2=3.340,df=1,P=0.068),幼年与成年之间(2=5.196,df=1,P=0.023)具显著差异,而亚成年和成年阶段之间存在极显著差异(2=18.460,df=1,P<0.001)。
A岛捕获的个体中历经幼年阶段共有36只,其中扩散个体7只(♂5,♀2);历经亚成年阶段有51只,扩散个体20只(♂13,♀7);历经成年阶段有55只,其中扩散个体5只(♂5)。不同年龄阶段的扩散个体存在极显著差异(2=14.020,df=2,P=0.001),其中幼年和亚成年之间有显著差异(2=3.854,df=1,P=0.050),幼年和成年无显著差异(2=2.037,df=1,P=0.153),亚成年和成年有极显著差异(2=13.325,df=1,P<0.001)。
B岛历经幼年有39只,扩散个体7只(♂4,♀3);历经亚成年有46只,扩散个体10只(♂8,♀2);历经成年和老年52只,扩散个体3只(成年♂2,老年♂1)。不同年龄阶段之间无差异(2=5.484,df=2,P=0.064),其中幼年与亚成年(2=0.190,df=1,P=0.663)和幼年与成年之间(2=3.380,df=1,P=0.066)无显著差异,而亚成年和成年阶段之间存在显著差异(2=5.410,df=1,P=0.020)。
分析结果显示,社鼠更加倾向于在未成年阶段发生扩散,尤其是亚成年阶段。将A,B两岛合并后作图(图 2)。由此可知,在大部分发生扩散的月份中亚成年个体扩散的比率要高于其他年龄阶段的社鼠。

图2 扩散个体的年龄差异Fig.2 Age variation in dispersers
2.5怀孕鼠的存在对扩散的影响
A岛共记录10只雌鼠具明显的怀孕特征,其中6只怀孕发生在4—5月,1只发生在7月,3只发生在9—10月。B岛共记录了5只怀孕鼠,其中3只怀孕发生在4—5月,2只发生在9—10月。
2.5.1怀孕鼠的存在对整个捕获史扩散的影响
A岛的33只雌鼠中,捕获史历经怀孕阶段的个体10只。其中3只为扩散个体,怀孕时已经完成定居,7只为未扩散个体。排除怀孕雌鼠后对A岛扩散雌雄个体数进行卡方检验,结果发现A岛雌雄个体扩散数存在显著差异(2=5.801,df=1,P=0.016)。B岛的33只雌鼠中,捕获史历经怀孕阶段的个体5只。其中1只为扩散个体,怀孕时已经完成定居,4只为未扩散个体。排除怀孕雌鼠后对B岛扩散雌雄个体数进行卡方检验,结果发现B岛雌雄个体扩散数存在显著差异(2=5.024,df=1,P=0.025)。A,B两岛数据合并后,发现雌雄扩散个体数存在极显著差异(2=11.603,df=1,P=0.001)。
2.5.2怀孕鼠的存在对繁殖高峰期扩散的影响
A岛4—5月份扩散13只(♂9,♀4),捕获44只(♂21,♀23),其中怀孕鼠6只。B岛扩散6只(♂4,♀2),捕获32只(♂15,♀17),其中怀孕鼠3只。由于A,B两岛4—5月份扩散雌鼠均未达到统计要求,故将A,B两岛数据进行合并统计分析。结果显示,怀孕鼠存在时,雄性扩散数大于雌性,两者存在显著差异(2=4.504,df=1,P=0.034),去除怀孕鼠后,雌雄社鼠的扩散个体数并不显著(2=2.302,df=1,P=0.129)。
2.6雄性亚成年时期个体性成熟对扩散的影响
A岛13只雄性亚成年扩散个体中,睾丸下垂的个体5只,未下垂的8只。未发生扩散的14只亚成年雄性个体中,睾丸下垂的2只,未下垂的12只。在扩散比例上,性成熟的个体(71.4%)明显高于未成熟的个体(40%)。B岛8只雄性亚成年扩散个体中,睾丸下垂的1只,未下垂的7只。未发生扩散的17只雄性个体中,睾丸下垂1只,未下垂16只。在扩散比例上,性成熟个体(50%)明显高于未下垂个体(30.4%)。虽然数据达不到统计分析要求,但从比例上看雄性亚成年时期性成熟的个体更趋向于发生扩散。
2.7家群大小对扩散的影响
对A岛的12个家群和B岛的11个家群进行分析,结果表明家群大小与扩散的个体数呈极显著的正相关性(A岛:R2=0.847,F1,10=55.542,P<0.001;B岛:R2=0.775,F1,9=31.032,P<0.001), 回归方程分别为,A岛y=0.456x-0.982,B岛为y=0.395x-0.621, 其中y代表扩散个体数,x代表家群大小(图3)。

图3 社鼠家群大小与扩散个体数的相关性Fig.3 Correlations between group size of Niviventer confucianus and number of total dispersers
2.8扩散距离2.8.1扩散距离与性别的关系
对A岛32个及B岛20个扩散个体计算扩散距离,结果表明,A岛扩散个体的平均扩散距离为 (184.23±14.39) m,其中雄性为(141.37±5.67) m,雌性为(293.75±23.23) m,雌雄个体之间的扩散距离存在极显著差异(t=-9.04,df=30,P<0.001)。B岛扩散个体的平均扩散距离为(188.87±16.93) m,其中雄性为(155.47±15.48) m,雌性为(266.81±21.03) m,雌雄个体间存在极显著的差异(t=-4.060,df=18,P<0.001)。分别对A、B两岛的雄鼠与雄鼠、雌鼠与雌鼠的扩散距离进行独立样本t检验,A、B两岛的雄鼠之间(t=1.006,df=35,P=0.322)和雌鼠之间(t=-0.807,df=13,P=0.434)的扩散距离均无显著差异。
将A、B两岛数据合并后分析,雌性个体的平均扩散距离为(282.97±16.14) m,雄性为(146.70±6.80) m,独立样本t检验表明雌雄个体间存在极显著差异(t=-9.229,df=50,P<0.001)。
2.8.2扩散距离与年龄组的关系
A岛幼年组的平均扩散距离为(170.82±32.20) m,亚成年组为(193.60±20.17) m,成年组为(165.50±11.07) m,单因素方差分析结果显示不同年龄组之间的扩散距离不存在显著差异(F2,29=0.345,P=0.711)。B岛幼年组的平均扩散距离为(212.80±30.22) m,亚成年组为(175.97±23.81) m,成年组为(187.70±79.16) m,老年组为152.63 m,不同年龄组之间的扩散距离亦无显著差异(F3,16=0.366,P=0.779)。结果表明扩散距离与个体年龄无关。
2.8.3扩散距离与体重的关系
A岛扩散个体发生扩散时平均体重为(42.93±1.87) g,B岛为(47.30±4.24) g。将A、B两岛扩散个体的扩散期体重和扩散距离进行对数处理后再进行相关性分析,结果显示两者相关性不显著(A岛:R2=0.003,F1,30=0.082,P=0.776;B岛:R2=0.005,F1,18=0.089,P=0.769)。
2.8.4扩散距离与最大活动距离的关系
A岛扩散个体的平均最大活动距离为(118.55±10.77) m,B岛为(84.31±9.13) m。统计分析表明,扩散个体的扩散距离与其最大活动距离相关性不显著(A岛:R2=0.005,F1,30=0.134,P=0.708;B岛:R2=0.014,F1,18=0.253,P=0.621)。
3讨论
3.1扩散个体的数量及性别差异
自然界中动物扩散的方式和原因较为复杂,种群密度[25]、食物[26]、栖息地质量[27]和生殖收益[28]等因素都会影响个体的扩散方式。发生扩散的个体数量与可利用的资源成反比,与种群内的压力成正比。若能够利用的食物及空间资源越少,则种群内个体间的竞争压力越大,个体为了寻找更适合的生存领域,更倾向于发生扩散。对于岛屿而言,由于其与陆地交流基本隔绝,啮齿类动物很难跨越水域障碍扩散到其他岛屿。对于岛屿上的优势种社鼠来说,可利用的食物和空间资源量有限,导致了其种群内个体间的竞争压力远大于陆地种群。本研究发现岛屿生境中社鼠的扩散率远高于陆地的长爪沙鼠(Merionesunguiculatus)[29]和东方田鼠[7]。
有研究表明不同家群间的扩散存在性别差异[30- 31]。如野外自然条件下小家鼠(Musmusculus)扩散的研究表明雌性比雄性更容易加入到其它群体中,虽然冒着环境资源的丢失或死亡的危险,但在到达一个新地方,可以获得更多的繁殖机会[32]。资源竞争(resource competition hypothesis)和避免近交假设(inbreeding avoidance hypothesis)认为,由于雌雄个体竞争的关键性资源不同,不同性别扩散个体具有不同的风险与收益[33]。对53个根田鼠(Microtusoeconomus)家群的研究发现,雄性个体为避免近亲繁殖,长距离扩散的个体多体现为雄性偏倚性扩散[34]。哺乳动物社群中,雌体竞争的主要资源是食物和空间,并具有较强的领域行为,而雄体竞争的主要资源是配偶。因此,雌体从恋巢行为中,较雄体能获取更多的利益,而雄体通过扩散以避免近交繁殖[33]。本研究中社鼠的扩散从整个捕获史而言表现出偏雄性扩散。雄鼠可能为了避免近亲繁殖或获得更多的繁殖机会而进行扩散,该点有待于进行进一步的遗传学验证。然而在繁殖高峰期扩散显然受到怀孕雌鼠的影响。这种影响可能会导致两种结果,一是怀孕鼠的存在可能导致了其他社鼠,尤其是雌性社鼠的扩散,因为4月份雌性社鼠的扩散个体数明显高于其他各月(图 2)。二是由于雌性社鼠的怀孕,导致雌性社鼠的扩散率降低,因为研究中并没有发现社鼠在怀孕时发生扩散的现象。
3.2扩散发生的季节及年龄差异
扩散发生的季节不仅与种群的数量动态以及种群的结构特征密切相关,而且与该季节领域内的资源的丰富度等有关。研究长爪沙鼠的扩散行为时发现,扩散的季节性变化与其生活史特征密切相关,在繁殖期的扩散行为主要与繁殖活动有关,在贮食期越冬鼠扩散者可能是由于在家群中没有繁殖机会而主动扩散[29]。野生小家鼠为获得充足的食物资源其扩散情况也随季节变化而不同[32]。已有研究表明千岛湖岛屿环境下社鼠的繁殖高峰期为春季4—5月和秋季9—10月,且秋季繁殖在11月份基本结束[16]。本次研究发现扩散主要发生在春季,且3月份达到最高值,随后逐渐下降。社鼠的扩散与种群的繁殖行为以及繁殖后种群数量增加有关,繁殖高峰前期亲代或子代为了寻找配偶,避免近亲繁殖,因此部分个体更倾向于发生扩散,扩散个体数也达到峰值。Begon 和 Motro 等[35- 38]认为, 近亲繁殖导致动物后代发生近交衰退、后代畸形率和死亡率上升等不利的结果,是一些物种的亚成体发生扩散的选择压力。本研究中A岛亚成年阶段个体的扩散与其他年龄阶段存在极显著差异,B岛亚成年阶段虽然与幼年阶段在统计上没有显著差异,但扩散数量上高于幼年个体。同时A、B(除秋季)两岛各个季节发生扩散的个体的平均体重均为45 g左右,说明扩散个体也倾向于在亚成年阶段发生扩散。幼年个体由于其活动能力有限,只有少部分会发生扩散;成年个体因其处于群体中的优势地位,对资源及配偶的竞争具有一定的优势;而亚成年个体则迫于资源和生殖压力,更倾向于发生扩散。
3.3家群大小对扩散的影响
对长爪沙鼠的研究表明,扩散前家群大小对家群中扩散个体数量有一定影响,扩散前集群数量大的家群,扩散个体数较多,反之则越少[29]。本研究中,岛屿社鼠的家群大小与扩散的个体数之间也呈极显著正相关性(图3)。家群越大对资源的竞争就越激烈,家群的大小一定程度上体现了配偶资源竞争压力的大小,说明种群内的配偶资源的竞争压力可能是导致种群内个体发生扩散的原因之一。
3.4扩散距离

参考文献(References):
[1] Walters J R. Dispersal behavior: an ornithological frontier. The Condor, 2000, 102(3): 479- 481.
[2]Howard W E. Innate and environmental dispersal of individual vertebrates.The American Midland Naturalist, 1960, 63(1): 152- 161.
[3]Clobert J, Danchin E, Dhondt A A, Nichols J D. Dispersal.Oxford: Oxford University Press, 2001.
[4]Johnson M L, Gaines M S. Evolution of dispersal: theoretical models and empirical tests using birds and mammals. Annual Review of Ecology and Systematics, 1990, 21: 449- 480.
[5]肖治术, 张知彬. 小议生物扩散. 生物学通报, 2006, 41(7): 27- 28.
[6]胡晓鹏. 布氏田鼠扩散研究[D]. 北京: 中国农业大学, 2005.
[7]杨月伟, 刘季科, 刘震. 东方田鼠种群扩散及活动对外部因子的反应格局. 生态学报, 2005, 25(6): 1523- 1528.
[8]王梦军, 钟文勤, 宛新荣, 王广和. 达乌尔鼠兔扩散过程中的生境选择. 动物学报, 1998, 44(4): 398- 405.
[9]鲍毅新. 社鼠的研究概要. 浙江师范大学学报: 自然科学版, 1993, 16(2): 50- 54.
[10]鲍毅新, 诸葛阳. 社鼠的年龄鉴定与种群年龄组成. 兽类学报, 1984, 4(2): 127- 137.
[11]张洁. 社鼠种群生态研究. 兽类学报, 1993, 13(3): 198- 204.
[12]王淯, 胡锦矗, 谌利民. 社鼠种群年龄结构的回归分析. 四川动物, 2003, 22(3): 159- 162.
[13]张旭, 鲍毅新, 刘军, 林杰君, 沈良良, 王艳妮. 陆桥岛屿环境下社鼠种群数量的估算方法. 生态学报, 2012, 32(5): 1562- 1569.
[14]叶彬, 沈良良, 鲍毅新, 张旭. 年龄、性别及季节因素对千岛湖岛屿社鼠最大活动距离的影响. 生态学报, 2013, 33(11): 3311- 3317.
[15]张美文, 黄璜, 王勇, 李波. 洞庭湖区社鼠的繁殖生态. 生态学报, 2006, 26(3): 884- 894.
[16]孙波, 鲍毅新, 张龙龙, 赵庆洋. 千岛湖秋季社鼠种群年龄结构及繁殖状况初探. 兽类学报, 2009, 29(3): 269- 276.
[17]沈良良, 鲍毅新, 张旭, 魏德重, 刘军. 千岛湖社鼠巢区面积的季节变化与性别差异. 浙江师范大学学报: 自然科学版, 2011, 34(3): 328- 332.
[18]沈良良. 千岛湖岛屿社鼠的巢区和领域研究[D]. 金华: 浙江师范大学, 2011.
[19]Wan X R, Zhong W Q. A revised convenient toe-clipping system for rodent species. Chinese Journal of Zoology, 2000, 35(4): 22- 24.
[20]Wang Y N, Liu W, Wang G M, Wan X R, Zhong W Q. Home range sizes of social groups of Mongolian gerbilsMerionesunguiculatus. Journal of Arid Environments, 2011, 75(2): 132- 137.
[21]Vaughan C, Ramírez O, Herrera G, Guries R. Spatial ecology and conservation of two sloth species in a cacao landscape inLimón, Costa Rica. Biodiversity and Conservation, 2007, 16(8): 2293- 2310.
[22]叶彬. 千岛湖岛屿社鼠的亲权鉴定和家群分析[D]. 金华: 浙江师范大学, 2013.
[23]Statistics I B M S. IBM SPSS Statistics 21. 0 for Windows.Chicago: IBM, 2012.
[24]May R A, Stevenson K J. Software review of Origin 8. 0. Journal of the American Chemical Society, 2009, 131(2): 872- 872.
[25]Ergon T, Ergon R, Begon M, Telfer S, Lambin X. Delayed density-dependent onset of spring reproduction in a fluctuating population of field voles. Oikos, 2011, 120(6): 934- 940.
[26]周建伟, 花立民, 左松涛, 苏军虎, 王巧玲. 高原鼢鼠栖息地的选择. 草业科学, 2013, 30(4): 647- 653.
[27]Haughland D L, Larsen K W. Exploration correlates with settlement: red squirrel dispersal in contrasting habitats. Journal of Animal Ecology, 2004, 73(6): 1024- 1034.
[28]Sterck E H M, Willems E P, Van Hooff J A R A M, Wich S A. Female dispersal, inbreeding avoidance and mate choice in Thomas langurs (Presbytisthomasi). Behaviour, 2005, 142(7): 845- 868.
[29]王艳妮. 长爪沙鼠巢区及扩散模式的研究[D]. 北京: 中国科学院动物研究所, 2008.
[30]Bowler D E, Benton T G. Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics. Biological Reviews, 2005, 80(2): 205- 225.
[31]Pasch B, Koprowski J L. Sex differences in space use of Chiricahua fox squirrels. Journal of Mammalogy, 2006, 87(2): 380- 386.
[32]Pocock M J O, Hauffe H C, Searle J B. Dispersal in house mice. Biological Journal of the Linnean Society, 2005, 84(3): 565- 583.
[33]Perrin N, Mazalov V. Dispersal and inbreeding avoidance. The American Naturalist, 1999, 154(3): 282- 292.
[34]Gundersen G, Andreassen H P. Causes and consequences of natal dispersal in root voles,Microtusoeconomus. Animal Behaviour, 1998, 56(6): 1355- 1366.
[35]Bélichon S, Clobert J, Massot M. Are there differences in fitness components between philopatric and dispersing individuals? ActaOecologica, 1996, 17(6): 503- 517.
[36]Motro U. Avoiding inbreeding and sibling competition: the evolution of sexual dimorphism for dispersal. The American Naturalist, 1991, 137(1): 108- 115.
[37]Arcese P. Intrasexual competition, mating system and natal dispersal in song sparrows. Animal Behaviour, 1989, 38(6): 958- 979.
[38]Wolff J O. Why are female small mammals territorial? Oikos, 1993, 68(2): 364- 370.
[39]Sutherland G D, Harestad A S, Price K, Lertzman K P. Scaling of natal dispersal distances in terrestrial birds and mammals. Conservation Ecology, 2000, 4(1): 16- 16.
[40]Saitoh T. Sexual differences in natal dispersal and philopatry of the grey-sided vole. Researches on Population Ecology, 1995, 37(1): 49- 57.
[41]陈越华. 布氏田鼠婚配制度的研究进展. 生物学通报, 2004, 39(8): 7- 9.
[42]张建军, 张知彬. 动物的婚配制度. 动物学杂志, 2003, 38(2): 84- 89.
Dispersal characteristics of populations of Chinese white-bellied rats (Niviventerconfucianus) in the Thousand Island Lake region
ZHANG Xinyu, WANG Hua, BAO Yixin*, WANG Yanni, YE Bin
InstituteofEcology,ZhejiangNormalUniversity,Jinhua321004,China
Abstract:We trapped two populations of Niviventer confucianus in the Thousand Island Lake region using the capture-mark-recapture (CMR) method from July to November 2009 and from March to September 2010, and explored the dispersal characteristics of the N. confucianus populations. The Biotas 2.0 software was used to calculate the dispersal distance. The 2 test was used to analyze the effects of sex, season, and age on the number of dispersers. One-way analysis of variance (ANOVA) was used to analyze the seasonal differences in body weight of the dispersers and the effects of age on the dispersal distance. The t test for independent samples was used to analyze the body weight differences between dispersers on two islands in the same season and the effect of sex on the dispersal distance. Linear regression analysis was used for correlation analysis. Our results showed that the dispersal ratio of N. confucianus was 37.96%, which is much higher than that of the Meriones unguiculatus and Microtus fortis that lived in the mainland. We considered the possibility that food and space limitations on the islands may lead to a dispersal ratio that is higher than that of mainland populations. The dispersal ratio showed significant differences among seasons, and the dispersal peak occurred in the spring, especially in March. Other studies showed that the peak breeding of N. confucianus occurs in April and May. We believe that the breeding behavior was fully active in the spring, contributing to the larger population size, and the breeding pressure led to the dispersal of some individuals. Sex-biased dispersal was detected, and the males were more likely to disperse (2= 12.542,df = 1,P < 0.001). We assumed that more males dispersed in order to avoid inbreeding or to get more breeding opportunities, but this notion still needs genetic verification. A significant difference was found in the breeding period (2= 4.504,df = 1,P = 0.034) when the pregnant rats were counted, which means that the pregnant females affected the dispersal model during the breeding period. Compared to the immature males at the subadult stage, sexually mature males were likely to disperse. The body weight showed no significant difference between the two sexes. The number of dispersers was related to their age, and more dispersers were found in the subadult group than in the other groups. The juvenile group was limited by their capacity for activity, and the adult group had enough food and spousal resources for their dominant positions in the population, but the subadult group exerted stronger pressure on food resources and reproductive opportunities. There was a significantly positive correlation between the number of dispersers and the size of social groups: the larger social group contained more dispersers. Social-group size reflected the level of competitive pressure on spouse resources, which meant that the social pressure may be the reason for dispersal of N. confucianus. The dispersal distance showed a highly significant difference between males and females: the dispersal distance of females ((282.97±16.14) m) was greater than that of males ((146.70±6.80) m). This phenomenon may be caused by the promiscuity system of N. confucianus or avoidance of inbreeding. Female offspring tended to disperse farther away from the maternal nest to claim a new territory in order to avoid resource competition, while reducing the inbreeding probability. The dispersal distance showed no significant relation with age, body weight, and the maximum movement distance.
Key Words:Niviventer confucianus; dispersal; mating system; thousand Island Lake
基金项目:浙江省自然科学基金(Y507080); 国家自然科学基金项目(31200323); 浙江省自然科学青年基金(LQ12C04001)
收稿日期:2014- 07- 06; 网络出版日期:2015- 07- 22
DOI:10.5846/stxb201407061386
*通讯作者Corresponding author.E-mail: sky90@zjnu.cn
张新玉, 王华, 鲍毅新, 王艳妮, 叶彬.千岛湖岛屿社鼠的扩散特征.生态学报,2016,36(5):1312- 1320.
Zhang X Y, Wang H, Bao Y X, Wang Y N, Ye B.Dispersal characteristics of populations of Chinese white-bellied rats (Niviventerconfucianus) in the Thousand Island Lake region.Acta Ecologica Sinica,2016,36(5):1312- 1320.
