餐饮肉制品中沙门氏菌检测的方法研究
2016-04-12周春红李羽翡2
周春红李羽翡2
(1.甘肃省产品质量监督检验中心 2.甘肃省食品检验研究院)
餐饮肉制品中沙门氏菌检测的方法研究
周春红1李羽翡2
(1.甘肃省产品质量监督检验中心 2.甘肃省食品检验研究院)
采用GB 4789.4-2010、SN0170-1992、ISO6579-2002 、VIDAS、VITEK、API20E六种方法对20个餐饮现做肉制品中沙门氏菌进行检测,其结果: 6种方法均检出沙门氏菌,但检出率略有差别。相比较沙门氏菌在XLD 和BS培养基上生长较好,且BS培养基的选择性高于其他培养基。API 20E在检测步骤、时耗、效率上优于三种标准方法,其与VITEK的检测结果较为详细。VIDAS在增菌后不需要分离纯菌,只需50min 即可出结果,但阳性结果并不是最终结果,需结合其他检验方法确证。
沙门氏菌 方法 比较
前言
沙门氏菌是一类杆状、不产芽孢、兼性厌氧的肠杆菌科革兰阴性菌,大多可运动、在自然界分布广泛,通过寄生于动物粪便及肠道内容物来传播,污染食品[1]。生鲜肉、蛋、乳制品最易受沙门氏菌污染。沙门氏菌病是导致食源性疾病的最主要病原体之一,而且是导致食源性疾病暴发的最主要原因[2-8]。近年来,关于沙门氏菌检测的相关研究有很多[9-13],但是归纳比较多个方法的文章还很欠缺,本文同时采用六种方法[14-17]对20个餐饮肉样品进行处理,结合实际比较六种方法的优缺点,对于沙门氏菌检测研究具有指导意义。

1、材料与方法
1.1 试剂与材料
1.1.1 标准菌株: 鼠伤寒沙门氏菌ATCC49416
1.1.2 培养基和试剂: BPW(缓冲蛋白胨水)、TTB(四硫黄酸钠煌绿增菌液基础)、SC(亚硒酸盐胱氨酸增菌液)、BS(亚硫酸铋琼脂)、XLD(木糖-赖氨酸脱氧胆盐琼脂)、HE(Hektoen Enteric 琼脂)、DHL(胆硫乳琼脂)、TSI(三糖铁培养基)、PCA(平板计数琼脂)、NA (营养琼脂)、沙门氏菌生化试鉴定套餐等均产自北京陆桥生物科技有限公司;丹麦SSI沙门氏菌血清(206种);RVS肉汤、MKTTN肉汤、VIDAS专用SLM试剂盒、API 20E专用RAPID ID 32 E(肠杆菌科和其他非苛养革兰氏阴性杆菌鉴定试剂条)及VITEK2 COMPACT GN 试剂卡由法国生物梅里埃公司提供。
1.1.3 样品由不同餐饮点随机抽取:椒麻鸡(3),咸水鸭(3),酱卤肉(6),手抓羊肉(4),牛腱子(4)
1.2 仪器设备
VIDAS(法国生物梅里埃公司);VITEK 2 COMPACT(法国生物梅里埃公司)。
1.3 实验方法
GB 4789.4-2010、SN0170-1992、ISO6579-2002均按方法规定的程序操作;VIDAS、VITEK、API20E按生物梅里埃公司相应的沙门氏菌检测方案进行。
1.4 测试步骤
1.4.1 GB4789.4-2010:无菌操作将25g(ml)样品加入225mL缓冲蛋白胨(BPW)水,均质后37℃培养18h,移取1mL,转种于10mLTTB内,42℃培养24h。同时,另取1mL,转种于10 mLSC内,37℃培养24h。培养后分别取增菌液1环,画线于BS琼脂平板和XLD(或HE)琼脂平板,BS于37℃培养48h,XLD或HE培养基于37℃培养24h,自选择性琼脂平板上分别挑取2个以上典型或可疑菌落后进行TSI、赖氨酸、NA、靛基质、尿素(PH7.2)和KCN实验。
1.4.2 SN0170-1992: 无菌操作将25g(ml)样品加入225mL缓冲蛋白胨(BPW)水中,均质后(pH调至6.8)于37℃培养4h,移取10mL,转种于100 mLTTB内,42℃培养20h。同时,另取10mL 前增菌液加入到100mLSC中,37℃,培养24h进行选择性增菌。无菌操作,用直径3mm的接种环分别挑取摇匀的培养液1环,画线于表面无凝结水的BS和DHL平板各一个,于37℃培养24h,每个琼脂平板至少应挑选2个典型或可疑菌落进行TSI、赖氨酸、NA、靛基质、尿素( pH7.2) 和KCN实验。
1.4.3 ISO6579-2002:37℃培养18h的1mL BPW增菌液加入10mLRVS肉汤41.5℃培养24h;1mLBPW增菌液加入10mL MKTTN肉汤37℃分别培养24h。培养后分别取增菌液1环,画线于XLD琼脂平板和HE琼脂平板,37℃培养24h,后挑取2个以上典型或可疑菌落后进行TSI、尿素酶、赖氨酸脱羧酶、β-牛乳糖、V-P、吲哚实验。
1.4.4 API20E方法:使用梅里埃/RAPID ID 32E(肠杆菌科和其他非苛养革兰氏阴性杆菌鉴定试剂条),配制菌悬液后接种于试剂条,于37℃培养24h,由API LAB Plus软件说明表判读鉴定结果。
1.4.5 VIDAS方法:取样、前增菌、增菌步骤同GB方法,后按照全自动食品致病菌检测方案检测步骤操作,先水浴加热15min,冷却后取500μL于沙门配套检测试剂条SLM配套SPR管进行操作,50min后自动打印鉴定结果。
1.4.6 VITEK:配制0.5-0.63麦氏单位菌悬液,充填到GN卡内,封口后放入测试槽内,按仪作规程装载卡片,6~10h后仪器自动生成鉴定结果。
2、结果
2.1 采用GB4789.4-2010进行实验
在20个肉样品中,禽肉检出2例,羊肉中检出1例,牛肉中未检出,猪肉中检出1例,检出率20%,且经生化及血清分析判断为肠炎沙门氏菌。共有六种不同情况的菌落形态:

表1 不同选择性琼脂平板上的菌落特征结果

BS琼脂 无可疑菌落XLD琼脂 无可疑菌落阳性对照5 BS琼脂 棕褐色菌落有金属光泽黄色菌落
将每个样品自对应的选择性琼脂平板上分别挑取3个典型菌落进行三糖铁琼脂斜面画线及底层穿刺实验:

表2 三糖铁琼脂和赖氨酸脱羧酶试验培养基内的反应结果
将每个样品进行蛋白胨水、尿素、氰化钾生化反应实验,结果见表:

表3 生化反应结果
血清学鉴定在玻片上划出2个区域,挑取待测菌后分别加多价菌体(O)抗血清、加多价菌体(H)抗血清和生理盐水对照。充分摇动混合1min,对着黑色背景观察结果:

表4 血清学鉴定结果
血清学分型:用O抗血清、H抗血清做玻片凝集试验,同时用生理盐水做对照。用Vi抗原的鉴定用Vi因子血清检查,均为阴性, 结果见表:

表5 O抗原、H抗原鉴定结果
菌型的判定:鉴定结果见表10根据血清学分型鉴定结果,按沙门氏菌属抗原表判定结果见表:

表6 菌型判定结果
2.2 SN0170-92 法检测结果
20个肉样品中,禽肉检出2例,羊肉中未检出,牛肉中未检出,猪肉中检出1例,检出率15%,TTB、SC增菌的样品在DHL平板、BS平板上培养,鉴定结果如下:

表7 菌型、生化及血清判定结果
2.3 ISO6579-2002:
1.4.1 症状积分 阴道炎的症状主要有外阴瘙痒或红肿、阴道充血、白带增多或异味等。按照阴道炎的严重程度分为0~3分的等级,其中3分说明有严重的阴道炎症状,2分说明有中度的阴道炎症状,1分说明有轻微的阴道炎症状,0分说明无阴道炎症状。在治疗前后,评价阴道症状的总积分,积分越高说明越严重[3]。
20个肉样品中,禽肉检出2例,羊肉中检出1例,牛肉中未检出,猪肉中检出1例,检出率20%。RVS/MKTTN增菌的样品在XLD平板、HE平板上培养,鉴定结果如下:

表8 菌型、生化及血清判定结果

2.4 VIDAS 法
VIDAS 是利用酶联荧光免疫分析技术(ELIFA)原理,通过固相吸附器,包被针上有抗体包被,用已知抗体来捕捉目标生物体,所测得的荧光与标本中抗原的含量成正比。本实验检测完成后,结果由计算机自动分析判定,检测阈值为0.23,本实验绝大部分样品值<0.23,判定为沙门氏菌阴性;但个别样品及阳性对照值>0.23,判定为沙门氏菌阳性。本实验20个肉样品中,禽肉检出2例,羊肉中检出1例,牛肉中出1例,猪肉中检出1例,检出率25%。
2.5 API 20E 试条中的生化反应结果
API 20E的鉴定结果见附表。API LAB软件分析结果%id=99.9。本实验20个肉样品中,禽肉检出2例,羊肉中检出1例,牛肉中未检出,猪肉中检出1例,检出率20%。

表9 API 20E 试条判定结果
2.6 VITEK
3、分析与讨论
在20个肉样品中,方法SN0170-1992检出率3例,方法GB 4789.4-2010、ISO6579-2002 、VITEK、API20E检出率4例,VIDAS检出5例,但有1例样品经生化鉴定不是沙门氏菌属。分析原因,推测SN0170-1992方法中前增菌时间短,且DHL培养基选择性不强,所以漏检。此外除VIDAS方法外其他方法均需纯菌培养,在BS、XLD平板上挑菌时,由于个人经验习惯,也可能存在漏挑不典型菌落。VIDAS基于酶联免疫技术原理,通过对菌体脂多糖和鞭毛蛋白抗原的鉴别区分菌种,因此不存在漏检,但可能出现假阳性结果。
没有任何一种培养基可以保证所有食品基质或各种沙门氏菌血清型正常生长,因此本文采用的几个标准方法均是同时使用两种或两种以上培养基进行平行实验,以减少假阴性结果。相比较,沙门氏菌在BS和XLD培养基上生长状态比较好,且BS培养基的选择性高于其他培养基。沙门氏菌标准检验方法检测过程复杂、周期长,需要多种试剂,成本较低,对检测者要求有丰富的检测经验。
VITEK仪器成本高,比传统方法节省约三分之一的时间,其与API20E生化实验上做到了微型化和集约化,检测结果更精确,步骤简单、时耗少、效率高;API20E基于半自动操作,成本低,易推广。VIDAS在50min左右可完成沙门氏菌的测定。检测快速、灵敏度、全自动、高通量,适合于大批量致病性微生物的快速筛选,但成本高,且阳性样品需确证,不能直接判定并定量。以下是几种方法的比较:
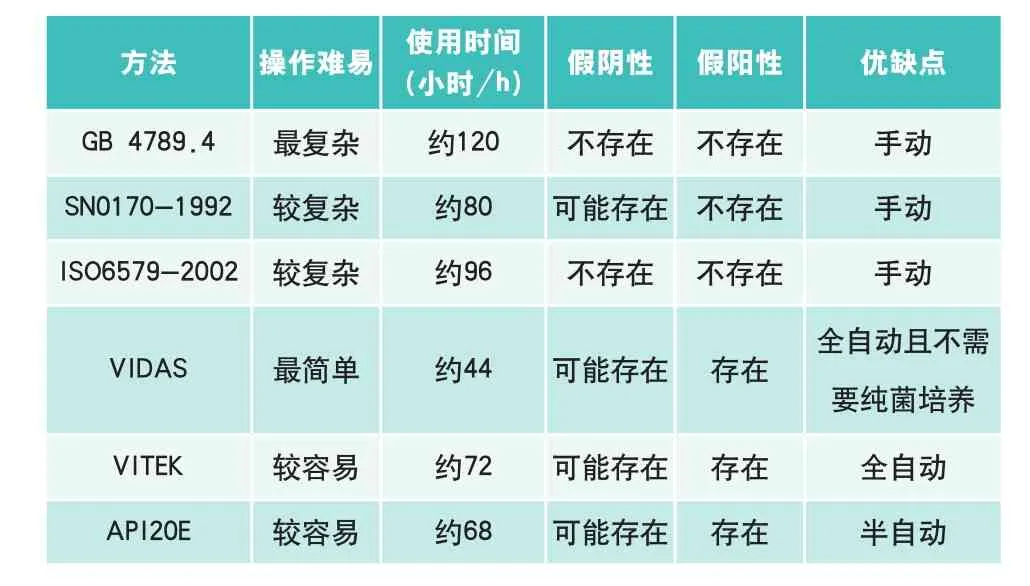
表10 六种方法的比较
结果显示,沙门氏菌在餐饮肉制品中污染比例较高,占20%,且禽肉中检出比例最高。推测原因是沙门氏菌的二次污染引起。尽管食品经过清洗、热处理大部分微生物已被灭活后才使用,但即食食品在加工过程中与受污染器械、餐具、带菌人员接触,或成品后与生鲜食品、带菌肉类混合储存等环节均可能再次染菌。
食品样品检验数量大,检验流程复杂,检验周期长一直是影响检验效率低的重要原因,在重大餐饮保障任务或节假日餐饮安全任务中为了保证全面、大规模的筛查应当先进行检品阳性初筛,这样不仅提高检验效率,还防止漏检现象的发生。通过判断,避免食品安全事故发生,提高食品监管部门应急处置突发事件的能力,将可能波及人员范围、事件影响程度降低到最低点,切实保障广大人民群众的利益,为餐饮食品监管提供科学、有效的依据;为加强食品安全的公共教育和宣传,增强全社会的食品安全意识,促进食品安全诚信体系建设奠定基础[18-19]。
[1]Ray B,Bhunia A. 基础食品微生物学[M].4 版.江汉湖,译. 北京: 中国轻工业出版社,2014: 264-270.
[2]吴双志,刘洋,胡锋,等.2011-2013 年牡丹江市食品中沙门氏菌的分布调查[J].医学动物防制,2015,31( 9):1005-1007.
[3]尹明远,张晓燕,艾乃吐拉,等.2010-2012年新疆乌鲁木齐地区零售生肉中沙门菌污染情况调查[J].中国食品卫生杂志,2014,26(2):172-175.
[4]张文宇,杜雄伟,岳威威.大连地区食源性沙门氏菌耐药性检测[J].畜牧兽医科技信息,2014(2):35-36.
[5]孙吉昌,游兴勇,曾艳兵,等.2009年至2011年江西省食品中沙门菌污染状况调查[J].实验与检验医学,2012,(2):126-129.
[6]琪木格.八类食品中沙门氏菌污染状况分析[J].内蒙古医学杂志,2012,44(2):F3.
[7]吴林海,王建华,朱淀,等.中国食品安全发展报告: 2013[M].北京: 北京大学出版社,2013: 2-500.
[8]陈玲,张菊梅,杨小鹃,等.南方食品中沙门氏菌污染调查及分型[J].微生物学报,2013,53( 12) : 132-1333.
[9]山珊,牛瑞江,赖卫华,等.免疫磁珠法富集沙门氏菌的优化及应用[J].食品工业科技,2013( 13) : 153-156.
[10]杜雄伟,李叶,冮洁,等.肉制品中沙门氏菌invA 基因实时荧光定量PCR检测方法的建立[J].食品工业科技,2013,12:68-70,80.
[11]李杜娟.食品沙门氏菌检测方法的发展[J].河南科技,2011( 5) : 69-70.
[12]俞慕华,鞠长燕,陈辉,等.能力验证实验中沙门菌分离与鉴定[J].中国卫生工程学,2012( 5) : 424-426.
[13]张贤群(译) ,李震(校).美国和欧洲的沙门氏菌污染控制经验:成功与改进[J].国外畜牧学: 猪与禽,2014,34( 11): 43-44.
[14]食品安全国家标准.沙门氏菌检验,GB4789.4-2010[S].
[15]中华人民共和国进出口商品检验行业标准.出口食品沙门氏菌属(包括亚利桑那菌)检验方法,SN0170-1992[S].中国标准出版社出版,1992.
[16]法国生物梅里埃公司. VIDAS 全自动食品致病菌检测方案[M].上海长源科学技术有限公司,2002,1: 1-4.
[17]ISO 6579-2002 [S]. Microbiology of Food and Animal Feeding stuffs-Horizontal Method for the Detection of Salmonella spp,2002,2.Comparison.
[18]胡建国.我国餐饮业食品安全现状及控制方法与措施[J].轻工科技,2012,(9):131-135.
[19]徐潇,甘辛,崔生辉,等.我国餐饮服务食品中致病菌污染及检验现状分析[J].中国药事,2012,(6):545-547.
Comparison of the Detection Results of Salmonella in Restaurant Meat Samples by 6 Kinds of Methods
Salmonella was tested in twenty restaurant meat samples by GB4789.4-2010、SN0170-1992、ISO6579-2002 、VIDAS、VITEK and API20E respectively. Every methods can detect salmonella in meat sample but detect rate is slightly different. It was proved that Salmonella grew better on XLD and BS while BS had better selectivity than others. API 20E need less time and is efficient than other standard analysis methods. VIDAS don't need to separate pure bacteria and just need 50 min to have the results. The positive result of VIDAS is not the final result and the result need to be confirmed by other analysis methods.
Salmonella Methods Comparison
甘肃省自然科学基金项目(1606RJZA210 )
