黄粉虫虫粕中甲壳素的提取工艺
2016-04-11高素红吉志新宋士涛温晓蕾暴瑞欣
高素红,吉志新,宋士涛,温晓蕾,暴瑞欣,王 熙
(1 河北科技师范学院生命科技学院, 河北 秦皇岛,066600;2 河北农业大学林学院)
黄粉虫虫粕中甲壳素的提取工艺
高素红1,2,吉志新1,宋士涛1,温晓蕾1,暴瑞欣1,王 熙1
(1 河北科技师范学院生命科技学院, 河北 秦皇岛,066600;2 河北农业大学林学院)
采用酸碱法从黄粉虫幼虫脱油脂后的干燥虫粕中提取甲壳素,通过正交试验设计对提取工艺进行优化。结果表明,HCl的质量分数和NaOH的质量浓度、浸泡时间、浸泡温度、提取剂用量对虫粕甲壳素的提取有较大的影响,其影响程度按照由大到小的顺序依次为:HCl浸泡时间,HCl浸泡温度,HCl的质量分数,提取剂用量;NaOH的质量浓度,浸泡温度,浸泡时间,提取剂用量。提取黄粉虫虫粕中甲壳素的最优工艺条件为:酸浸时间2.5 h,酸浸温度80 ℃,质量分数为0.08的HCl,提取剂用量15 mL·g-1;碱浸时间3 h,碱浸温度80 ℃,质量浓度为60 g·L-1的NaOH,提取剂用量20 mL·g-1。制得的产品为白色片状固体,灰分的质量分数为0.006 7,剩余蛋白的质量分数为0.020 3 mg·g-1。产品提取率为13%。
黄粉虫虫粕;甲壳素;正交试验;提取工艺
甲壳素是21世纪最具开发价值的生物材料[1~4]。目前,从虾蟹壳提取甲壳素/壳聚糖己形成工业化生产,然而越来越多的研究结果表明,昆虫外骨骼中甲壳素含量(33%~44%)高于虾蟹壳中含量(15%~17%),且昆虫外骨骼中的盐类物质远少于虾壳、蟹壳,是一种更优良的甲壳素资源[5~7]。
当前,对于特种经济昆虫黄粉虫虫油、虫蛋白等的提取及纯化技术已日臻完善[8],而提取后的虫粕除用于畜禽饲料外,并未得到很好的利用,经济价值低。进一步对黄粉虫幼虫虫粕中含有的大量甲壳素提取提纯,变废为宝,可实现资源的增值利用。为此,笔者以提取油脂后的黄粉虫虫粕作为原材料提取甲壳素,采用正交试验设计,以残余蛋白质含量和灰分含量为考察指标,探讨酸碱法中各因素对甲壳素提取的影响。
1 材料与方法
1.1 材料仪器
1.1.1 材料 秦皇岛市经济昆虫开发利用工程技术研究中心(河北科技师范学院)提供的压榨油脂后的黄粉虫虫粕。
1.1.2 试剂 质量分数为0.37的HCl,质量浓度为60 g·L-1的NaOH,无水C2H6O,NaHSO3,HNO3,H3PO4,I-KI溶液,浓H2SO4,KMnO4,KBr,均为分析纯。
1.1.3 仪器 电子天平(MP200A,上海精密科学仪器有限公司)、恒温水浴锅(HHS21-6,江苏省金坛市医疗仪器厂)、紫外可见分光光度计(UV755B,上海精密科学仪器有限公司)、傅里叶变换红外光谱仪(TENSOR 27,德国BRUKER公司)、马弗炉(天津市欧亚仪器仪表有限公司)、电炉(天津市泰斯特仪器有限公司)、电热鼓风干燥箱(GZX-9140MBE,上海博讯实业有限公司医疗设备厂)、干燥器、离心机(GL-20G-H,上海安亭科学仪器厂)、移液管(枪)、坩埚、研钵、pH试纸等。
1.2 试验设计
在单因素实验的基础上,将HCl的质量分数和NaOH的质量浓度,浸泡时间,浸泡温度以及提取剂用量作为考察因素。每个因素选择4个水平,如表1,表2。按L16(45)进行正交设计,以确定提取虫粕中甲壳素的工艺参数。

表1 黄粉虫虫粕酸处理正交试验因素及水平

表2 黄粉虫虫粕碱处理正交试验因素及水平
1.3 试验方法
1.3.1 工艺流程 制备甲壳素的流程见图1。
1.3.2 酸处理去无机盐 将HCl溶液配成质量分数分别为0.04,0.06,0.08,0.10的HCl溶液,备用。称取5.00 g虫粕置于1~16号500 mL烧杯中,按照正交试验设计方案分别加入适量酸液浸没虫粕(表1),以温度分组放入水浴锅中,并按设计时间依次取出相应烧杯。取出后用清水清洗至中性,置于培养皿中,于110 ℃烘箱中干燥至恒质量。
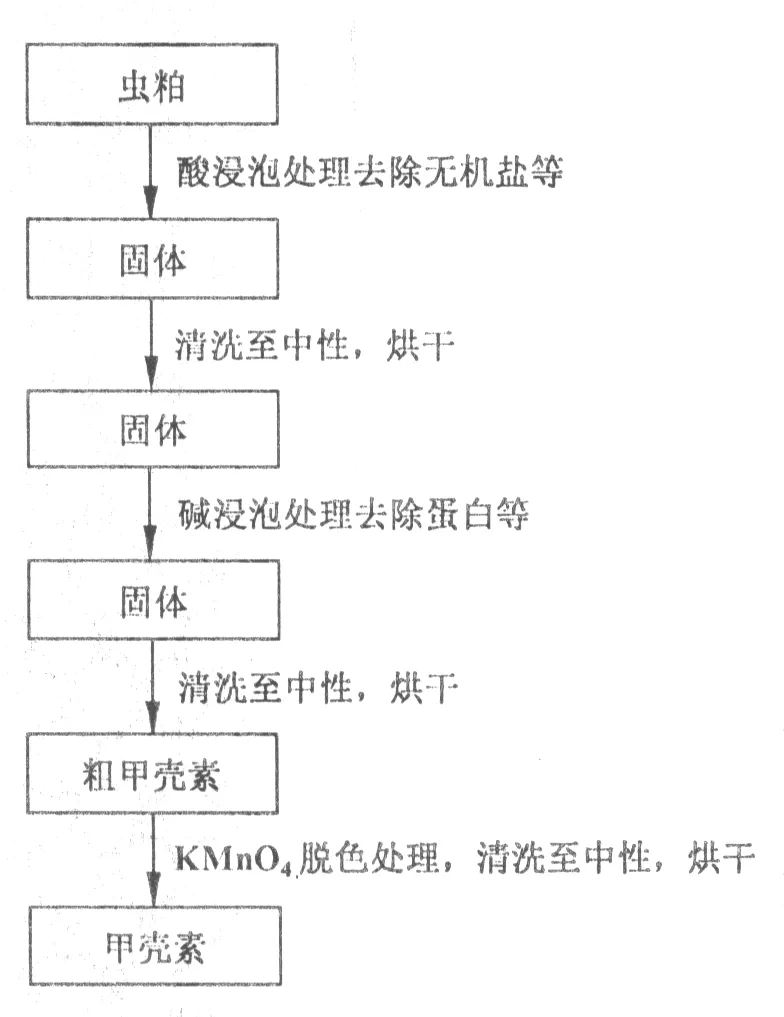
图1 黄粉虫虫粕制备甲壳素流程
1.3.3 灰分含量的测定[9,10]
(1)坩埚的准备 将使用的坩埚用质量分数为0.20的稀盐酸煮沸1~2 h后,去离子水洗净,100 ℃烘箱烘干。置高温电炉中以550 ℃灼烧1 h,当温度降至200 ℃以下时,用坩埚钳取出坩埚,放入干燥器中冷却,待温度降至室温后,迅速称质量,准确至0.1 mg。然后以同样的温度灼烧30 min后称质量,2次质量之差不可超过0.2 mg,否则重复灼烧。
(2)称样 将经过盐酸处理的16个样品用研钵磨碎后分别装入坩埚中,以盛满坩埚为宜,称质量,精确至0.1 mg。
(3)预灰化 为了促进样品均匀灰化,加2 mL体积分数为0.95的C2H6O溶液湿润样品,然后将坩埚放在低温的电炉预灰化。开始电压为80~100 V,约1 h后逐渐升到220 V,要避免明火燃烧,防止样品的固体微粒喷出,在不冒烟以后增加温度。当预灰化接近完成时,取下坩埚放在石棉网上冷却后,加8滴体积分数为0.30的H2O2和2~3滴浓HNO3,再放在电炉上,利用余温加热直至蒸干,再加热至内容物呈白色或灰白色。
(4)灰化 将预灰化后的坩埚放入高温电炉中,以540~560 ℃灼烧4 h,待温度降至200 ℃以下,取出坩埚,放入干燥器中冷却,降至室温后,迅速称质量,准确至0.1 mg。
(5)灰分质量分数的计算
灰分的质量分数=[(m1-m2)/m3]
式中:m1——坩埚质量加灰分质量,m2——坩埚质量,m3——样品质量。
1.3.4 碱处理去除蛋白等有机物 以酸处理后所得各因素最优组合处理黄粉虫虫粕,将所得产品分16份,每份4 g置于编号1~16的500 mL烧杯中,按照正交试验设计的方案分别加入配比好的碱液浸没样品(表2),按温度分组放入水浴锅中,碱煮,根据设计时间依次取出相应烧杯。取出后用清水清洗至中性,置于培养皿中,于110 ℃烘箱中干燥至恒重。
1.3.5 蛋白质量分数的测定(考马斯亮蓝G-250染色法)
(1)考马斯亮蓝G-250试剂的配制 称取10 mg考马斯亮蓝G-250溶于5 mL体积分数为0.90的C2H6O中,再加入10 mL 质量浓度为850 g·L-1的H3PO4溶液,用蒸馏水定容至100 mL。
(2)100 mg·L-1标准牛血清蛋白溶液 用电子天平精确称取牛血清蛋白10 mg,溶于100 mL蒸馏水中。(3)标准曲线制作 6支试管,按表3添加试剂。摇匀,放置2 min后在595 nm波长下比色,记录消光值。以消光值为纵坐标,牛血清蛋白为横坐标,绘制标准曲线。
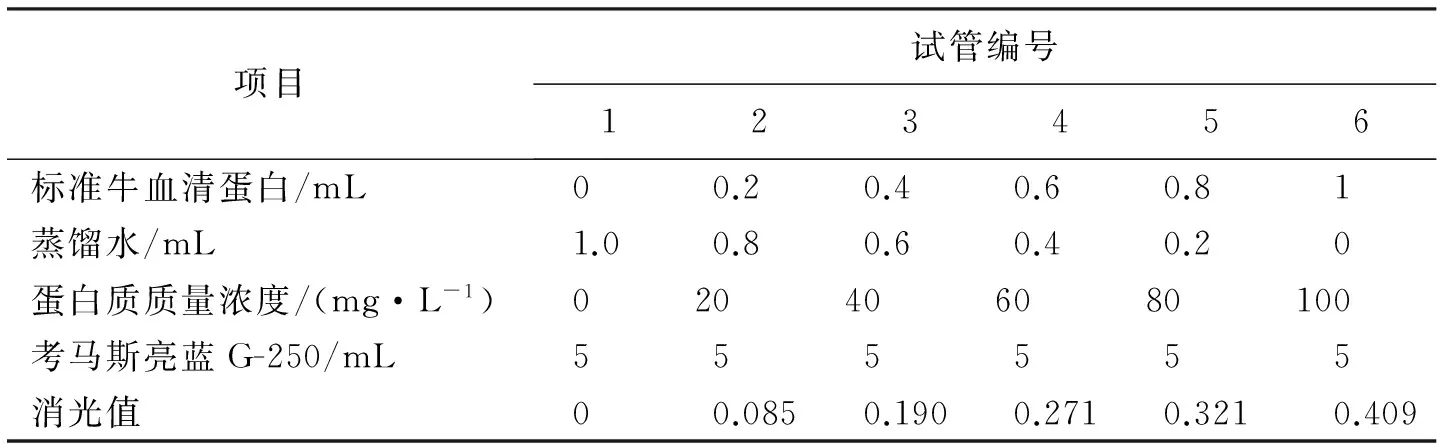
表3 测定蛋白质量分数的标准曲线的制作
得到直线回归方程为y=0.004x+0.010 2(R2=0.956)。
(4)样品处理 将经过碱处理的16个样品,每份称取0.5 g放入研钵中磨至粉状,与5 mL去离子水混合均匀后转入离心管,置于离心机中以10 000 r/min离心10 min,取上清液,定容待测。
(5)测定消光值 吸取上述所得上清液1 mL转入锥形瓶中,加入5 mL配制好的考马斯亮蓝G-250试剂,充分摇匀,放置2 min后于595 nm处比色,记录消光值。
(6)参比液 将1 mL去离子水倒入锥形瓶中,加5 mL考马斯亮蓝试剂,充分摇匀。
(7)计算蛋白的质量分数
A=C×V/(W×1 000)
式中:A蛋白质的质量分数(mg·g-1);C为从坐标曲线上查得蛋白质的质量浓度(mg·L-1);V为上清液总体积(mL);W为样品质量(g)。
1.3.6 脱色方法 将粗甲壳素浸入质量浓度为20 g·L-1的KMnO4溶液中,在50 ℃下加热3 h。产品经清水洗涤,过滤,再用质量浓度为30 g·L-1的NaHSO3溶液浸泡30 min,还原至中性。
1.3.7 甲壳素定性检验
显色反应[11]将制得的产品依次移入体积分数为0.95,0.70,0.50,0.30的C2H6O溶液中清洗,再用蒸馏水冲洗待用;将甲壳素置于白瓷点滴试验板上,加入 1 滴体积分数为0.000 3的I-KI溶液,再加1滴体积分数为0.01的H2SO4溶液,若显示紫褐色,再加数滴体积分数为0.75的H2SO4溶液,紫色逐渐消失,则表明测定物为甲壳素。
红外光谱测定 准确称取2~3 mg甲壳素样品,加入100 mg KBr于研钵中在红外灯下研磨,直至完全研细混匀。将研磨好的粉末放入压膜器内,抽真空加压,得到透明薄片,将薄片置于样品架上在500~4 000 cm-1范围内扫描,进行红外光谱测试。
1.3.8 甲壳素提取率的测定 将制得的甲壳素放入培养皿中于烘箱60 ℃烘干后,用万分之一电子天平称质量,待样品质量2次之差不超过0.001 g时,即为烘干后的甲壳素质量。
计算公式:提取率=[烘干后甲壳素质量/虫粕质量]×100%
2 结果与分析
2.1 酸处理黄粉虫虫粕的结果与分析
以灰分的质量分数为评价指标,优化虫粕脱无机盐的最佳工艺条件。正交试验结果见表4。极差分析表明,在所考察因素的水平范围内,4因素对残余灰分质量分数影响的主次顺序依次为C,B,A,D(表4)。即处理时间影响最大,提取剂用量影响最小,较优的脱钙条件为8号组合:质量分数为0.06的盐酸,浸泡温度80 ℃,浸泡时间2 h,提取剂用量为15 mL·g-1,即A2B4C3D2,该条件下残余灰分的质量分数为0.008。
由表4可知,当使用质量分数为0.08的盐酸,浸泡温度为80 ℃,浸泡时间为2.5 h,提取剂用量为15 mL·g-1时,即A3B4C4D2组合,提取物中灰分的质量分数最低(该组合未在16组正交试验设计中出现)。以最优条件组合酸浸虫粕,得到产品并测定其灰分的质量分数,结果为0.006 7,该结果优于已进行试验的正交试验中所有组合。因此,A3B4C4D2为本次试验酸处理黄粉虫虫粕的最优组合。

表4 黄粉虫虫粕脱无机盐的酸处理正交试验结果
2.2 碱处理黄粉虫虫粕的结果与分析
以残留蛋白质的质量分数为评价指标,优化虫粕脱蛋白的最佳工艺条件。正交试验结果见表5。极差分析表明(表5),在所考察因素的水平范围内,4因素对残余蛋白的质量分数影响的主次顺序依次为A,B,C,D,即NaOH的质量浓度影响最大,提取剂用量影响最小,较优的脱蛋白条件为6号组合:使用质量浓度为60 g·L-1的NaOH,浸泡温度80 ℃,浸泡时间1 h,提取剂用量为25 mL·g-1,即A2B2C1D4,该条件下残余蛋白的质量分数为0.024 9 mg·g-1。
碱煮黄粉虫虫粕提取甲壳素的最佳条件组合为:NaOH的质量浓度60 g·L-1,浸泡温度80 ℃,浸泡时间3 h,提取剂用量20 mL·g-1,即A2B2C3D3(该组合未在16组正交试验设计中出现)。以最优条件组合碱煮黄粉虫虫粕,得到产品并测量其蛋白的质量分数,结果为0.020 3 mg·g-1,该结果优于已进行试验的正交试验中所有组合。因此,A2B2C3D3为本次试验碱处理的最优组合。
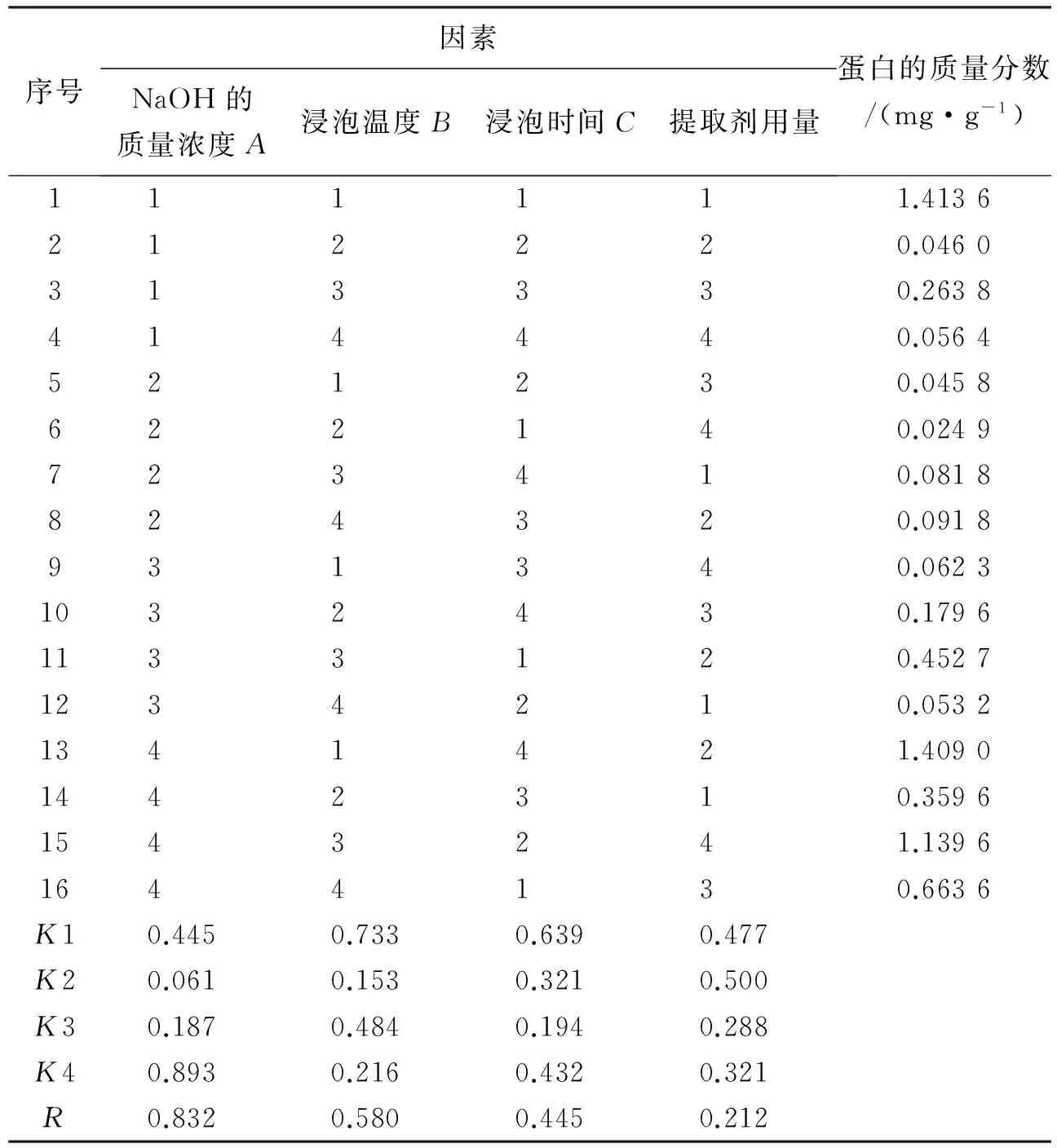
表5 NaOH处理黄粉虫虫粕的正交试验结果
2.3 产品的定性检验
2.3.1 显色反应 将产品清洗后置于白瓷点滴试验板上,加入1滴体积分数为0.000 3的I-KI溶液,再加1滴体积分数为0.01的H2SO4溶液在点滴试样板上,显示紫褐色;再加数滴体积分数为0.75的H2SO4溶液后,紫色逐渐消失,确定本产品为甲壳素。
2.3.2 红外光谱测定 通过红外光谱测定,发现最优工艺条件下制得的产品与甲壳素标准品图谱及文献报道的甲壳素的红外光谱[12,13]一致,各主要吸收谱带的归属为:3 446~3 266 cm-1处的宽峰为ν(O-H)+ν(N-H);3 110~2 927 cm-1处的一组峰为ν(C-H);1 660 cm-1附近的峰为ν(C=O)(酰胺Ⅰ谱带);1 558 cm-1处的峰为ν(N-H)(酰胺Ⅱ谱带);1 415,1 379 cm-1附近的峰为ν(CH2)+ν(CH3);1 315 cm-1附近的峰为酰胺Ⅲ谱带;1 157 cm-1处的峰为ν(C-O-C);1 115 cm-1处的峰为ν(环);1 074,1 027 cm-1处的峰为ν(C-O),依次分别为二级醇羟基和一级醇羟基。其中1 659 cm-1(酰胺Ⅰ),1 558 cm-1(酰胺Ⅱ),1 315 cm-1(酰胺Ⅲ)为甲壳素的3个特征峰(图2)。表明从黄粉虫幼虫虫粕中成功制备了甲壳素。
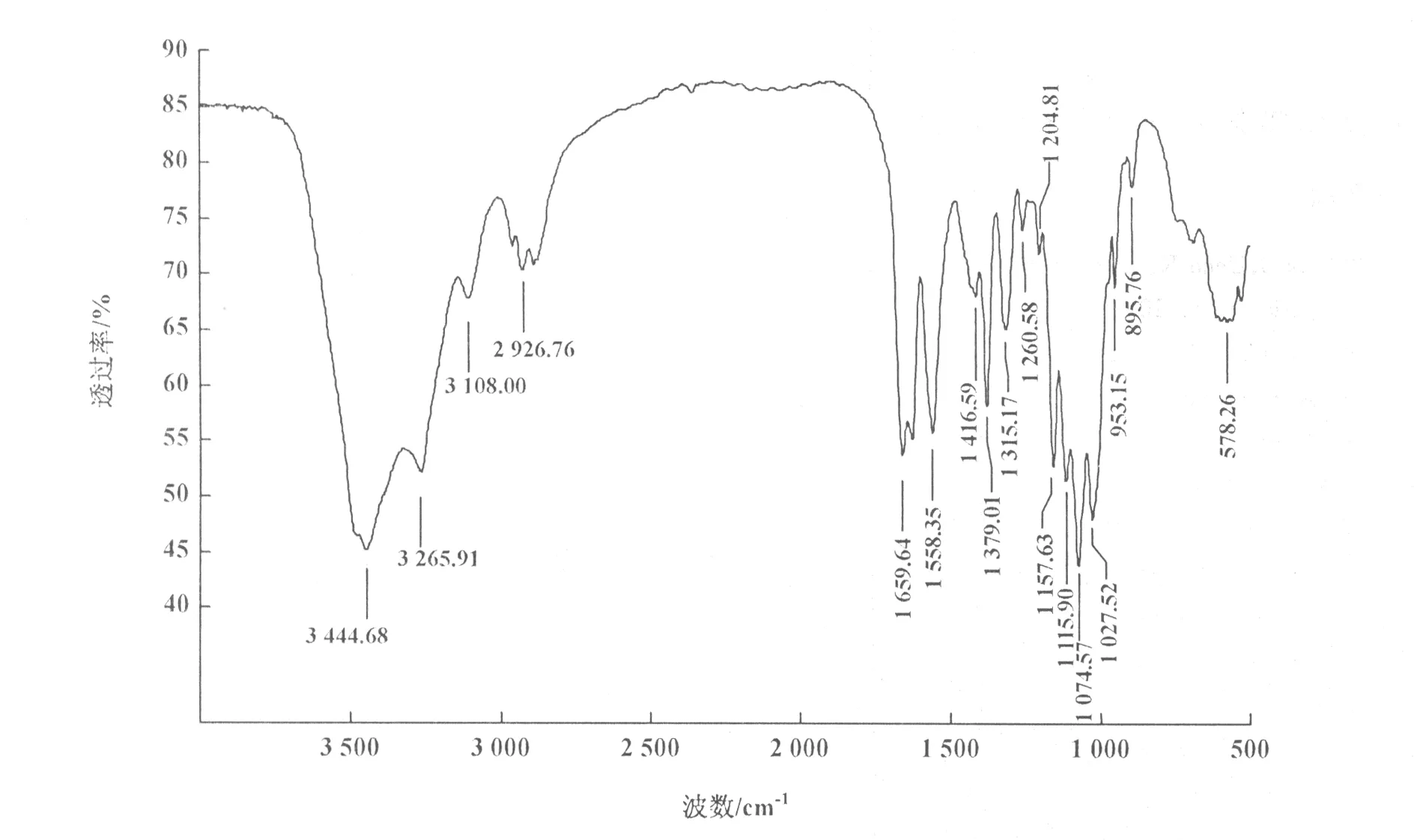
图2 黄粉虫虫粕中提取的甲壳素红外光谱
2.4 产品外观性状
片状固体。经KMnO4氧化脱色后,2号、5号、6号工艺条件下的产品色泽达到食品级要求,呈白色;其余工艺条件下的产品也都达到了工业级的要求,呈乳白色或淡黄色;仅有1号、13号、15号工艺条件下的产品颜色仍较深,未达到工业级甲壳素的标准。
2.5 甲壳素的提取率
以最优组合下的工艺条件提取黄粉虫幼虫虫粕中的甲壳素,提取率为13%。
3 结论与讨论
3.1 结论
(1)本次试验制得的产品通过显色反应和红外光谱定性分析为甲壳素,最优组合工艺条件下所得甲壳素为白色片状固体。
(2)黄粉虫幼虫虫粕脱除无机盐的最优工艺条件为:使用质量分数为0.08的盐酸,酸浸温度80 ℃,酸浸时间2.5 h,提取剂用量为15 mL·g-1,该条件下产品中灰分的质量分数为0.006 7;脱除蛋白的最优工艺条件为:使用质量浓度为60 g·L-1的NaOH,碱浸温度80 ℃,碱浸时间3 h,提取剂用量20 mL·g-1,该条件下产品剩余蛋白的质量分数仅为0.020 3 mg·g-1。
3.2 讨论
与虾蟹壳来源制备的甲壳素相比,从黄粉虫中提取的甲壳素,灰分含量较低,分子量较低,可进一步用来制备低分子量、脱乙酰度较高的壳聚糖[14],有很高的经济价值。利用虫粕制备甲壳素和壳聚糖将开辟黄粉虫饲养厂家的又一精深加工途径,产品附加值高,且原料充足,成本低廉,易大量收集,变废为宝,资源得以充分利用。
本次试验中黄粉虫虫粕甲壳素提取率为13%,高于从虾蟹壳中提取甲壳素的提取率[15,16]。在影响提取率的因子中,HCl浸泡时间、温度和去蛋白所用碱液浓度影响最大,在某一范围内,与提取率均表现为负相关。HCl浸泡时间、温度与去无机盐、碱液浓度与去蛋白互作效应较大,是决定得率的主要因素。
酸碱法提取黄粉虫虫粕中甲壳素的工艺必须使用大量具有腐蚀性的酸、碱,而强酸性、强碱性废液的排放将给环境造成严重的污染。同时,提取甲壳素后的废液中含有大量的蛋白、氨基酸、无机盐、HCl、NaOH等物质,经过有效处理后将得到大量可利用物质,也可经过处理作为饲料添加剂或作为液体肥料等再度被利用[11]。如何合理利用此项工艺产生的废液尚需进一步研究,这对减少环境污染,充分利用资源,实现甲壳素产业的绿色化具有非常重要的意义[17]。
[1] Tokura S,Ueno K,Miyazaki S,et al.Molecular weight dependent antimicrobial activity by Chitosan[J].Macromolecular Symposia,1997,120(1):1-9.
[2] Hideyuki T,Takuya F,Tomokazu O,et al.Colon-specific delivery of R68070, a new thromboxane synthase inhibitor, using chitosan capsules: Therapeutic effects against 2,4,6-trinitrobenzene sulfonic acid-induced ulcerative colitis in rats[J].Life Sci,1999,64(13):1 155-1 162.
[3] 杨怀宇,武婷茹,刘俊希,等.甲壳素-壳聚糖的生理功能及应用研究进展[J].安徽农业科学,2015,43(18):24-25.
[4] 王科兵,王芳宇.壳聚糖及其衍生物抗菌作用的研究进展[J].临床军医杂志,2007,35(6):937-940.
[5] 范文艳,王丽艳.黄粉虫几丁质/壳聚糖提取工艺的研究[J].黑龙江农业科学,2010(4):122-126.
[6] 郭宝华,何钊,冯颖,等.三种昆虫甲壳素提取与分析[J].林业科学研究,2008,21(4):561-565.
[7] 杜开书.黄粉虫壳聚糖的提取及应用研究[D].雅安:四川农业大学,2003.
[8] 李艳芳,伍爱萍,徐匆,等.黄粉虫的应用现状及展望[J].安徽农业科学,2015,43(36):99-101.
[9] 岁姗姗,周祥,周楷.正交试验法优化黄粉虫甲壳素提取新工艺[J].海南大学学报(自然科学版),2015,33(2): 147-151.
[10] 张水华.食品分析[M].北京:中国轻工业出版社,2007.
[11] 吉惠杰,马艳丽.蚕蛹甲壳素提取工艺研究[J].吉林化工学院学报,2012,29(5):28-33.
[12] 王鑫,郑超,张新歌,等.新型生物黏附性材料巯基壳聚糖的合成与表征[J].高等学校化学学报,2008,29(1):206-211.
[13] 窦珍伟,刘宝,孟宪武,等.黄粉虫中甲壳素和壳聚糖的提取工艺研究[J].山东大学学报(工学版), 2008,38(5):107-112,116.
[14] 王丙丽,王洪亮,赵志强,等.黄粉虫虫蜕中甲壳素的提取条件研究[J].广东农业科学,2011(1):118-119.
[15] 王建刚,严涛海,陈光艺.虾蟹壳制取甲壳素工艺的试验研究[J].轻纺工业与技术,2012,41(5):1-3.
[16] 蔚鑫鑫,刘艳,吴光旭.小龙虾壳中甲壳素的提取及壳聚糖的制备[J].湖北农业科学, 2013,52(13):3 120-3 123.
[17] 张天成.甲壳素资源的充分利用及其产业的绿色化[J].中国资源综合利用,2003(8):22-24.
(责任编辑:朱宝昌)
Optimization of Extraction Process of Chitin fromTenebriomolitorMeal
GAO Suhong1,2,JI Zhixin1,SONG Shitao1,WEN Xiaolei1,BAO Ruixin1,WANG Xi1
(1 College of Life Science & Technology, Hebei Normal University of Science & Technology, Qinhuangdao, Hebei, 066600; 2 College of Forestry, Agricultural University of Hebei; China)
The acid-alkali method was used to extract chitin from theTenebriomolitorlarva meal in this paper. The extraction process was optimized by orthogonal experiment design in this experiment. The results showed that thew(HCl) andρ(NaOH), soaking time, soaking temperature and amount of extracting agent had great influences on the extraction of chitin. The influence degree was in accordance with the order from large to small: soaking time of HCl, soaking temperature of HCl,w(HCl), amount of extracting agent, andρ(NaOH), soaking temperature of NaOH, soaking time of NaOH, amount of extracting agent. The optimum extraction conditions were as 2.5 h soaking time of HCl, 80 ℃ soaking temperature of HCl,w(HCl)=0.08, 15 mL·g-1extracting agent, and 3h soaking time of NaOH, 80 ℃ soaking temperature of NaOH,ρ(NaOH)=60 g·L-1, 20 mL·g-1extracting agent. The products was white flake solid, while its ash content and remaining protein content were 0.006 7 mg·g-1and 0.020 3 mg·g-1, respectively. The extraction rate could be as high as 13%.
tenebriomollilorlarva meal;chitin;orthogonal test;extraction process
10.3969/J.ISSN.1672-7983.2016.02.009
秦皇岛市科技局农业推广项目(项目编号:2013-3);秦皇岛市农业科学研究院项目(利用营养源昆虫处理蔬菜尾菜关键技术研究与示范)。
2016-02-09; 修改稿收到日期: 2016-04-22
TQ281.2
A
1672-7983(2016)02-0048-07
高素红(1976-),女,副教授,在读博士。主要研究方向:植物病虫害免疫诱导技术与害虫生态控制研究与应用。
