拮抗细菌TD—12菌株发酵条件的优化及鉴定拮抗细菌TD—12菌株发酵条件的优化及鉴定
2016-04-11张蕾蒋继志于永昂
张蕾++蒋继志++于永昂

摘要:TD-12菌株是前期分离筛选得到的在防治马铃薯晚疫病中很有潜力的内生细菌。为加快对该菌株的深入研究和利用,本试验利用滤纸片法对其部分发酵条件进行了初步优化,结果表明,该菌株在37 ℃、150 r/min、初始 pH值7.0、培养30 h得到的菌液抑菌效果最佳,抑菌率达到了93.12%,抑菌率比优化前提高了7.86%。并通过对该菌株的形态和培养特征观察、生理生化特性以及16 S rDNA序列分析,对该菌株进行了初步鉴定,该菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。试验结果为深入研究该菌株的抑菌性能及开发利用提供了基础资料。
关键词:致病疫霉;TD-12 菌株菌液;鉴定;发酵条件
中图分类号: S435.32文献标志码: A文章编号:1002-1302(2016)02-0143-04
收稿日期:2015-01-27
基金项目:河北省自然科学基金(编号:C2011201003)。
作者简介:张蕾(1987—),女,河南新乡人,硕士,助理实验师,从事植物分子生物学研究。E-mail:zhanglei07025@163.com。
通信作者:蒋继志,教授,博士生导师,从事植物病害生物防治及生物活性物质研发。E-mail:jizhijiang909@163.com。马铃薯(Solanum tuberosum L.)是茄科茄属的一年生草本块茎植物,在粮食作物中位居第四,是唯一的粮菜兼用型作物。由致病疫霉[Phytophthora infestans (Mont) de Bary]引起的马铃薯晚疫病是引起马铃薯产量损失最严重的一种病害。由于化学农药的长期大量使用及病菌A2交配型的出现,致使高致病性、高抗药性菌株不断出现,造成近几年晚疫病在马铃薯和番茄上大流行,引起了国际社会的极大关注[1]。生产中主要依靠选用抗病品种、农业栽培措施、化学农药来控制该病的发生[2],而生物防治因其与环境友好、维持生态平衡、有利于人类健康等优点,受到越来越多研究者的关注和重视。前人已从多种类型的土壤中筛选得到了一些有明显抑制致病疫霉生长或诱导马铃薯增强抗病性的真菌[3]、细菌[4-5]和放线菌[6],并对他们产生的拮抗物质[3]、抑菌机理[7]、诱导抗病作用[4-5,8]等进行了研究。但利用茄科植物内生菌抑制致病疫霉的报道还比较少。我们在前期研究中筛选出了一些对致病疫霉菌丝生长具有显著抑制作用的菌株,如分离自马铃薯块茎的TD-12菌株在初期试验中对致病疫霉菌丝生长表现了强烈的抑制作用,在马铃薯离体组织上也展示出了良好的防病作用,其活体对病菌生长的抑制率达到了92.24%,在马铃薯块茎切片和离体叶片上对晚疫病的防效分别达到了 91.00%、76.23%以上[9]。但在后期的重复试验研究中,发现该菌株的抑菌率有所下降,抑菌率仅为85.26%。为稳定和进一步提高TD-12菌株对致病疫霉的抑制作用,对其部分发酵条件进行了初步优化,并对该菌株的分类地位进行了鉴定,以期为今后开发田间有效控制马铃薯晚疫病高效稳定的生物农药提供理论依据。
1材料与方法
1.1供试菌种
拮抗细菌TD-12菌株(分离于马铃薯块茎中),致病疫霉菌株[Phytophthora infestans (Mont.) de Bary]Z182,本研究室保存菌株。
1.2TD-12菌株发酵条件优化
1.2.1种子液的制备用灭菌竹签挑取牛肉膏蛋白胨平板上的TD-12菌株的新鲜培养菌落,接种到含有50 mL LB液体培养基中,37 ℃、150 r/min振荡培养24 h后,按照1%的比例吸取1 mL到100 mL的LB液体培养基中,37 ℃、150 r/min振荡培养24 h后即为种子液。
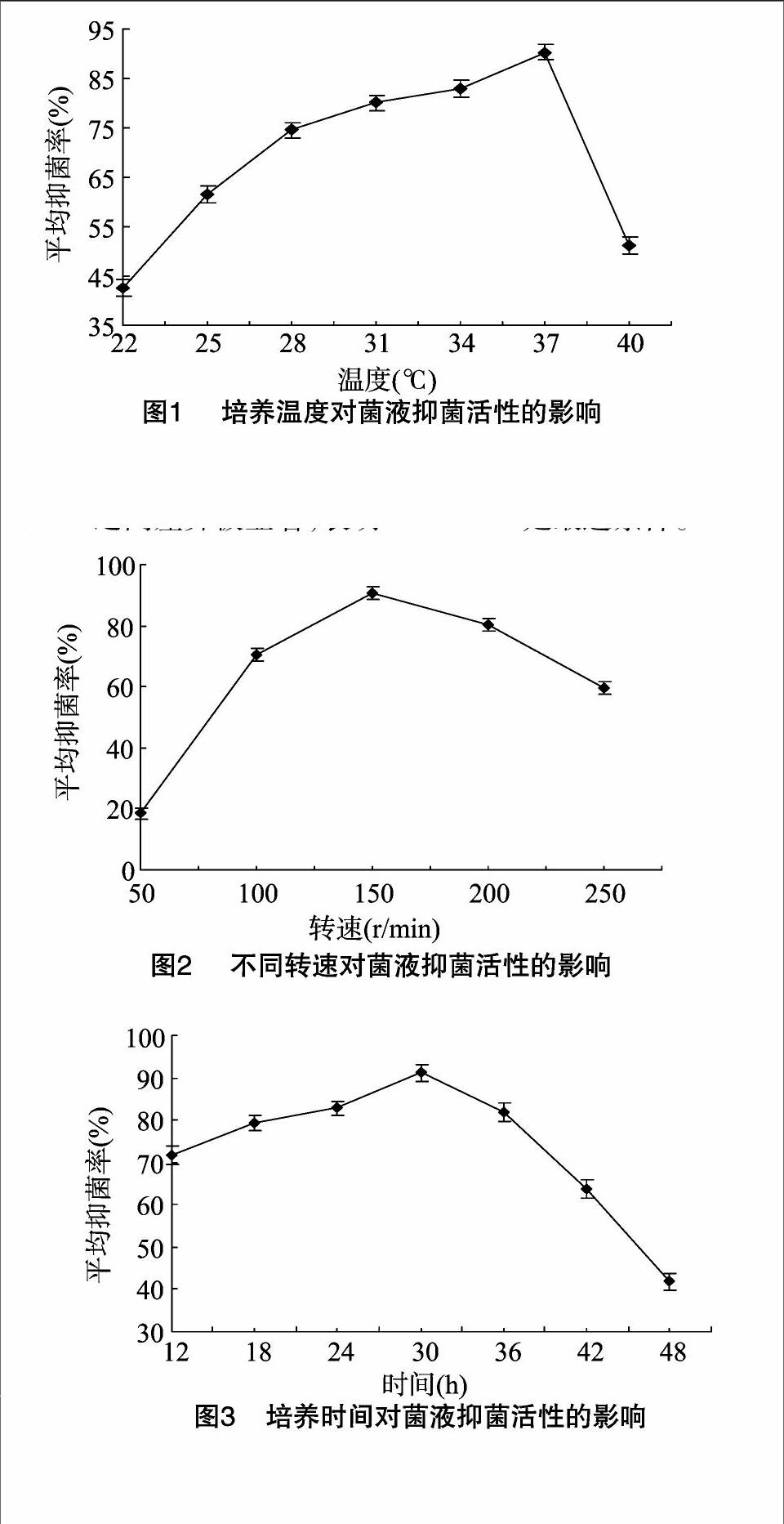
1.2.2发酵温度的确定取TD-12 菌株种子液1 mL接种到装有100 mL LB液体培养基的250 mL三角瓶中,分别在22、25、28、31、34、37、40 ℃条件下振荡(150 r/min)培养24 h,采用滤纸片法[10].,测定对致病疫霉生长的抑制作用,参照李丽艳等方法[5]计算抑菌率。
1.2.3发酵培养中转速的确定将TD-12 菌株1 mL的种子液接种到100 mL LB液体培养基中,按照上述试验中已确定的最适培养温度,分别在50、100、150、200、250 r/min等不同转速下振荡培养24 h,所得菌液抑菌效果的测定方法同“1.2.2”节。
1.2.4培养时间的确定取TD-12菌株种子液1 mL接种到装有100 mL LB液体培养基的250 mL三角瓶中,按照上述试验中已确定的最适培养温度和转速,分别取在第12、18、24、30、36、42、48 h的菌液进行抑菌试验,所得菌液抑菌效果的测定方法同“1.2.2”节。
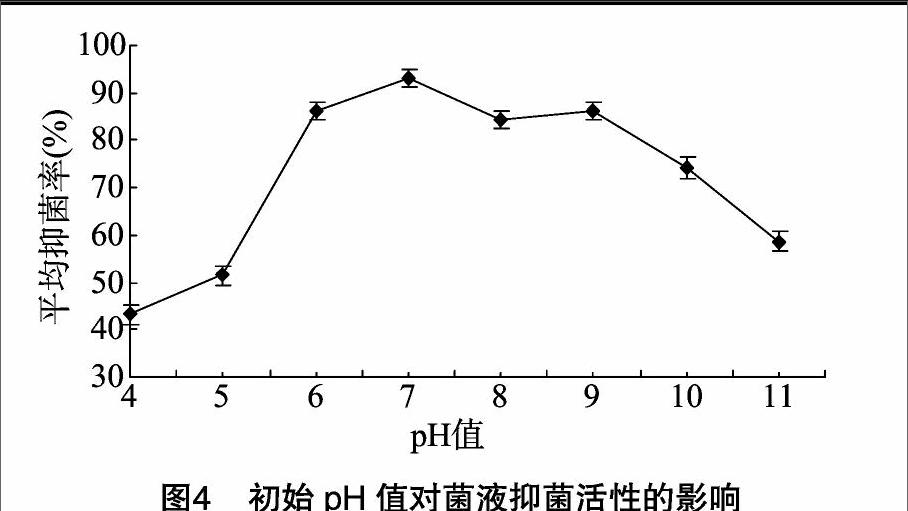
1.2.5初始pH值的确定用NaOH和HCl将LB液体培养基调制成pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0的培养基,然后将1 mL TD-12菌株的种子液接种到100 mL上述培养基中,按照上述试验中所确定的最佳发酵温度、转速以及时间进行发酵培养,所得菌液抑菌效果的测定方法同“1.2.2”节。
以上各项试验条件每组处理重复3次,所得试验结果用SPSS软件进行统计分析。
1.3菌株分类地位的确定
1.3.1菌株培养特性及菌体形态观察及其染色观察TD-12菌株在 LB固体培养基上的生长状况及菌落特征,在光学显微镜下观察菌株菌体的形态,并参照文献[11]进行革兰氏染色和芽孢染色。
1.3.2生理生化特征参照常见细菌系统鉴定手册的方法[12],对TD-12菌株分别进行了接触酶反应、明胶水解、淀粉水解、V-P测定、硝酸盐还原、酪氨酸水解、苯丙氨酸脱氢酶、吲哚产生、柠檬酸利用以及葡萄糖、D-甘露醇、麦芽糖、蔗糖的利用试验。
1.3.316S rDNA基因序列测定及分析采用SDS法提取菌株TD-12总DNA,采用细菌16S rDNA 扩增通用引物扩增TD-12菌株的基因组DNA,通用引物设计,Primer1:5′-AGAGTTTGATCATGGCTCAG-3′,Primer2:5′-TAGGGTTACCTTGTTACGACTT-3′。委托华大基因测序,将所得测序结果通过Blast软件与GenBank核酸数据库进行对比,选取具有代表性的菌株,采用Mega4.1软件包中的Phylogeny进行系统发育树的构建[13]。
2结果与分析
2.1发酵培养温度
取TD-12菌株种子液1 mL接种到装有100 mL LB液体培养基的250 mL三角瓶中,分别在22、25、28、31、34、37、40 ℃条件下振荡(150 r/min)培养24 h,结果表明,培养温度对TD-12菌液抑菌率的影响比较明显(图1),随培养温度升高,抑菌率呈先上升后下降的趋势,在培养温度为22 ℃时抑菌率只有42.59%,随着培养温度的升高,抑菌率逐渐升高,在培养温度为37 ℃时抑菌率最高,为90.25%,而在培养湿度为40 ℃时抑菌率显著下降。分析表明,温度37 ℃所得抑菌率与其他处理之间差异显著。表明TD-12菌株的最佳培养温度为37 ℃,以下试验培养温度均选用37 ℃。
2.2振荡培养中的转速
振荡培养中的转速对TD-12菌液抑菌率的影响见图2。在转速为50 r/min条件下,所得菌液的抑菌率仅为20%,与静置培养条件下的抑菌率无明显差异;当转速在100~200 r/min范围内时,所得菌液均表现出了很强的抑制作用,抑菌率都在70%以上,其中以150~200 r/min条件下所得菌液的抑菌率较高,均在80%以上。在转速为150 r/min时抑菌率最高,为90.52%,在转速为250 r/min时,抑菌率明显下降,为60%。分析表明,转速150 r/min所得抑菌率与转速50、100、200、250 r/min之间差异极显著,表明150 r/min是最适条件。
2.3发酵培养时间
培养时间对抑菌活性的影响结果见图3。该菌株在培养时间为12 h时抑菌率最低,只有70%,随着培养时间的增加,抑菌率逐渐增加,在培养时间为30 h时抑菌率最高,为92%,之后抑菌率随着培养时间的增加而有所下降。分析表明,培养时间为30 h所得抑菌率与培养12、18、24、36、42、48 h处理间差异显著。因此,该菌株的最佳发酵时间为30 h。
2.4培养基初始pH值
从图4可以看出,在初始pH值为4时,抑菌率最低,只有41%;在初始pH值为6~9时,抑菌率基本稳定在90%,其中pH值为7时,抑菌率最高,为93.12%;pH值超过9后,抑菌率急剧下降,当pH值为10、11时,抑菌率分别为74%、58%。分析表明,初始pH值为7时所得抑菌率与其他处理差异显著,由此确定pH值7为最适的初始pH值。
综合上述所有优化条件,优化后的结果见图5。优化后TD-12菌株菌液对致病疫霉的抑菌率达到了93.12%,比优化前85.26%提高了9.22%,表明TD-12菌株有进一步应用潜能。
2.5菌株分类地位的确定
2.5.1培养特性、形态特征及染色结果拮抗菌TD-12在LB培养基上培养呈黄色不透明菌落,表面粗糙,菌落边缘不规则(图6)。显微镜下油镜观察细胞呈杆状,革兰氏染色呈阳性,产芽孢,芽孢呈椭圆形,有运动性。
2.5.2生理生化特征TD-12 菌株的接触酶反应有气泡产生,明胶水解、淀粉水解、V-P 反应和硝酸盐还原均为阳性;酪氨酸水解、苯丙氨酸脱氢酶、吲哚产生、柠檬酸利用均为阴性;可利用葡萄糖、D-甘露醇、麦芽糖和蔗糖。综合 TD-12 菌落特征、培养特性、形态观察和染色结果,参照东秀珠等的方法[12],初步推测 TD-12 菌株可能为芽孢杆菌或类芽孢杆菌属细菌。
2.5.3拮抗菌TD-12菌株的16S rDNA序列分析经PCR扩增后得到TD-12菌株16S rDNA的PCR产物为单一条带,测序结果表明,TD-12菌株16S rDNA的序列长度为1 432 bp。将该序列在GeneBank/NCBI 中进行序列比对,结果表明,TD-12菌株与解淀粉芽孢杆菌在同一个分支上,同源性为94%(图7、图8),表明TD-12菌株与解淀粉芽孢杆菌亲缘关系最近。结合上述形态特征、染色结果和生理生化特性,可以初步确定TD-12菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
3讨论
微生物在不同生长发育阶段和不同培养条件下产生活性物质的种类和数量均不相同,有时培养条件即使只发生微小的变化,活性物质产生也会受到明显的影响。因此,确定菌株的最佳发酵条件对于获得大量高活性物质至关重要。李双东等从番茄中分离得到内生枯草芽孢杆菌EB-28,EB-28无菌体培养液对致病疫霉游动孢子释放的抑制率达91.26%,但对菌体生长没有抑制作用,EB-28菌悬液对马铃薯晚疫病在离体叶片和盆栽植株上的防病效果分别为55.68%和74.22%[14]。Daayf等筛选得到的芽孢杆菌B.subtilis B1、J1、B3对致病疫霉的抑菌率分别达到81%、79%、76%[15]。姜军坡等从健康的牛粪便中筛选出1株解淀粉芽孢杆菌BN-9,发现其对大肠杆菌有较强的抑制作用[16]。Sutyak等从益生菌乳制品中分离得到1株解淀粉芽孢杆菌,其细胞无菌上清液可以对单核细胞增生李斯特菌、链球菌属及肠道加德菌产生抑制作用,但对肠道乳酸菌不产生作用[17]。此外,于靓等对解淀粉芽孢杆菌T1进行了发酵培养基和培养条件进行优化,优化后的培养液中解淀粉芽孢杆菌T1的活菌数明显增多,由1.4×109 CFU/mL增至3.5×109 CFU/mL[18]。郭尧等
用滤纸片法以单因子试验对致病疫霉拮抗放线菌sy11发酵条件优化,结果表明,优化后抑菌率达到了90%,比优化前提高了约10%[19]。吴真真等对致病疫霉拮抗细菌SR13-2进行发酵条件优化,优化后比优化前抑菌率提高了约10%,并且发现该菌株具有较强的耐热性和耐酸碱性[20]。
本研究对分离自马铃薯块茎的 TD-12 菌株菌液抑制致病疫霉菌丝生长的部分发酵条件进行了优化,明确了该菌株的最适发酵条件为:将1 mL种子液接种到初始 pH值7的100 mL LB液体培养基中,在37 ℃条件下以150 r/min的转速振荡培养30 h,在此条件下,所得菌液对致病疫霉菌丝生长的抑制率可达93.12% 优化后比优化前抑菌率提高了9.22%。该菌株在抑制致病疫霉方面有较大的应用潜力。此外,明确拮抗菌的种类及其分类地位,对开发生物制剂且应用于农业生产具有重要的指导意义。本试验中通过菌体形态、培养特性、菌落特征观察以及生理生化特性的16S rDNA序列分析,将菌株 TD-12 鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。有报道表明,解淀粉芽孢杆菌种内的许多菌株对人畜安全,已被越来越多地应用于饲料添加剂和饲用微生态制剂[13]。与此同时,该细菌种内的另外一些菌株展示出了抑制许多植物病原菌的巨大潜力,分离自土壤的1株解淀粉芽孢杆菌 HN06,对黑曲霉(Aspergillus niger)、稻瘟病菌(Magnaporthe oryzae)、水稻纹枯病菌(Rhizoctonia solani)、苦瓜枯萎病菌(cucurbit wilt)均有良好的抑制作用[21]。上述研究进一步证实,解淀粉芽孢杆菌在植物病害防治方面有广阔的应用潜力。
参考文献:
[1]黄英菊,蒋继志,冯丽娜,等. 致病疫霉颉颃细菌研究进展[J]. 中国植保导刊,2013,33(8):18-22.
[2]Cooke L R,Schepers H,Hermansen A,et al. Epidemiology and integrated control of potato late blight in Europe[J]. Potato Research,2011,54(2):183-222.
[3]El-Hasan E,Walker F,Schone J,et al. Detection of viridiofungin A and other antifungal metabolites excreted by Trichoderma harzianum active against different plant pathogens[J]. European Journal of Plant Pathology,2009,124(3):457-470.
[4]An Y J,Kang S C,Ki-Deok K K,et al. Enhanced defense responses of tomato plants against late blight pathogen Phytophthora infestans by pre-inoculation with rhizobacteria[J]. Crop Protection,2010,29(12):1406-1412.
[5]Li L Y,Jiang J Z,Guo W. Screening of antagonistic bacteria against Phytophthora infestans and its inhibition effect[J]. Plant Diseases and Pests,2011,2(3):49-51,55.
[6]刘月,蒋继志,郭俊亭,等. 致病疫霉拮抗放线菌的筛选及抑菌作用初步研究[J]. 河北农业大学学报,2012,35(3):82-85.
[7]蒋继志,郭俊亭,李丽艳. 致病疫霉拮抗真菌研究进展[J]. 河北大学学报:自然科学版,2012,32(1):105-112.
[8]蒋继志,孙琳琳,郭会婧,等. 几种微生物提取物诱导马铃薯抗晚疫病及机理的初步研究[J]. 植物病理学报,2010,40(2):173-179.
[9]蒋继志,张蕾,刘璇,等. 致病疫霉拮抗内生细菌的筛选及离体防病作用[J]. 河北农业大学学报,2013,36(2):75-79.
[10]Rodriguez H,Rico S,Diaz M,et al. Two-component systems in Streptomyces:key regulators of antibiotic complex pathways[J]. Microbial Cell Factories,2013,12:127-136.
[11]周德庆. 微生物学实验手册[M]. 上海:上海科学技术出版社,1986:65-70.
[12]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:353-356.
[13]王德培,孟慧,管叙龙,等. 解淀粉芽孢杆菌BI2的鉴定及其对黄曲霉的抑制作用[J]. 天津科技大学学报,2010,25(6):5-9.
[14]李双东,曹克强. 枯草芽孢杆菌EB228对马铃薯晚疫病菌的抑菌作用及防病效果[J]. 安徽农业科学,2009,37(24):11376-11378.
[15]Daayf F,Adam L,Fernando W D. Comparative screening of bacteria for biological control of potato lateblight(strain US-8),using in-vitro,detached-leaves,and whole-plant testing systems[J]. Calif J Plant Pathol,2003,25(3):276-284.
[16]姜军坡,范会兰,王伟,等. 牛源肠道益生菌芽孢杆菌BN-9菌株的分离鉴定[J]. 湖北农业科学,2009,48(1):142-146.
[17]Sutyak K,Wirawan R E,Aroutcheva A A,et al. Isolation of the Bacillus subtilis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amylaliquefaciens[J]. Journal of Applied Microbiology,2008,104(4):1067-1074.
[18]于靓,程德勇,熊儒先,等. 解淀粉芽孢杆菌T1增殖培养基配方及培养条件优化[J]. 湖北农业科学,2014,53(15):3621-3624.
[19]郭尧,李丽,蒋继志,等. 致病疫霉拮抗放线菌Sy11发酵条件的优化[J]. 河北农业大学学报,2014,37(2):71-75.
[20]吴真真,蒋继志,汪洁,等. 致病疫霉拮抗细菌SR13-2菌液稳定性研究[J]. 中国植保导刊,2013,33(8):9-12,8.
[21]陈成,崔堂兵,于平儒. 一株抗真菌的解淀粉芽孢杆菌的鉴定及其抗菌性研究[J]. 现代食品科技,2011,27(1):36-39.郝蔚,王丽丽,景伟文,等. 接种落叶型黄萎病菌棉株的棉酚和单宁含量与抗病性的关系[J]. 江苏农业科学,2016,44(2):147-151.
