抗轮纹病苹果砧木1—1—10—8茎尖培养快繁体系建立
2016-04-11陈晓洁郑伶杰李方方李忠勇
陈晓洁++郑伶杰++李方方++李忠勇++张学英+++徐继忠
摘要:以抗轮纹病苹果砧木1-1-10-8的茎尖为外植体,通过研究培养基中不同植物生长调节剂配比对芽苗诱导、增殖和生根的影响,筛选出适合苹果砧木1-1-10-8茎尖组培快繁的培养基配方。结果表明:1-1-10-8砧木外植体材料经0.1%HgCl2浸泡处理10 min的消毒效果最好,外植体成活率较高,为65%;以MS为基本培养基,添加蔗糖 35 g/L、琼脂6.2 g/L,适宜启动培养的植物生长调节剂配比为6-BA 1.0 mg/L+NAA 0.05 mg/L;适宜增殖培养的植物生长调节剂配比为6-BA 1.0 mg/L+NAA 0.075 mg/L,增殖系数可达到每4周12.71倍;以1/2MS为基本培养基,附加蔗糖15 g/L、琼脂6 g/L,适宜组培苗生根的植物生长调节剂配比为IAA 1.0 mg/L+IBA 0.6mg/L,生根率达 98.06%,每株苗平均生根7.89条,移栽成活率达92.38%。
关键词:苹果砧木;茎尖培养;组培快繁;植物生长调节剂
中图分类号: S436.611.1+9文献标志码: A
文章编号:1002-1302(2016)02-0051-03
收稿日期:2015-01-26
基金项目:河北省科技项目(编号:14226307D-5);公益性行业(农业)科研专项(编号:201203075-05)。
作者简介:陈晓洁(1989—),女,河北张家口,硕士研究生,主要从事果树栽培生理研究。E-mail:15933593516@163.com。
通信作者:徐继忠,博士,教授,博士生导师,主要从事果树生物技术、果树栽培生理与生态研究。E-mail:xjzhxw@126.com 。
苹果轮纹病,是由轮纹病病原菌(Botryosphaeria dothidea)引起的真菌性病害,已成为威胁苹果产业的重大病害之一[1-2]。苹果轮纹病不仅危害苹果果实,造成烂果,降低果实品质,而且危害枝干,削弱树势,影响结果年限,严重时造成枝干枯死[3]。近年来,果实套袋技术的推广使苹果果实轮纹病的发生受到抑制,但枝干轮纹病却日趋严重,成为苹果生产中的瓶颈问题。苹果枝干轮纹病在高温多雨地区发病严重,杨军玉等统计分析发现全国除了甘肃和黑龙江较轻外,苹果枝干轮纹病在各地均发生严重[4]。目前,生产上对苹果枝干轮纹病的防治主要是采取重刮皮结合施用化学农药的措施[5],但是这些措施很难根除苹果枝干轮纹病的发生,且刮树皮、施药等需要耗费较多的人力、物力[6],长期大量使用化学农药不仅会增加果实的农药残留,严重影响着苹果果实的质量与安全,而且容易使轮纹病菌对化学药剂产生抗性[7-9]。所以寻求一条能够安全有效解决苹果枝干轮纹病的正确途径成为苹果产业亟待解决的关键问题。
选用轮纹病抗性砧木是防治苹果枝干轮纹病安全有效的方法之一。研究表明,采用抗轮纹病的砧木能够增强树体对苹果轮纹病的抗性,有效降低苹果轮纹病的发病率[6,10-12]。姜忠武等从鸡冠自然杂交实生苗中选育出的“烟砧1号”砧木对苹果轮纹病菌具有抗性,以其作中间砧的富士枝干轮纹病的发病率比未嫁接中间砧的富士降低59.3%[10]。因此,选育优良抗轮纹病苹果砧木成为果树育种工作人员的迫切任务之一。
应用抗轮纹病砧木防治苹果枝干轮纹病的首要任务是生产培育健壮的抗轮纹病自根砧木苗。自根砧的繁殖方式主要有种子繁殖、扦插、压条与组织培养等[13],其中组织培养技术是快速稳定高效繁殖苗木的最佳方式[14]。1-1-10-8砧木是由河北农业大学园艺学院苹果课题组经田间自然发病调查和接菌试验鉴定的抗轮纹病苹果砧木,对防治苹果枝干轮纹病具有重要利用价值,迄今对1-1-10-8砧木组培快繁的研究尚未见报道。本试验以抗轮纹病苹果砧木1-1-10-8为试材,采用茎尖培养的方法,通过调节培养基的激素配比,筛选出适宜于苹果砧木1-1-10-8诱导成活、增殖与生根的最佳培养基配方,建立其快速繁殖体系,为进一步研究轮纹病的防治奠定基础。
1材料与方法
1.1试验材料
2014年3月下旬,自河北省保定顺平县滕家庄村苹果试[LM]验园剪取具饱满芽的1-1-10-8砧木未萌芽枝条,清水冲洗干净后置于光照培养箱内水培,培养条件为:光/暗周期12 h/12 h,光照条件下温度为(24±2) ℃,黑暗条件下温度为(15±2) ℃,空气湿度保持70%以上,每天喷雾保湿并更换清水。芽萌发后取2.0 cm以上的嫩梢作为外植体,用流水冲洗干净,置于100 mL三角瓶中备用。
1.2试验方法
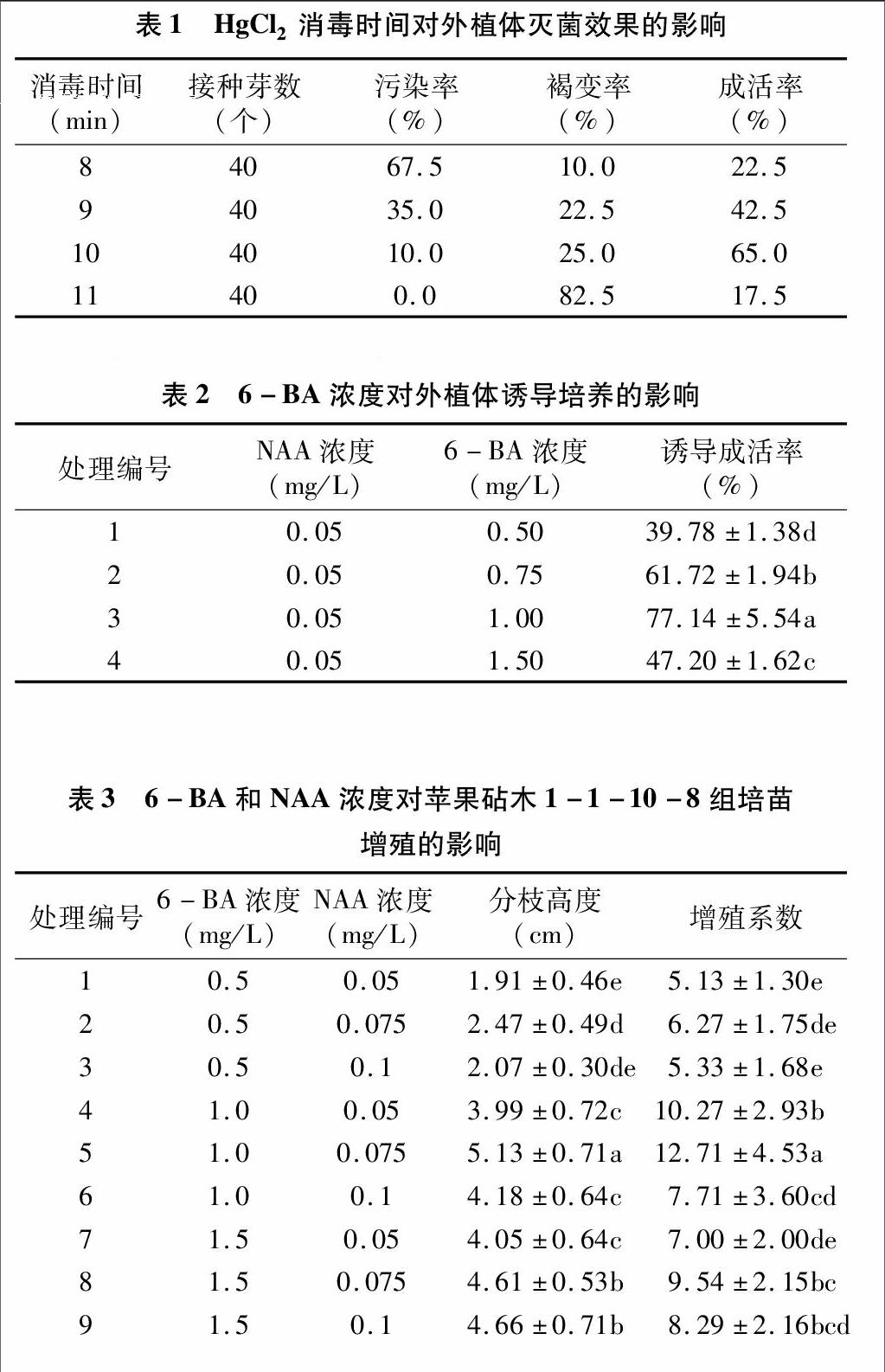
1.2.1外植体的消毒时间对接种成活的影响在超净工作台上用0.1% HgCl2溶液进行消毒处理,消毒时间设置8、9、10、11 min 4个处理,0.1% HgCl2溶液浸泡后,用无菌水冲洗 4~5次,然后用枪状镊取出置于无菌的玻璃皿中,最后切除外植体伤口部位褐变的部分,接种于启动培养基上。启动培养基选用苹果组织培养通用培养基(MS+蔗糖30 g/L+琼脂 6 g/L+6-BA 1.0 mg/L+NAA 0.05 mg/L),2周后调查污染率和外植体成活情况。
1.2.2外源激素对苹果砧木1-1-10-8启动培养的影响启动培养基以MS为基本培养基,其中蔗糖35 g/L,琼脂 6.2 g/L,pH值为6.0~6.5,NAA浓度为0.05 mg/L保持不变,将6-BA设为0.5、0.75、1.0、1.5 mg/L 4个浓度梯度,共4个处理,重复3次。接种后置于光照培养室内培养,培养温度为(25±2) ℃,光照度2 000~3 000 lx,光/暗周期各12 h交替。接种25 d后,统计诱导成活率。
诱导成活率=诱导成活外植体数/接种外植体数×100%。
1.2.3外源激素对1-1-10-8组培苗继代增殖的影响继代培养基以MS为基本培养基,其中蔗糖35 g/L、琼脂 6.2 g/L,6-BA设为0.5、1.0、1.5 mg/L 3个浓度梯度,NAA 设为0.05、0.075、0.1 mg/L 3个浓度梯度,两两组合,共9个处理。选取启动培养基中生长健壮一致的芽苗,分别接种至上述9种不同继代培养基中,每个处理20株,重复3次,培养条件与启动培养保持一致。接种后4周左右统计接芽的增殖系数和分枝高度。
[JZ]增殖系数=增殖茎尖数/接种茎尖数。
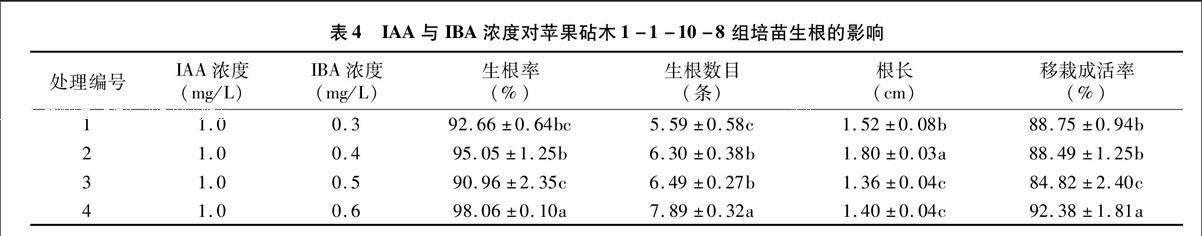
1.2.4外源激素对J35-8组培苗生根的影响选择健壮情况一致、高于2.0 cm的继代苗,分别接种于不同生根培养基中。生根培养基以1/2MS为基本培养基,附加蔗糖15 g/L,琼脂6 g/L,IAA浓度为1.0 mg/L保持不变,IBA设置为0.3、0.4、0.5、0.6 mg/L 4个浓度梯度,每个处理20株,重复3次,培养条件同启动培养。接种20 d后统计生根率、根数和根长,评价生根苗生长状态。
生根率=诱导生根茎段数/接种茎段数×100%。
1.2.5炼苗与移栽生根培养20 d,移至温室中炼苗,1周后去除封口膜,再锻炼2~3 d后移栽至营养钵中。蛭石和草炭等体积混合后用0.1%多菌灵溶液杀菌配制成培养基质,培养基质的湿度以“手握成团不滴水,落地即散”为宜。将基质装入事先准备好的营养钵中,栽入生根苗。移栽后立即用0.1%的多菌灵溶液浇透,覆盖棚膜,保温保湿。1周左右开始放风锻炼,经过2周左右揭开棚膜,3周后长出新叶,统计成活率。
移栽成活率=移栽成活株数/总移栽株数×100%。
2结果与分析
2.1HgCl2消毒时间对外植体消毒效果的影响
由表1可知,HgCl2消毒时间对外植体成活具有较大影响,在8~11 min之间,随消毒时间延长,外植体真菌污染率呈降低趋势,消毒处理11 min时外植体的污染率为0;但消毒时间越长外植体褐变率也越高,消毒处理11 min的褐变率高达82.5%。消毒处理10 min时,外植体污染率和褐变率控制在较低水平,分别为10.0%和25.0%,外植体接种成活率最高,为65.0%,所以1-1-10-8砧木外植体消毒的最适时间为10 min。
2.2不同6-BA浓度对芽诱导的影响
由表2可知,NAA浓度为0.05 mg/L不变,6-BA的浓度对外植体诱导成活有较大的影响,6-BA浓度在0.5~1.5 mg/L 范围内,外植体成活率呈显先升高后降低的规律,6-BA 浓度为1.0 mg/L时,外植体诱导成活率最高,为7714%。因此认为,本试验中最适宜于抗轮纹病苹果砧木1-1-10-8启动培养的植物生长调节剂配比为NAA 0.05 mg/L+6-BA 1.0 mg/L。
2.3不同6-BA与NAA配比对组培苗继代增殖的影响
由表3可知,6-BA浓度一定,NAA浓度在0.05~0.10 mg/L 范围内,继代苗的增殖系数和分枝高度均呈显先上升后下降的趋势。增殖系数最高的是处理5,为12.71,显著高于其他处理;其次为处理4,增殖系数为10.27;处理1的
增殖系数最低,仅5.13,不足处理5和处理4的1/2。分枝高度最高的也是处理5,为5.13 cm,其次为处理9和处理8,分枝高度分别为4.66 cm和4.61 cm,再次为处理4,分枝高度为3.99 cm,分枝高度最小的是处理1,低于2 cm。所以,处理5更适宜应用于抗轮纹病苹果砧木1-1-10-8的增殖培养,其植物生长调节剂配比为6-BA 1.0 mg/L+NAA 0.075 mg/L。
2.4不同IAA与IBA配比对组培苗生根及移栽成活率的影响
由表4可知,各处理的外植体材料均容易生根,生根率均达90%以上,平均生根5条以上,根长为1.36 cm以上,且较易移栽成活。当IAA浓度为1.0 mg/L、IBA浓度为0.6 mg/L时, 不论生根率、生根数目和成活率都显著高于其他处理,生根率为98.06%,每株生根苗平均生根7.89条,移栽成活率高达92.38%。因此,较适宜于苹果抗轮纹病砧木1-1-10-8组培苗的生根的培养基为1/2MS+IAA 1.0 mg/L+IBA 0.6 mg/L。
3讨论与结论
外植体材料接种成活受多种因素的影响[15-19],如材料的种类、质量、消毒处理时间和启动培养基配方等。褐变和真菌污染是威胁苹果砧木外植体材料成活的2个最重要的影响因素,所以外植体材料消毒处理时间应综合考虑两者的影响,使外植体材料的褐变率和真菌污染率同时控制在较低水平下。试验证明1-1-10-8砧木外植体材料最适消毒时间为10 min,外植体污染率和褐变率较低,分别为10%和25%,外植体接种成活率高,为65%。
试验结果表明:抗轮纹病苹果砧木1-1-10-8的外植体经HgCl2消毒处理10 min,外植体褐变率和污染率较低,有利于外植体材料成活;适宜于1-1-10-8外植体启动培养的培养基配方为MS+6-BA 1.0 mg/L+NAA 0.05 mg/L;适宜于继代培养的培养基为MS+6-BA 1.0 mg/L+NAA 0.075 mg/L;最适生根培养基为1/2MS+IAA 1.0 mg/L+IBA 0.6 mg/L。
试验观察发现,苹果砧木1-1-10-8外植体材料接种成活后转至继代培养基中继代苗茎明显变细,但组培苗生长旺盛,增殖系数较高,组培苗生根和移栽成活不受影响。该现象可能与材料本身的遗传特性有关,也可能与激素配比有关,有待进一步证实。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]曹若彬.果树病理学[M]. 3版.北京:中国农业出版社,1997.
[2]王国平,窦连登.果树病虫害诊断与防治原色图谱[M]. 北京:金盾出版社,2002.
[3]国立耘,李金云,李保华,等. 中国苹果枝干轮纹病发生和防治情况[J]. 植物保护,2009,35(4):120-123.
[4]杨军玉,王亚南,王晓燕,等. 2011—2012年全国苹果病虫害发生概况和用药情况统计分析[J]. 北方园艺,2013(12):124-127.
[5]高艳敏,李广旭,沈永波,等. 苹果轮纹病药剂筛选与药剂配方[J]. 果树学报,2006,23(3):401-405.
[6]赵玲玲,宋来庆,李元军,等. 抗轮纹病苹果砧木‘烟砧一号抗病机理初探[J]. 园艺学报,2010,37(2):297-302.
[7]王英姿,张伟,刘保友,等. 山东省苹果轮纹病菌对戊唑醇的抗药性及其地理分布[J]. 果树学报,2010,27(6):961-964.
[8]苏平,周增强,侯珲,等. 苹果轮纹病菌对戊唑醇的敏感性检测[J]. 果树学报,2010,27(1):69-76.[HJ1.75mm]
[9]刘鹏,周增强,国立耘.苹果轮纹病菌对多菌灵、亚胺唑和丙环唑的敏感性[J]. 果树学报,2009,26(6):907-911.
[10][ZK(#]姜中武.苹果抗轮纹病新砧木——烟砧一号的选育[J]. 中国果业信息,2011,28(6):52-53.
[11]孙月丽.苹果砧木抗轮纹病鉴定方法及抗性砧木初选[D]. 保定:河北农业大学,2012:31.
[12]于秋香.抗轮纹病苹果砧木的筛选及其与抗性相关因子的研究[D]. 保定:河北农业大学,2010:31.
[13]王荣,沈向,黄翠香,等. 关于苹果砧木与自根砧快繁技术的综述[J]. 天津农业科学,2012,18(3):115-119.
[14]张庆田.几种苹果砧木组织培养技术的研究[D]. 泰安:山东农业大学,2007:7-20.
[15]杨冉,黄萍,祁珊珊,等. 柳枝稷种子组培快繁技术[J]. 江苏农业科学,2014,42(2):46-48.
[16]郑晓峰. 草莓组培育苗外植体的选择及茎尖组培快繁技术[J]. 中国南方果树,2008(6):58-60.
[17]陈丽静,于春叶,李浩戈,等. 南果梨茎尖离体快繁技术研究[J]. 中国农学通报,2011,27(31):168-173.
[18]于红梅,赵密珍,钱亚明,等. 海沃德猕猴桃带芽茎段的组织培养快繁技术[J]. 江苏农业科学,2014,42(11):78-79.
[19]代丽,王玖瑞,刘孟军,等. 酸枣组培快繁的影响因素[J]. 河北农业大学学报,2006,29(3):26-28,42.
