脱细胞胶原基质双层材料与骨髓间充质干细胞的生物相容性研究
2016-04-10南文滨徐志浩王永学陈红丽
南文滨 徐志浩 王永学 陈红丽
453003新乡医学院生命科学技术学院;河南省高校干细胞与生物技术治疗工程中心
脱细胞胶原基质双层材料与骨髓间充质干细胞的生物相容性研究
南文滨 徐志浩 王永学 陈红丽
453003新乡医学院生命科学技术学院;河南省高校干细胞与生物技术治疗工程中心
目的对脱细胞胶原基质双层材料和骨髓间充质干细胞(BMSCs)间的生物相容性进行研究。方法将BMSCs与脱细胞胶原基质双层材料共培养作为实验组,单独培养的BMSCs为对照组,对BMSCs的生长和增殖情况进行研究,扫描电镜下观察细胞在材料上的贴附生长情况,并采用CCK-8法测定细胞活性。结果扫描电镜结果显示BMSCs在脱细胞胶原基质双层材料上生长良好。CCK-8法测得的BMSCs与脱细胞胶原基质双层材料共培养的生长曲线显示,实验组与对照组间差异无统计学意义(P>0.05)。结论脱细胞胶原基质双层材料具有较好的生物相容性,这为脱细胞胶原基质组织工程支架双层材料下阶段在体内动物中的应用提供了科学依据。
骨髓间充质干细胞;生物相容性;脱细胞胶原基质材料
Fund program:Natural Science Foundation of China(U1304819);Scientific Research Fund of Xinxiang Medical University(2014QN137)
0 引言
创面的愈合是一个由细胞、细胞外基质及细胞因子多因素共同参与并高度协调、相互调控的复杂生物学过程[1]。对于大面积皮肤创伤和慢性皮肤创伤,皮肤组织的自我修复能力有限,需要人为干预促进创口愈合。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为干细胞的一种,具有自我更新及全向分化为特定细胞群的能力,其用于修复皮肤创伤显示出良好的效果,因此常被作为皮肤组织工程的种子细胞。
在皮肤组织工程中,所制备的生物材料需具备相应的物理化学性能,并具有较好的生物相容性来确保可应用于临床。皮肤组织脱细胞材料具有良好的生物相容性,但其机械强度不高;而胶原材料具有较强的机械强度,但持有营养成分能力不强,难以支持细胞在支架中生长。笔者将这两种材料交联形成双层脱细胞胶原基质材料,评价其与BMSCs的相容性,以期这两种材料可发挥各自优点,为组织工程皮肤应用于临床实践提供参考。
组织工程研究中对制备材料的生物相容性的检测分为动物体内和体外细胞实验检测。动物体内实验检测是将材料植入模型动物中检测材料的生物相容性,而体外细胞实验检测是直接观察材料对细胞的生长、代谢、周期及增殖等方面的影响,较动物体内实验更直观,本研究采用的便是体外细胞实验检测。
本研究从雌性小鼠体内筛选出BMSCs,然后运用流式细胞技术检测BMSCs表面干性标记,再用CCK-8法测定细胞生长曲线,并用扫描电镜观察BMSCs在双层脱细胞胶原基质材料上的生长状态,从而评价双层脱细胞胶原基质材料与BMSCs的生物相容性,为进一步开展组织工程化人工器官的研究及临床应用提供相应的科学依据。
1 材料与方法
1.1 主要材料与仪器
6周龄健康昆明种小鼠(清洁级,体质量20~22g)(新乡医学院实验动物中心),DMEM/F12培养基(美国Sigma-Aldrich公司)、D-Hank's、胰酶、胎牛血清、双抗(美国Life公司),CCK-8试剂盒(上海碧云天生物技术有限公司),CD29-PE抗体、CD44-FITC抗体(美国BD公司),胶原溶胀液(以猪皮为原料,采用胃蛋白酶消化法自制,主要成分为I型胶原,含量>95%)。
恒温细胞培养箱(美国Shellab公司)、FACS Calibur流式细胞仪(美国BD公司),BX-4096扫描电镜(日本电子株式会社),SpectraMax Plus384酶标仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 脱细胞胶原基质材料的制备
将猪源真皮皮片放入含30 ml 0.05%胰蛋白酶的离心管中,4℃过夜后用PBS冲洗;加入新的胰蛋白酶液37℃水浴1 h;然后放入冰箱4℃20 min,再放入超低温冰箱-70℃1 h,再37℃水浴5 min,如此循环3次;最后用PBS冲洗,将其置于冷冻干燥机内冻干,与胶原溶胀液按体积比1∶1复合后,用体积分数为0.3%的戊二醛溶液交联。采用放射方式进行消毒处理,封装备用。
1.2.2 小鼠BMSCs的体外分离培养
用体积分数为10%的水合氯醛麻醉小鼠,切取小鼠四肢的股骨和胫骨;以DMEM/F12培养基穿刺冲洗股骨和胫骨的骨髓腔,并对冲洗液进行过滤处理,12 000 r/min离心3~5 min,再用含体积分数为10%胎牛血清的DMEM/F12培养基重悬培养。每天换液,约10 d后细胞生长至80%,使用胰酶消化并传代培养。约每3天传代1次,传至第4代时可见杂细胞较少,选取状态良好的第4代之后的细胞进行后续实验。
1.2.3 BMSCs的表面干细胞标记检测
将小鼠BMSCs消化后,用D-Hank's溶液重悬于流式细胞管中,使用流式细胞仪检测CD29、CD44等干细胞表面标记。
1.2.4 脱细胞胶原基质材料的预处理
取不同大小的脱细胞胶原基质材料分别置于24孔或96孔培养板中,使用含血清的DMEM/F12培养基孵育培养板约48 h。
1.2.5 脱细胞胶原基质材料与BMSCs共培养的扫描电镜观察
将脱细胞胶原基质材料置入24孔培养板内,按上述方法孵育后,加入BMSCs悬液,置于细胞培养箱中培养;培养4~5 d后取出材料,用甲醛固定,临界点干燥,镀金膜,最后在扫描电镜下观察细胞在材料上的附着情况。
1.2.6 CCK-8法测定细胞生长曲线
取合适大小的脱细胞胶原双层基质材料置于96孔培养板中按1.2.4所述方法预处理。取7块96孔培养板,每块培养板分为2组,加入脱细胞胶原基质双层材料的作为实验组,未加入材料的为对照组,每组8孔。将小鼠BMSCs接种于96孔板中,置于细胞培养箱中进行培养,每天换液。于细胞接种后的7 d内,每天取1块板进行检测,向每孔中加入CCK-8试剂10 μl,在细胞培养箱内孵育4 h后,用酶标仪检测450 nm下的吸光度值,取平均值,绘制生长曲线。
1.3 统计学方法
利用SPSS13.0统计学软件处理数据,数据以均数±标准差(±s)表示,使用重复测量的方差分析进行组间比较,以P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs生长状态
原代培养的小鼠BMSCs在48 h内大部分贴壁,细胞呈短梭形、多边形,2周左右细胞呈成纤维细胞形态(图1);传代培养的BMSCs可在12 h内基本贴壁,细胞呈长梭形态。

图1 相差显微镜下原代小鼠骨髓间充质干细胞形态(×100)
2.2 流式细胞仪检测BMSCs表面抗原
研究表明,CD29和CD44是BMSCs的表面干性标记。传代至大约第5代时,大部分细胞为BMSCs。使用流式细胞仪对分离出的小鼠BMSCs进行检测,根据CD29及CD44的着色程度设定流式门,结果显示CD29+CD44+双阳性率为70.66%,证明分离出的细胞大部分为BMSCs。(图2)

图2 CD29和CD44表面干性标记的流式检测结果
2.3 脱细胞胶原基质材料与BMSCs共培养的扫描电镜观察
将脱细胞胶原基质材料与BMSCs共培养至第5天时,可见脱细胞胶原基质材料的表面有细胞附着,细胞形态正常,伸出伪足黏附在材料上,表明脱细胞胶原基质材料对细胞的贴附无影响。(图3)
2.4 细胞生长
采用CCK-8法检测脱细胞胶原基质材料对BMSCs增殖的影响。以细胞活度(吸光度值)绘制细胞生长曲线。由图4可知,实验组和对照组在一周内随时间延长细胞活性均呈增加的趋势,且两组生长曲线间差异无统计学意义(P>0.05)。
3 讨论与结论

图3 脱细胞胶原基质材料与骨髓间充质干细胞共培养第5天的扫描电镜图(×100)
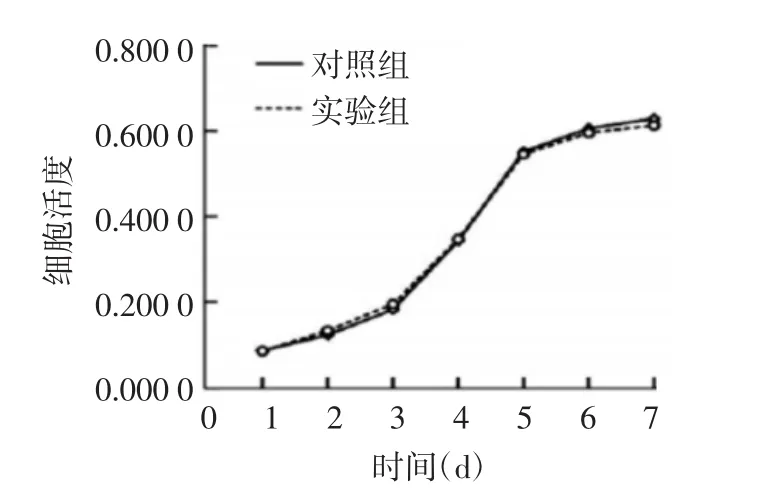
图4 对照组和实验组骨髓间充质干细胞1周内的生长曲线
当人因外伤、疾病等原因导致皮肤缺损时,具有多能性的皮肤干细胞可增殖分化为多种细胞,完成对皮肤的修护,因此,皮肤干细胞引起了科学家们越来越多的关注。BMSCs具有能进行自我复制、快速增殖、多能性等特点,在特定条件下可形成骨、软骨、成纤维细胞等多种细胞[2-8]。CD29和CD44是BMSCs的表面干性标记[9-10]。使用流式细胞仪对分离出的BMSCs进行检测,结果显示CD29阳性率为80.9%,CD44阳性率为72.91%,证明分离出的细胞大部分为BMSCs。本研究使用CCK-8法检测脱细胞胶原基质双层材料对BMSCs增殖的影响,发现实验组和对照组在一周内随时间延长细胞活性均呈增加的趋势,且两组生长曲线间差异无统计学意义,由此可见脱细胞胶原基质双层材料对BMSCs的生长无毒性。
皮肤组织脱细胞材料具有良好的组织相容性[11-18],而胶原材料具有较强的机械强度,将两者交联形成双层材料以更好地发挥各自优点,该双层材料与干细胞复合在皮肤损伤方面具有良好的应用前景。然而,该复合材料要应用于临床还需检测其生物相容性。本研究在扫描电镜下观察到BMSCs可在脱细胞胶原基质双层材料的表面正常生长,且状态良好。CCK-8法的检测结果显示BMSCs的增殖功能良好,表明脱细胞胶原基质双层材料对小鼠BMSCs的生长无毒性。综上所述,脱细胞胶原基质双层材料与BMSCs具有较好的生物相容性,该研究结果为此复合材料的应用提供了科学依据。
[1]Falanga V.Wound healing and its impairment in the diabetic foot[J]. Lancet,2005,366(9498):1736-1743.DOI:10.1016/S0140-6736(05) 67700-8.
[2]Zhu XL,Eibl O,Scheideler L,et al.Characterization of nano hydroxyapatite/collagen surfaces and cellular behaviors[J].J Biomed Mater Res A,2006,79(1):114-127.DOI:10.1002/jbm.a.30706.
[3]Sato M,Aslani A,Sambito MA,et al.Nanocrystalline hydroxyapatite/titania coatings on titanium improves osteoblast adhesion[J].J Biomed Mater Res A,2008,84(1):265-272.DOI:10.1002/jbm.a. 31469.
[4]Wang DP,Han Y,Zhu WM,et al.Nano-hydroxyapatite artificial bone with different pore sizes to repair radial defect in rabbits[J].J Clin Rehabil Tiss Eng Res,20071,11(48):9641-9645.
[5]Chen R,Curran SJ,Curran JM,et al.The use of poly(L-lactide)and RGD modified microspheres as cell carriers in a flow intermittency bioreactor for tissue engineering cartilage[J].Biomaterials,2006, 27(25):4453-4460.DOI:10.1016/j.biomaterials.2006.04.011.
[6]Webster TJ,Ergun C,Doremus RH,et al.Enhanced functions of osteoblasts on nanophase ceramics[J].Biomaterials,2000,21(17): 1803-1810.DOI:10.1016/S0142-9612(00)00075-2.
[7]Kim HT,Zaffagnini S,Mizuno Shuichi,et al.A peek into the possible future of management of articular cartilage injuries:gene therapy and scaffolds for cartilage repair[J].J Orthop Sports Phys Ther,2006,36(10):765-773.DOI:10.2519/jospt.2006.2284.
[8]Wang XJ,Li YB,Wei J,et al.Development of biomimetic nanohydroxyapatite/poly(hexamethylene adipamide)composites[J]. Biomaterials,2002,23(24):4787-4791.DOI:10.1016/S0142-9612 (02)00229-6.
[9]Balasundaram G,Sato M,Webster TJ.Using hydroxyapatite nanoparticles and decreased crystallinity to promote osteoblast adhesion similar to functionalizing with RGD[J].Biomaterials,2006, 27(14):2798-2805.DOI:10.1016/j.biomaterials.2005.12.008.
[10]Torekov SS,Larsen LH,Glümer C,et al.Evidence of an association between the Arg72 allele of the peptide YY and increased risk of type 2 diabetes[J].Diabetes,2005,54(7):2261-2265.DOI:10.2337/ diabetes.54.7.2261.
[11]Pan YS,Xiong DS,Gao F.Viscoelastic behavior of nano-hydroxyapatite reinforced poly(vinyl alcohol)gel biocomposites as an articular cartilage[J].J Mater Sci Mater Med,2008,19(5):1963-1969.DOI: 10.1007/s10856-007-3280-6.
[12]Itoh S,Kikuchi M,Takakuda K,et al.The biocompatibility and osteoconductiveactivityofanovelhydroxyapatite/collagen composite biomaterial,and its function as a carrier of rhBMP-2[J].J Biomed Mater Res,2001,54(3):445-453.DOI:10.1002/1097-4636 (20010305)54:33.3.CO;2-0.
[13]Wang AJ,Ao Q,Cao WL,et al.Fiber-based chitosan tubular scaffolds for soft tissue engineering:fabrication and in vitro evaluation[J].Tsinghua Sci Technol,2005,10(4):449-453.DOI:10. 1016/S1007-0214(05)70099-7.
[14]Taylor JC,Cuff SE,Leger JP,et al.In vitro osteoclast resorption of bone substitute biomaterials used for implant site augmentation:a pilot study[J].Int J Oral Maxillofac Implants,2002,17(3):321-330.
[15]李声伟,田卫东.现代口腔修复前外科学[M].成都:四川大学出版社,2002:118-130. Li SW,Tian WD.Modern Oral Preprosthetic Surgery[M].Chengdu:Sichuan University Press,2002:118-130.
[16]Lee EO,Kim JD.Palmitoyl lysozyme-induced stabilization of PE (phosphatidylethanolamine)liposomes and their interaction with Candida albicans[J].J Biochem,1995,117(1):54-58.
[17]伍耀宏,徐宝山,杨强,等.软骨脱细胞细胞外基质多孔支架与山羊髓核细胞生物相容性研究[J].国际生物医学工程杂志, 2013,36(1):5-8.DOI:10.3760/cma.j.issn.1673-4181.2013.01.002. Wu YH,Xu BS,Yang Q,et al.Study of compatibility of acellular cartilage extracellular matrix-derived porous scaffolds with sheep nucleus pulposus cells[J].Int J Biomed Eng,2013,36(1):5-8.DOI: 10.3760/cma.j.issn.1673-4181.2013.01.002.
[18]张林朴.组织工程化口腔黏膜研究进展[J].国际生物医学工程杂志,2013,36(6):371-375.DOI:10.3760/cma.j.issn.1673-4181. 2013.06.013. Zhang LP.Research progress of tissue-engineered oral mucosa[J].Int J Biomed Eng,2013,36(6):371-375.DOI:10.3760/cma.j.issn.1673-4181.2013.06.013.
Biocompatibility of bone marrow mesenchymal stem cells on acellular collagen matrix double-layer material
Nan Wenbin,Xu Zhihao,Wang Yongxue,Chen Hongli
School of Life Science and Technology,Xinxiang Medical University;Stem Cell and Biotherapy Technology Research Center of Henan Province,Xinxiang 453003,China
Corresponding author:Chen Hongli,Email:chenhlhl@126.com
ObjectiveTo study the biocompatibility of bone marrow mesenchymal stem cells(BMSCs)on acellular collagen matrix double-layer material.MethodsBMSCs with acellular collagen matrix double-layer material were trained as experimental group,while separately cultured BMSCs as control group.The growth and proliferation of BMSCs on acellular collagen matrix double-layer material were investigated.Scanning electron microscope was used to observe the adherence of cells,and cell vitality was detected by CCK-8 method.ResultsThe acellular collagen matrix double-layer material did not influence the growth and proliferation of BMSCs.The difference between the growth curves of experimental group and control group was not significant(P>0.05).ConclusionsThe acellular collagen matrix double-layer material has acceptable biocompatibility.This research provides a scientific basis for the application of this composite material.
Bone marrow mesenchymal stem cells;Biocompatibility;Acellular collagen matrix doublelayer material
陈红丽,Email:chenhlhl@126.com
10.3760/cma.j.issn.1673-4181.2016.01.004
国家自然科学基金(U1304819);新乡医学院科研培育基金(2014QN137)
2015-10-15)
