丹参多糖对体外肝窦内皮细胞窗孔的影响
2016-04-10宋雨鸿韩棉梅卢艳娴翁立冬潘锦瑶
阳 金 宋雨鸿 黄 柱 韩棉梅 卢艳娴 翁立冬 潘锦瑶*
(1广州医科大学附属广州市第一人民医院,广东 广州 510180;2江门市五邑中医院,广东 江门 529031;3南方医科大学中医药学院,广东 广州 510515)
·临床研究·
丹参多糖对体外肝窦内皮细胞窗孔的影响
阳 金1宋雨鸿1黄 柱1韩棉梅1卢艳娴2翁立冬3潘锦瑶1*
(1广州医科大学附属广州市第一人民医院,广东 广州 510180;2江门市五邑中医院,广东 江门 529031;3南方医科大学中医药学院,广东 广州 510515)
目的:探讨并观察丹参多糖(SMPS)对体外肝窦内皮细胞(LSEC)窗口的影响。方法:SMPS灌胃大鼠提取的血清干预脂多糖(LPS)刺激的LSEC,检测细胞上清液中的血管活性物质内皮素-1(ET-1)、前列腺素E2(PGE2)的含量,细胞小窝蛋白-1(Cav-1)、α 平滑肌肌动蛋白 (α SMA)的表达及LSEC窗口数目面积的变化。结果:SMPS能降低细胞上清中ET-1、PGE2的含量,减少Cav-1、α SMA表达,并使肝窦内皮细胞窗孔数目增多、孔径增大。结论:SMPS通过对体外LSEC的干预,改善肝脏循环起到保护肝脏的作用。
丹参多糖;体外;肝窦内皮细胞
体外肝窦内皮细胞(liver sinusoidal endothelial cell,LSEC)属于肝脏的非实质细胞,占肝脏非实质细胞群中44%左右。肝窦是肝脏物质交换的场所,所以肝窦内皮细胞对于维持肝脏的正常功能具有十分重要的作用[1-3]。血清干预脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌膜上的复合物,可刺激内皮细胞分泌细胞因子,如(endothelin-1,ET-1)、前列腺素E2(prostaglandin E2,PGE2),导致肝细胞大量坏死与炎症细胞浸润,引起肝损伤[4-5]。丹参为中国的传统中药, 丹参多糖(salvia miltiorrhiza polysaccharides,SMPS)是丹参中有效成分,有关丹参多糖对急性肝损伤的研究已有不少报道,目前大量研究丹参多糖与肝窦内皮细胞多为体内造模肝脏整体情况,即脂多糖诱导的小鼠急性肝损伤模型,很少有研究体外肝窦内皮细胞。前期本课题组研究了丹参多糖对急性肝损伤有保护作用,其机制与LSEC窗孔的改变有关,为了进一步排除肝脏内其他细胞如枯否细胞、星状细胞、隐藏窝细胞的影响,通过细胞实验形式对体外培养的LSEC进行造模,用LPS刺激LSEC造成细胞损伤从而引起肝脏微循环障碍,再通过含丹参多糖的含药血清干预刺激的LSEC,最后检测体外细胞培养中细胞小窝蛋白-1(caveolin-1,Cav-1)、α平滑肌肌动蛋白(alpha-sooth muscle actin,α-SMA)的表达以及ET-1和NO的含量,观察其对LSEC的影响,探索窗孔的调节机制,及丹参多糖对该调节的影响。
1 材料和方法
1.1 材料
1.1.1 动物 SD大鼠,体质量(180~220)g,40只,SPF级,雌雄各半,购于湖南莱克斯景达实验动物有限公司,动物许可证号:SCXK(湘)2013-0004。湖南莱克斯景达实验动物有限公司。动物房保持通风,干燥,室温22~25 ℃,湿度维持在50%~70% ,自由饮水,鼠料定量喂养。
1.1.2 细胞 LSEC购买于赛百慷(上海)生物技术股份有限公司,其公司的采用免疫细胞化学鉴定。LSEC核周及胞浆周围出现黄绿色荧光,胞核呈蓝色荧光,表明CD14染色阳性,阳性率大于95%,如图1。

图1 LSEC的CD14免疫细胞化学染色结果
1.1.3 药物 丹参多糖由南方医科大学中医药学院中药制剂教研室翁立冬老师提供,按照专利(一种从丹参中提取多糖的方法,公开号:200810026249. 4)的方法提取丹参多糖。本实验所提取的丹参多糖为粗提物,纯度>70%。
1.1.4 试剂 脂多糖L2880购于美国Sigma 公司,胎牛血清(南美)购于美国GIBCO公司,DMEM高糖培养液、青霉素-链霉素溶液、胰酶溶液0.25%(含酚红含EDTA)、磷酸盐缓冲液(PBS)购于美国Genom公司,大鼠ET-1 、大鼠前列腺E2(PG-E2)ELISA试剂盒购于CUSABIO公司,产品编号分别为:E06979r/Lot:O29010812、CSB-E07967r/Lot:C1624140194,Caveolin-1、a-SMA抗体购买于 ABCAM 公司。1.1.5 仪器 酶标仪(南京华东电子集团医疗装备有限责任公司,DG5033A型);和泰凯弗隆实验室纯水系统(上海和泰仪器有限公司,Ultra Pure UF型);电热恒温水浴箱(上海一恒科技有限公司,CU-420型);移液枪(10,100,200,1 000 μL);XTJ-4400光学显微镜(深圳市斯威冠光学仪器有限公司);S-3000N扫描电子显微镜(日立公司)等等。
1.2 方法
1.2.1 含药血清的提取 40只体质量为180~220 g的SD大鼠,雌雄各半,按完全随机分为4组,分别以3.6 g/kg、1.8 g/kg、0.9 g/kg 的丹参多糖药液和0.9%生理盐水连续灌胃1周,末次给药2 h后固定大鼠腹主动脉取血,不加抗凝剂,室温静置30 min,取上清,4 ℃ 3 000 rpm(r=8 cm)离心15 min,56 ℃灭活30 min,过0.22 um微孔滤膜除菌,制备的含药血清分装于-70 ℃冰箱保存备用。
1.2.2 LSEC 的体外培养刺激与干预 ①传代培养LSEC:将细胞悬液用吸管移入6 孔板中加入培养液控制浓度为1.5×106/mL个细胞,分为正常对照组、模型组、丹参多糖高剂量组、中、低剂量组。②刺激干预:用浓度为100 μg/L的LPS刺激模型组、丹参多糖高剂量组、中、低剂量组的LSEC,并将含药血清对应加入丹参多糖高剂量组、中、低剂量组,各组含药血清的终浓度均为10% ,培养细胞48 h后分别收集培养上清及细胞。
1.2.3 电镜样本制备及观察 将1 cm×2 cm的无菌盖玻片放于6孔板中,然后将细胞悬液用吸管移入6孔板中 ,集中于盖玻片上,放于37 ℃、含5%CO2孵育箱中培养,接种2 h 后更换培养液,培养48 d待细胞长满盖玻片后,按上述刺激干预加药处理48 h,再用PBS冲洗3遍,将盖玻片放入1.5%的戊二醛固定液固定,用乙醇梯度脱水发将SLEC进行脱水,脱水后将样品用临界点干燥仪进行CO2临界点干燥。干燥完后置于扫描电镜下观察LSEC窗口的大小、数目及面积,每组选3个细胞,分别描记每个细胞窗口数目、面积。
1.2.4 指标检测 收集的上清液用ELISA检测ET-1、PGE2的含量,按试剂盒说明书步骤来检测;收集的细胞用Western Blotting检测Cav-1、α SMA的表达,实验步骤按说明书进行。
1.5 统计学处理
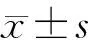
2 结 果
2.1 SMPS对LSEC ET-1、PGE2含量的影响
模型组上清液ET-1、PGE2的含量与正常对照组比较显著升高,差异有统计学意义(P<0.05),丹参多糖高中低组PGE2的含量与模型组相比都显著降低,差异有统计学意义(P<0.05),丹参多糖高、中剂量组ET-1与模型组相比显著降低,差异有统计学意义(P<0.05),但丹参多糖低剂量组ET-1下降不显著(P>0.05)。见表1。

表1 SMPS对LSEC ET-1、PGE2含量的影响
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05
2.2 SMPS对LSEC Cav-1、α -SMA表达的影响
Western Blotting的结果显示,与正常对照组,模型组细胞Cav-1、α-SMA的表达量显著增多(P<0.05)(图2、3)。与模型组相比,丹参多糖组细胞Cav-1、α-SMA的表达量显著减少(P<0.05)(图2、3)。且SMPS浓度越高,Cav-1、α -SMA表达减少量越多(图5)。

α-SMAGAPDH低剂量组中剂量组高剂量组模型组正常对照组
图2 Western Blotting检测LSEC α -SMA的表达

Cav-1GAPDH低剂量组中剂量组高剂量组模型组正常对照组
图3 Western Blotting检测LSEC Cav-1的表达
2.3 扫描电镜观察结果
按照以上实验步骤,每组得到的细胞电镜图像(图5)。正常对照组(5-A)LSEC窗孔数目多,孔径大,面积大,模型组(5-B)LSEC明显数目减少,几乎消失,表明肝细胞造模成功。丹参多糖高(5-C)、中(5-D)、低(5-E)剂量组较模型组数目稍增多,且丹参多糖浓度越高,窗孔数目增加越多,面积越大。所以SMPS对LSEC窗孔有明显的改变作用。

1.61.41.21.00.80.60.40.20α-SMAGAPDH低剂量组中剂量组高剂量组模型组正常对照组
图4 α -SMA、Cav-1在不同组别的表达情况示意图

BACDE注:A:正常对照组;B:模型组;C:丹参多糖高剂量组;D:丹参多糖中剂量组;E:丹参多糖低剂量组
图5 SMPS对LSEC窗孔的影响(箭头所指为LSEC窗孔)

注:在描记时,细胞不完整的、细胞表面被损坏或覆盖的排除,完整的细胞,直径超过100 nm的窗孔纳入统计范围。由于技术受限,此次实验的窗口数目及面积都是手工描绘后统计,有不可避免的误差,但是我们本着客观的原则,严格按照纳入标准执行,尽量避免人为因素,有效维护实验的客观性
图6 电脑软件描记细胞窗孔个数及面积
3 讨 论
目前有很多关于中药与肝病之间的研究,如丹参、黄芪等。丹参有保护肝细胞、改善肝脏微循环、促进肝细胞的修复与再生等药理作用[6],因此丹参及其复方制剂常用于肝脏疾病中。丹参为中国的传统中药,最早见于《神农本草经》,并被列为上品,丹参以唇形科多年生草本植物丹参的干燥根及根茎入药,具有广泛的药理活性。其味苦,气微寒,无毒。归心、肝经。具有活血调经、凉血消痈,清心安神的功效[7]。SMPS具有多种药理作用,主要有:①抗免疫性肝损伤及急性肝损伤的保护作用[8-9],SMPS能促进淋巴细胞增殖,抑制iNos、IFN-α及Il-1βmRNA基因表达,有免疫调节保护功能;SMPS还能降低LPS诱导的急性肝损伤模型小鼠MDA含量,升高GSH含量,降低血清AST含量从而起到保护急性肝损伤。②保护心肌细胞损伤[10]。SMP能通过增加心肌细胞活力和降低心肌细胞凋亡率,能明显增加心肌超氧化物歧化酶,有效保护H2O2所导致的心肌细胞损伤。③抗肿瘤作用[11]。丹参多糖不能像环磷酰胺一样杀死肿瘤细胞,但能明显抑制肿瘤细胞的蛋白质和核酸的合成从而抑制其生长,还能诱导肿瘤细胞凋亡,改变肿瘤细胞膜的生物特性等起到抗肿瘤的作用。④抗大鼠实验性肾损伤[12]。丹参根中提取到的多糖用于氨基核苷诱导的实验性肾病模型中,能减少尿蛋白的排泄[13],抑制血清胆固醇和脂质过氧化物浓度的提高,从而起到保护肾损伤的作用。此外还有降血糖[14]、降胆固醇[15]等作用。
目前大量研究丹参多糖与肝窦内皮细胞多为体内造模肝脏整体情况,即脂多糖诱导的小鼠急性肝损伤模型,很少有研究体外肝窦内皮细胞情况。为了进一步排除肝脏内其他细胞如枯否细胞、星状细胞、隐藏窝细胞的影响,通过细胞实验形式对体外培养的LSEC进行造模,用LPS刺激LSEC造成损伤从而引起肝脏微循环障碍,再通过含丹参多糖的含药血清干预刺激的LSEC,最后检测LSEC窗口数量及大小、ET-1、PGE2等指标的变化来说明丹参多糖在LPS介导LSEC激活中的作用。研究结果显示SMPS对LSEC的ET-1、PGE2的含量有显著升高,与模型组有显著差别,同时对LSEC的Cav-1、α SMA表达明显升高,并且明显增加了LSEC窗口的数目与面积,以上均反应出SMPS对LSEC有明显的保护作用,并改善肝脏循环,进一步对肝脏也起到很好的保护作用。
[1] Elvevold KH ,Nedredal GI,Revhaug A,et al. Scavenger properties of cultivated pig liver endothelial cells[J]. Comparatives Hepatology,2004,3(1):4.
[2] Nagai T,Yokomori H,Yoshimura K.Actin filaments around endothelial fenestrae in rat hepatic sinusoidal endothelial cells [J]. Med Electron Microsc,2004,37(4):252-255.
[3] Ueno T,Bioulac-Sage P,Balabaud C. Innervation of the sinusoidal wall: regulation of the sinusoidal diameter [J]. Anat Rec A Discov Mol Cell Evol Biol,2004,280(1):868-873.
[4] 刘丽萍,朱继红,成令忠. 肝血窦内皮细胞研究进展[J].解剖学进展,1999,5(2):102-106.
[5] 王自力,李占伟,穆 祥,等. 内毒素对微循环及血管内皮细胞功能影响的研究进展[J].动物医学进展,2003,24(6):45-48.
[6] 辛淑杰.丹参的药理作用及临床应用探讨[J].中国民族民间医药,2013(5):26 - 27.
[7] 刘 慧,开金龙. 丹参的现代研究进展[J].甘肃中医,2010,23(2) :70-72.
[8] 姚莹华,刘 强,陈育尧,等. 丹参多糖对小鼠急性肝损伤的保护作用[J].中国实验方剂学杂志,2010,6(6):227-229.
[9] 宋雨鸿,刘 强,徐 舒,等. 丹参多糖对小鼠免疫性肝损伤的保护作用[J].中南药学,2013,11 (5):345-348.
[10] Liu AH,Lin YH,Yang M,et al. Development of the fingerprints for the quality of the roots of Salviamiltiorrhiza and its related preparations by HPLC-DAD and LC-MSn[J]. Journal of Chromatograph, 2007,846:32-41.
[11] Liu L,Jia J,Zeng G,et al.Studies on immunoregulatory and anti-tumor activities of a polysaccharide from Salvia miltiorrhiza Bunge[J].Carbohydrate Polymers,2013,92(1):479-483.
[12] JCR Pharmaceuticals Co.LTD.Polyglucuronic acid as remitting agent for nephritic syndrome and hepatopathy symptoms:Europe,94305146.6 [P].1994-07-14.
[13] 汪 红,王 强,王顺贵,等. 丹参多糖的提取分离及结构鉴定[J].中国实验方剂学杂志,2010,16 (18):88-90.
[14] Niu J,Pi ZF,Yue H,et al.Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chrom atography-m ass spectrom etry[J]. Journal of Chrom atograpy B ,2012,907:7-12.
[15] Jang SI,Kim HJ,Kim YJ,et al. Tanshinone IIA inhibits LPS-induced NF-κBactivation in RAW 264.7 cells:Possible involvement of the NIK-IKK,ERK1/2,p38 and JNK pathways[J]. Eur J Pharmacol,2006,542(1-3):1-7.
(本文编辑:郑颖)
Effect of salvia miltiorrhiza polysaccharides on window of sinusoidal endothelial cells in vitro
YangJin1,SongYuhong1,HuangZhu1,HanMianmei1,LuYanxian2,WengLidong3,PanJinyao1*
(1GuangzhouFilstMunicipalPeople’sHospital,Guangzhou510180;2WuyiHospitalofTraditionalChineseMedicine,Jiangmen,Guangdong529031;3SchoolofTraditionalChineseMedicine,SouthernMedicalUniversity,Guangzhou510515,China)
*Correspondingauthor:Email:lpanjy@sina.com
Objective:To investigate the effect of salvia miltiorrhiza polysaccharides (SMPS) on the window of sinusoidal endothelial cells (LSEC) in vitro. Methods:The serum extracted from rats,which were given SMPS gavage,were used to intervene lipopolysaccharide (LPS) stimulated LSEC. The content of endothelin-1 (ET-1) and prostaglandin E2 (PGE2),expression of Caveolin-1 (Cav-1) and Alpha-smooth muscle actin (α-SMA),and the number and pore size of the LSEC window were measured in the vasoactive substances of the cell supernatant. Results: SMPS could decrease the contents of ET-1 and PGE2 in the supernatant of cells,decrease the expression of Cav-1 and α-SMA,and increase the number of the LSEC and the pore size. Conclusion: SMPS can improve the circulation of liver and protect the liver by intervention of LSEC in vitro.
salvia miltiorrhiza polysaccharides; in vitro; sinusoidal endothelial cells
10.3969/j.issn.2095-9664.2016.05.07
广州市医药卫生科技项目(20141A011003);广东省中医药局建设中医药强省科研课题(20131007)
*通讯作者:Email:lpanjy@sina.com
R81
A
2095-9664(2016)05-0030-04
2016-03-21)
