建立大鼠高肺血流性肺动脉高压模型的简易方法
2016-04-10郑周忠王燕飞陈欣欣
郑周忠 王燕飞 陈欣欣
(广州医科大学附属广州市妇女儿童医疗中心心脏中心,广东 广州 510623)
·论著·
建立大鼠高肺血流性肺动脉高压模型的简易方法
郑周忠 王燕飞 陈欣欣*
(广州医科大学附属广州市妇女儿童医疗中心心脏中心,广东 广州 510623)
目的:简化、改良建立大鼠高肺血流性肺动脉高压模型的方法。方法:采用腹主动脉-下腔静脉穿刺分流术建立大鼠高肺血流性肺动脉高压模型,并以组织黏合剂闭合腹主动脉左侧穿刺口。分流11周后,观察下腔静脉变化情况,通过右心导管术检测大鼠肺动脉压力,以血气分析方法测定动静脉血氧饱和度,分离右心室与左心室(包含室间隔)并计算右心室肥厚指数。结果:腹主动脉阻断时间少于2 min;11周后分流组大鼠下腔静脉明显增粗并存在震颤及动静脉血混合,其分流瘘口之上的下腔静脉血氧饱和度约等于腹主动脉血氧饱和度,但明显高于假手术组下腔静脉血氧饱和度(P<0.01),分流组大鼠平均肺动脉压及右心室肥厚指数显著高于假手术组(P<0.01)。结论:采用组织黏合剂的方法能简易、快速地完成腹主动脉-下腔静脉穿刺分流术,有效地建立大鼠高肺血流性肺动脉高压模型。
肺动脉高压;高肺血流;腹主动脉-下腔静脉穿刺分流术;组织黏合剂;大鼠
先天性心脏病(congenital heart disease,CHD)是小儿时期最常见的心脏病,肺动脉高压(pulmonary hypertension,PH)是CHD最严重而常见的并发症之一。数十年以来,PH一直是热门的心血管基础研究领域。目前大鼠腹主动脉-下腔静脉穿刺分流术是建立高肺血流性肺动脉高压动物模型的常用方法,而腹主动脉壁的穿刺口多数通过缝线缝合[1-5],但因为大鼠的血管较小,这给操作带来一定困难,容易造成腹主动脉狭窄,而且操作繁琐、效率不高。本课题采用组织黏合剂的方法对腹主动脉-下腔静脉穿刺分流术进行改良,有效地建立大鼠高肺血流性肺动脉高压模型。
1 材料与方法
1.1 实验材料
1.1.1 药品 生理盐水;75%乙醇;水合氯醛(上海江莱生物科技有限公司),临用前以生理盐水配成10%水合氯醛。
1.1.2 器材 12号一次性针头,Histoacryl组织黏合剂(规格0.5 mL/安瓶,REF1050052,购自贝朗医疗(上海)国际贸易有限公司),止血夹,1 mL注射器,橡皮筋5条,3-0、4-0幕丝非吸收缝线,纱块,医用棉签,解剖器械包1套,MP100多导生理记录仪(BIOPAC Systems,Inc.)。
1.1.3 实验动物的准备和分组 Sprague-Dawley雄性大鼠(体重160~180 g) 24只 (广州中医药大学动物中心提供),随机分为假手术组、分流组,每组12只。给分流组行腹主动脉-下腔静脉穿刺分流术,假手术组大鼠仅予暴露腹主动脉及下腔静脉,不予分流术。两组大鼠术后常规饲养11周,饲养条件相同。
1.2 实验方法
1.2.1 高肺血流性肺动脉高压模型的建立 用10%水合氯醛(2~4 mL/kg)将大鼠麻醉,腹部备皮、消毒后取正中切口,用两根棉签将肠管拨出腹腔并用湿纱块包裹,间中予少量生理盐水使肠管保持湿润。用棉签钝性分离后腹膜,在充分显露腹主动脉及下腔静脉后用小弯镊钝性分离它们后壁组织。用一小止血夹阻断左肾动脉起始部下方的腹主动脉和下腔静脉,再以一根3-0幕丝非吸收缝线在髂总动静脉上方将下腔静脉阻断,分别用止血钳将缝线的2个末端固定于大鼠两边,以使腹主动脉和下腔静脉轻轻悬吊起来为宜。然后以腹主动脉的左肾动脉起始部到其末端段的下2/3处的左侧壁作为穿刺点,用12号一次性针头以45°角穿透腹主动脉壁进入相邻的下腔静脉内(不能刺穿下腔静脉对侧管壁)造成腹主动脉与下腔静脉瘘道(见图1A)。拔出针头,用小无齿镊将穿刺口之下1 mm的腹主动脉轻轻提起使穿刺口合拢,这样既能止血,又能防止组织黏合剂渗入血管内堵塞血流;然后用棉签擦掉残留血迹,往穿刺口滴少量Histoacryl组织黏合剂(见图1B),以刚好覆盖穿刺口周边0.5 mm左右为佳,因为过量的组织黏合剂容易将穿刺口附近的腹主动脉和下腔静脉覆盖,这样容易造成此处动静脉僵硬、缩窄,从而影响左向右分流量、下半身的血供或血液回流。先松开血管夹,若观察到下腔静脉内存在鲜红色血液流动并伴有血管震颤,则说明分流手术成功,然后松开髂总动静脉上方的幕丝非吸收缝线。最后用4号丝线分别缝合腹膜、肌层和皮肤。
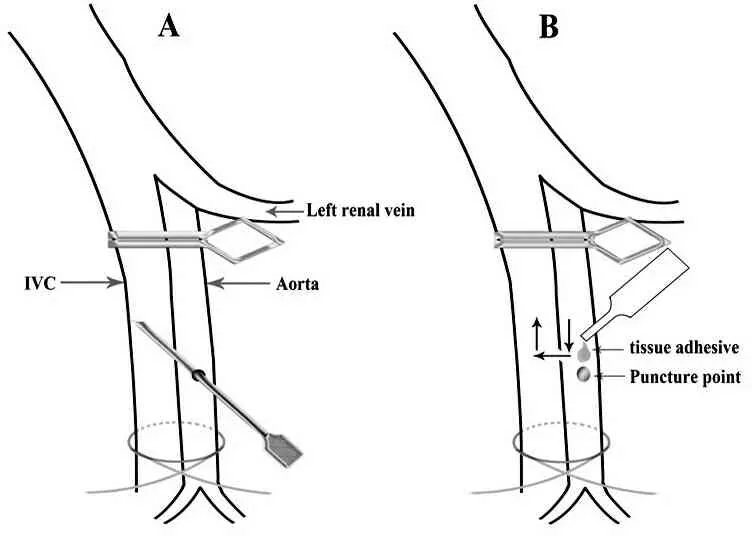
图1 腹主动脉-下腔静脉穿刺分流术步骤
1.2.2 血氧饱和度的测定 分流11周后,分别抽取各组大鼠的腹主动脉、股静脉及分流瘘口之上的下腔静脉的血液进行血气分析,测得它们的血氧饱和度。
1.2.3 血流动力学参数的检测 通过右心导管术和MP100多导生理记录仪分别检测和记录大鼠心率、肺动脉收缩压(pulmonary arterial systolic pressure,PASP)及肺动脉舒张压(pulmonary arterial diastolic pressure,PADP)。平均肺动脉压 (pulmonary arterial pressure,mPAP)参考Chemla D和Herve P的方法计算:mPAP=2/3 PADP+l/3 PASP[6]。
1.2.4 右心室肥厚指数的计算 将实验大鼠称重,记录体重(BW)。处死大鼠后取出心脏,去掉心房组织及血管组织,用生理盐水把心脏冲洗干净,将右心室(right ventricle,RV)与左心室(包含室间隔)(left ventricle+septal,LV+S)分离,用滤纸吸干分别称重,计算右心肥厚指数(RVHI):RVHIa=RV/(LV+S)和RVHIb=RV/BW(右室重/体重)。
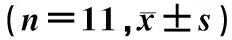
表1 两组大鼠血流动力学参数、右心肥厚指数及血氧饱和度
注:与假手术组比较,*P<0.01
2 结 果
2.1 耗时及死亡情况
腹主动脉-下腔静脉穿刺分流术从开腹至关腹耗时少于7 min,腹主动脉阻断时间少于2 min。假手术组1只大鼠在术后第3天开始出现腹胀,于术后第10天死亡,考虑原因可能是腹部感染或术后肠梗阻。分流组有1只大鼠于分流术后24 h内死亡,考虑原因可能是左向右分流量过大造成右室前负荷过高或血栓造成的大面积心肌梗死或肺梗死。
2.2 腹主动脉-下腔静脉分流外观
分流11周后,分流组大鼠下腔静脉与假手术组大鼠下腔静脉相比明显增大(见图2),并且可见下腔静脉震颤及动静脉血混合。

AB
注:A:白箭头所指的为假手术组下腔静脉;B:黑箭头所指的为分流组下腔静脉
图2 腹主动脉-下腔静脉分流外观
2.3 各组大鼠血流动力学参数及RVHI
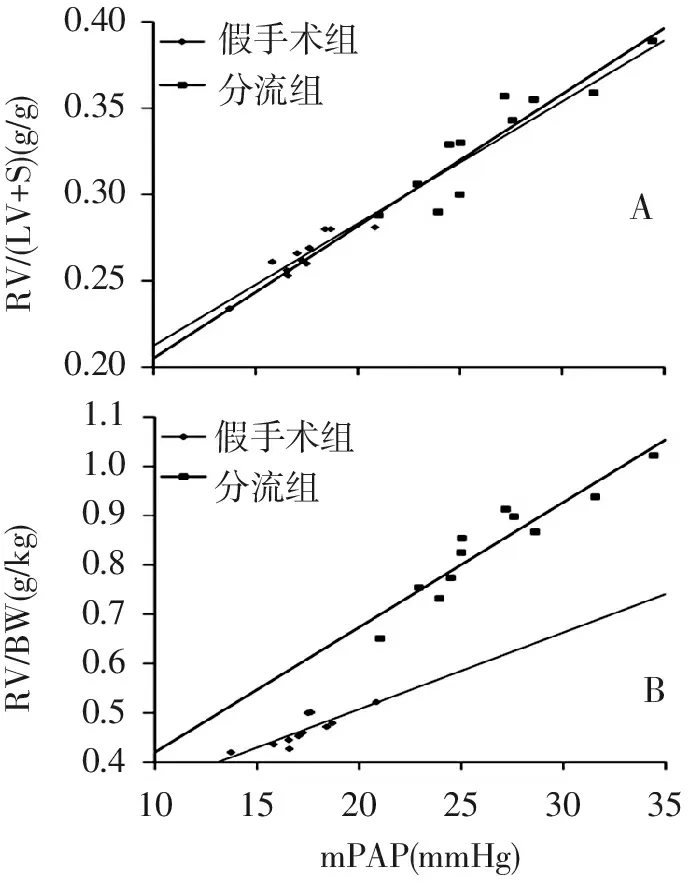
分流组大鼠肺动脉平均压显著高于假手术组[(26.52±3.90) mmHg vs (17.27±1.79) mmHg,1 mmHg=0.133 Kpa,P<0.01];分流组右心室肥厚指数明显高于假手术组(P<0.01) (见表1);各组大鼠的肺动脉平均压与右心肥厚指数呈显著正相关(见图3)。
0.400.350.300.250.201.11.00.90.80.70.60.50.4假手术组分流组RV/(LV+S)(g/g)RV/BW(g/kg)假手术组分流组mPAP(mmHg)101520253035AB
注:A:RVHIa与mPAP显著正相关(r假手术组=0.843、r分流组=0.914);B:RVHIb与mPAP显著正相关(r假手术组=0.907、r分流组=0.936)
图3 肺动脉平均压与右心肥厚指数相关分析图
2.4 血氧饱和度
如表1所示,分流组分流瘘口之上的下腔静脉血氧饱和度约等于腹主动脉血氧饱和度,但明显高于假手术组下腔静脉血氧饱和度;分流组股静脉血氧饱和度约等于假手术组股静脉血氧饱和度。
3 讨 论
对于大鼠腹主动脉-下腔静脉分流术的研究已有数十年,文献报道多数采用缝线闭合腹主动脉左侧穿刺口的方法[1-5,7],但该方法往往需要显微镜的辅助,操作过程繁琐,耗时长,缝合穿刺口时容易引起腹主动脉狭窄。而本课题腹主动脉-下腔静脉穿刺分流术的材料及操作方法简单,耗时较少,腹主动脉阻断时间在2 min以内,能降低血栓形成的风险,减少下半身缺血造成的伤害,而且组织黏合剂闭合穿刺口时不容易引起腹主动脉狭窄。
为了提高穿刺分流的成功率及减少大出血等意外情况的发生,本课题对该技术的操作技巧进行了总结与改良,现描述如下:①分离:以棉签钝性分离为主,需注意不可分离腹主动脉和下腔静脉之间的组织包膜,以免在穿刺分流术后它们间隔部位出血或血肿形成。②阻断:阻断腹主动脉建议使用止血夹,不建议使用非吸收缝线,因为后者阻断可能不完全,存在大出血的风险;阻断下腔静脉建议使用非吸收缝线,因为通过缝线的缠绕悬吊作用容易将其完全阻断,而且使穿刺时有更多的操作空间。保留1~2支下腔静脉的分支小静脉开放,因为适量的静脉血回流可使下腔静脉保持充盈状态,降低刺穿下腔静脉对侧管壁的风险。③穿刺:针头穿透腹主动脉和下腔静脉间隔部位时有突破感,当看到下腔静脉对侧管壁被针头稍稍顶起时停止推进,不能刺穿下腔静脉对侧管壁;如果穿刺针不能进至下腔静脉对侧管壁,则穿刺造瘘口可能偏小,左向右分流量不够,而且日后该造瘘口容易闭合,从而分流失败。当拔出针头时,由于此前有1~2支下腔静脉的小分支不被阻断,因此可看到少量暗红色的血液从左侧穿刺口缓慢流出,这说明穿刺造瘘成功;如果看不到以上描述的情况,则说明穿刺口过小或穿刺造瘘失败,这时在原穿刺口重新进针穿刺,确保穿刺成功和瘘口大小合适。
分流11周后,大鼠下腔静脉明显增大并存在震颤及动静脉血混合,这说明了瘘口通畅,左向右分流存在,分流瘘口之上的下腔静脉血氧饱和度、腹主动脉血氧饱和度及股静脉血氧饱和度之间的比较则进一步明确分流成功,而分流组大鼠平均肺动脉压及右心室肥厚指数显著高于假手术组说明了大鼠高肺血流性肺动脉高压的形成,以上这些情况和前人研究报道的一致[1,5,8]。关于高肺血流性肺动脉高压所致肺血管结构的改变已在很多前人研究中得到证实[2,5,8-10],我们不进行这方面的研究。
总之,左向右分流所致肺动脉高压目前仍然是先天性心脏病患儿主要死因之一,未来对于肺动脉高压的形成机制及治疗措施的研究将会更加深入,本课题的腹主动脉-下腔静脉穿刺分流术能够简易、快速及有效地建立大鼠高肺血流性肺动脉高压模型,从而有利于这方面的研究,值得推广。
[1] Ocampo C,Ingram P,Ilbawi M,et al. Revisiting the surgical creation of volume load by aorto-caval shunt in rats[J]. Mol Cell Biochem,2003,251(1-2):139-143.
[2] Li XH,Du JB,Jin HF,et al. The regulatory effect of endogenous hydrogen sulfide on pulmonary vascular structure and gasotransmitters in rats with high pulmonary blood flow[J]. Life Sci,2007,81(10):841-849.
[3] 庞璐璐,齐建光,扬 高,等. 中介素抑制高肺血流性肺动脉高压大鼠肺组织胶原生成[J]. 中国病理生理杂志,2014,30(12):2185-2189.
[4] 张超英,李晓惠,伏 瑾,等. 基质金属蛋白酶及其抑制物在容量过负荷致慢性心力衰竭大鼠血浆及心肌组织中的变化及意义[J]. 实用儿科临床杂志,2011,26(13):992-994.
[5] 陈传斯,庞玉生,马建法,等. 高肺血流性肺动脉高压大鼠肺间质的病理变化[J]. 中华实用儿科临床杂志,2014,29(1):15-18.
[6] Chemla D,Herve P. Estimation of mean pulmonary artery pressure:simpler than expected[J]. Chest,2008,133(3):592-593.
[7] 高 扬,建 光,李晓惠,等. 肾上腺髓质素对大鼠高肺血流性肺血管结构重构的干预作用[J]. 实用儿科临床杂志,2012,27(22):1751-1753.
[8] Wang YF,Shi L,Du JB,et al. Impact of L-arginine on hydrogen sulfide/cystathionine-gamma-lyase pathway in rats with high blood flow-induced pulmonary hypertension[J]. Biochem Biophys Res Commun,2006,345(2):851-857.
[9] Luo L,Liu D,Tang CS,et al. Sulfur dioxide upregulates the inhibited endogenous hydrogen sulfide pathway in rats with pulmonary hypertension induced by high pulmonary blood flow[J]. Biochem Biophys Res Commun,2013,433(4):519-525.
[10] 钟南山,罗福全,张挪富,等.光学相干断层成像在肺动脉介入诊疗中的应用[J].中华生物医学工程杂志,2010,16(4):12-14.
(本文编辑:郑颖)
Simple establishment of rat model of pulmonary hypertension with high pulmonary blood flow
ZhengZhouzhong,WangYanfei,ChenXinxin*
(HeartCenter,GuangzhouWomenandChildren’sMedicalCenter,GuangzhouMedicalUniversity,Guangzhou510623,China)
*Correspondingauthor:Email:zingerchen@163.com
Objective:To establish a simplified and improved rat model of pulmonary hypertension with high pulmonary blood flow. Methods: The rat model of pulmonary hypertension with high pulmonary blood flow was established by abdominal aorta-inferior vena cava puncture and shunt. The left aorta puncture was closed with tissue adhesive. At 11 weeks after the shunt,the changes of the inferior vena cava were determined. The pulmonary arterial pressure was measured by right cardiac catheterization. The arterial and venous oxygen saturation was measured by blood gas analysis. The right ventricle and left ventricle (including ventricular septum) were separated,and the right ventricular hypertrophy index was calculated. Results: The occlusion time of the abdominal aorta was less than 2 minutes. At 11 weeks,the inferior vena cava of the shunt group was thickened significantly,with tremor and mixing of arterial blood and venous blood.The oxygen saturation of the inferior vena cava above the fistula in the shunt group was similar to that of the abdominal aorta but was significantly higher than that of the sham operation group (P<0.01). The mean pulmonary arterial pressure and right ventricular hypertrophy index in the shunt group were significantly higher than those in the sham operation group (P<0.01). Conclusion: Using the tissue adhesive can easily and quickly complete the abdominal aorta-inferior vena cava puncture and shunt,and effectively establish the rat model of pulmonary hypertension with high pulmonary blood flow.
pulmonary hypertension; high pulmonary blood flow; abdominal aorta-inferior vena cava puncture and shunt; tissue adhesive; rat
10.3969/j.issn.2095-9664.2016.05.04
国家自然科学基金(81100233)
*通讯作者:Emai:zingerchen@163.com
R540
A
2095-9664(2016)05-0018-04
2016-03-21)
