康脑液对脑缺血再灌注大鼠血管内皮生长因子mRNA及肝细胞生长因子mRNA表达的影响
2016-04-09赵志敏肖志娟茜邹玉安王河北北方学院河北张家口075000
赵志敏 肖志娟 薛 茜邹玉安王 静(河北北方学院,河北 张家口 075000)
康脑液对脑缺血再灌注大鼠血管内皮生长因子mRNA及肝细胞生长因子mRNA表达的影响
赵志敏肖志娟薛茜1邹玉安1王静2(河北北方学院,河北张家口075000)
〔摘要〕目的探讨康脑液对脑缺血再灌注损伤大鼠血管内皮生长因子( VEGF) mRNA及肝细胞生长因子( HGF) mRNA的影响。方法大鼠随机分为假手术组、模型组、尼莫地平组、康脑液高、中、低剂量组。栓线法复制SD大鼠大脑中动脉缺血模型( MCAO),采用原位杂交法观察各组大鼠脑内VEGF mRNA和HGF mRNA的表达,同时观察康脑液对脑缺血再灌注大鼠神经功能、脑梗死体积的影响。结果与模型组比较,尼莫地平组、康脑液各剂量组均能改善脑缺血大鼠的神经功能缺失症状,缩小脑梗死体积,增强VEGF mRNA和HGF mRNA的表达( P<0.05),其中康脑液高、中剂量组作用强于尼莫地平组( P<0.01)。结论康脑液能增强大鼠脑缺血再灌注后VEGF mRNA及HGF mRNA的表达,是其抗脑缺血的可能作用机制之一。
〔关键词〕缺血性脑卒中;血管新生;康脑液;血管内皮生长因子;肝细胞生长因子
1河北北方学院附属第一医院神经内科
2河北北方学院生命科学研究中心
第一作者:赵志敏( 1985-),女,硕士,医师,主要从事缺血性脑血管病药理学研究。
在我国,缺血性脑血管病可占到致死因素的56.6%~80%,患者总人数可达500万~600万,存活者约有75%的高致残率〔1〕。研究缺血性脑卒中脑损伤机制,寻找恰当有效的治疗方法是临床与实验研究的主要任务之一。康脑液是益气活血鼻祖方补阳还五汤结合现代人患病特点化裁而来,本实验从血管新生这一角度,探讨其防治脑血管病的可能作用机制。
1材料与方法
1. 1药品及试剂康脑液(由黄芪、丹参、川芎、葛根、钩藤、三七粉等组方),河北北方学院附属第一医院制备并提供。除三七粉外,常规煎煮2次,再将两煎的上清液混合,分别浓缩成400%、200%、100%康脑液(每毫升含生药4、2、1 g),4℃冰箱保存;尼莫地平片,规格: 20 mg×50片,生产批号: 20121107,河北永丰药业有限公司提供,用无菌蒸馏水溶解为0.1 mg/ml溶液;血管内皮生长因子( VEGF)、肝细胞生长因子( HGF)原位杂交试剂盒购自武汉博士德生物工程有限公司。
1. 2主要实验仪器自动脱水机与石蜡切片机,均购美国Thermo产品;电脑生物组织包埋机,浙江金华科迪产品; CX21光学显微镜,日本Olympus产品。
1. 3实验动物SPF级雄性成年SD大鼠156只,体重200~280 g,购自北京大学医学部动物中心〔许可证号SCXK(京) 2011-0012〕。
1. 4动物分组与给药大鼠随机分为假手术组、模型组、尼莫地平组、康脑液高、中、低剂量组,术后分别存活6 h,12 h,1 d,3 d,7 d,除假手术组每个时间点1只外,其余各组均6只。于术前7 d,每天早晨灌胃给药1次,最后一次给药1 h后,实施脑缺血再灌注手术,术后继续给药,直至处死。给药剂量按大鼠与人体表面积等效剂量折算,康脑液高、中、低剂量( 28.6,14.3,7.15 g·kg-1·d-1),尼莫地平组1 mg·kg-1·d-1,给药体积均为10 ml/kg,假手术组、模型组给予等体积生理盐水。
1. 5模型制作参照文献方法〔2〕,栓线经右侧颈外动脉插入建立右侧大脑中动脉闭塞( MCAO)模型,缺血2 h后再灌注,假手术组除不穿线外,其余操作同模型组及治疗组。
1. 6神经功能学评分参照文献等〔3〕5分制评分方法于大鼠脑缺血再灌注后24 h对各个实验动物的神经行为学进行评分。0分:无神经系统损伤症状; 1分:不能完全伸展对侧前爪; 2分:向左侧转圈; 3分:向对侧倾斜; 4分:不能自发行走,意识丧失。1. 7 TTC染色及脑梗死体积测定于再灌注24 h后,每组随机抽取6只大鼠,腹腔注射10%水合氯醛过量麻醉后,快速断头取脑,置冰箱(-20℃)内10 min后,去除嗅球、小脑和低位脑干,取冠状面从前向后均匀切成2 mm厚脑片5片,将切片迅速置于2%TTC溶液( 37℃水浴)中避光条件下染色30 min。正常脑组织染成红色,缺血区呈灰白色,界线清晰。4%多聚甲醛固定24 h。取出脑片,用数码相机在同样光性条件下拍照。照片用图像分析系统Image Proplus 6.0计算每片脑组织的梗死面积、脑片面积。按照下列公式计算出每只大鼠脑组织的脑梗死体积百分比,脑梗死体积百分比=(脑片总梗死面积/脑片总面积)×100%。
1. 8 VEGF mRNA、HGF mRNA原位杂交检测切片常规脱蜡至水,3%H2O2室温10 min灭活内源性酶,蒸馏水洗3次,加1%柠檬酸新鲜稀释的胃蛋白酶消化37℃10 min,原位杂交用磷酸盐缓冲液( PBS)液冲3×5 min,蒸馏水1次,用0.1%DEPC处理的多聚甲醛后固定,室温10 min,蒸馏水洗3次。预杂交:每张切片20 μl预杂交液,40℃3 h,吸去多余液体不洗。杂交每张切片滴加20 μl杂交液,盖上原位杂交专用的盖玻片,42℃过夜,37℃左右水温2×SSC洗涤5 min×2,0.5×SSC 15 min×1,0.2×SSC 15 min×1,滴加封闭液,37℃30 min,甩去封闭液,滴加生物素大鼠抗地高辛,37℃1 h,原位杂交用PBS洗5 min×4,滴加SABC,37℃20 min,原位杂交用PBS洗5 min×3,滴加生物素过氧化物酶,37℃20 min,原位杂交用PBS洗5 min×4,DAB显色15~25 min,轻度复染,脱水,透明,封片。在×400视野下计数,在梗死周边区随机选取10个互不重叠视野,以胞质染成棕黄色为阳性细胞。
1. 9统计学处理采用SPSS17.0软件行单因素方差分析,组间两两比较用SNK法。
2结果
2. 1神经行为学评分及脑梗死体积比较尼莫地平组和康脑液各剂量组神经功能评分均显著低于模型组( P<0.05),康脑液高、中剂量组与尼莫地平组比较差异显著( P<0.01) ;康脑液各剂量组脑梗死体积显著低于模型组( P<0.05),康脑液高、中剂量组与尼莫地平组比较差异显著( P<0.01)。见表1,图1。2. 2 VEGF mRNA、HGF mRNA原位杂交结果VEGF mRNA阳性细胞主要分布于缺血坏死区周围皮质、侧脑室、海马齿状回的神经细胞和血管内皮细胞。在假手术组有少量表达,模型组VEGF mRNA阳性细胞数与假手术组比较差异显著( P<0.01),康脑液各剂量组和尼莫地平组与模型组比较显著升高( P<0.05) ;康脑液高、中剂量组与尼莫地平组比较差异显著( P<0.01)。假手术组大鼠大脑皮质仅见HGF mRNA少量表达,HGF mRNA阳性细胞呈棕黄色,模型组缺血半球皮质HGF mRNA表达与假手术组比较显著升高( P<0.01),康脑液高、中剂量组与模型组和尼莫地平组比较差异显著( P<0.01)。见表2、表3,图2。
表1各组大鼠神经功能和脑梗死体积比较(±s,n=6)

表1各组大鼠神经功能和脑梗死体积比较(±s,n=6)
与假手术组比较: 1) P<0.01;与模型组比较: 2) P<0.05,3) P<0.01;与尼莫地平组比较: 4) P<0.01;与康脑液低剂量组比较: 5) P<0.01,下表同
组别 神经功能学评分(分) 脑梗死体积( %)假手术组 0 0模型组 3.67±0.521) 39.67±2.341)尼莫地平组 2.50±0.553) 30.83±1.473)康脑液高剂量组 1.50±0.843) 4) 5) 24.33±2.503) 4) 5)康脑液中剂量组 1.50±0.553) 4) 5) 23.83±3.493) 4) 5)康脑液低剂量组 2.83±0.412) 33.50±1.763)

图1各组大鼠脑组织TTC染色
表2各组大鼠大脑皮质VEGF mRNA的表达(±s,n=6)

表2各组大鼠大脑皮质VEGF mRNA的表达(±s,n=6)
组别 6 h 12 h 24 h 3 d 7 d假手术组 10.00±2.28 10.00±1.67 10.17±2.23 12.17±3.66 11.50±2.35模型组 14.50±1.871) 21.33±3.501) 19.33±2.071) 34.33±4.721) 41.00±3.581)尼莫地平组 19.17±2.233) 27.00±2.833) 24.67±4.273) 40.33±6.922) 48.83±2.933)康脑液高剂量组 24.00±3.953) 4) 5 32.17±3.193) 4) 5) 29.83±2.933) 4) 5) 47.50±3.993) 4) 5) 55.83±3.433) 4) 5)康脑液中剂量组 24.33±2.423) 4) 5) 34.83±4.173) 4) 5) 30.17±2.863) 4) 5) 48.17±3.763) 4) 5) 56.33±5.683) 4) 5)康脑液低剂量组 18.67±3.012) 25.50±2.592) 24.17±3.662) 40.00±2.972) 47.17±3.973)
±s,n=6)表3各组大鼠血管HGF mRNA的表达(
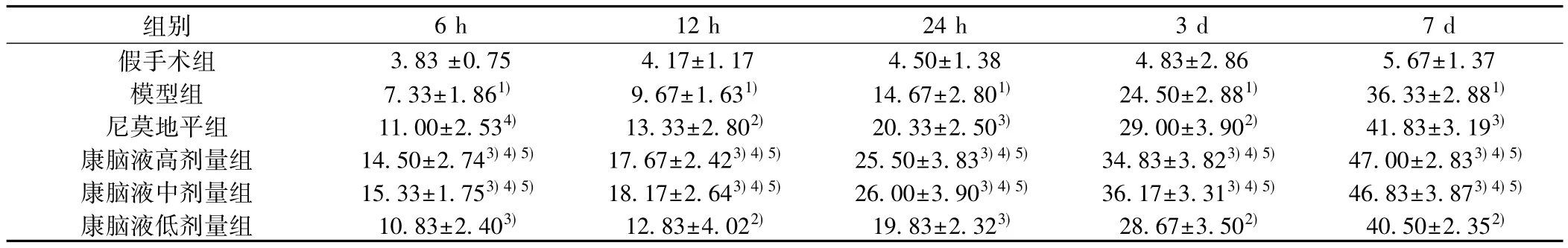
±s,n=6)表3各组大鼠血管HGF mRNA的表达(
组别 6 h 12 h 24 h 3 d 7 d假手术组 3.83±0.75 4.17±1.17 4.50±1.38 4.83±2.86 5.67±1.37模型组 7.33±1.861) 9.67±1.631) 14.67±2.801) 24.50±2.881) 36.33±2.881)尼莫地平组 11.00±2.534) 13.33±2.802) 20.33±2.503) 29.00±3.902) 41.83±3.193)康脑液高剂量组 14.50±2.743) 4) 5) 17.67±2.423) 4) 5) 25.50±3.833) 4) 5) 34.83±3.823) 4) 5) 47.00±2.833) 4) 5)康脑液中剂量组 15.33±1.753) 4) 5) 18.17±2.643) 4) 5) 26.00±3.903) 4) 5) 36.17±3.313) 4) 5) 46.83±3.873) 4) 5)康脑液低剂量组 10.83±2.403) 12.83±4.022) 19.83±2.323) 28.67±3.502) 40.50±2.352)

图2各组大鼠脑组织VEGF、HGF mRNA表达(×400)
3讨论
脑缺血后,脑组织由于缺血、缺氧,缺血中心区细胞迅速坏死,半暗区神经细胞处于低氧、低灌注状态,及时恢复该区域血流供应,有可能挽救潜在可逆的缺血脑组织,在时间和空间上阻止可逆向不可逆损伤病态发展,故挽救半暗带可逆的神经元是缺血性脑卒中治疗成功的关键〔4〕。而半暗区血流的恢复有赖于侧支循环的建立,血管新生是决定这些细胞存活的关键因素,与缺血性脑卒中病人的预后关系密切。脑缺血后,低氧作为一种信号激活VEGF/VEGF受体系统,促使半暗带VEGF高表达〔5〕,VEGF是一种内皮细胞特异的有丝分裂原,通过与VEGF受体结合而发挥促血管内皮细胞增殖、促进新生血管形成、增加血管通透性等生物学特性,有类似于血管源性的神经保护和神经营养作用〔6,7〕。近年研究发现,HGF是一种具有多种生物学功能的细胞因子,可促进细胞有丝分裂,对于神经系统的形态功能也具有重要意义。HGF通过与c-met受体结合而发挥作用,可以作用于多种类型靶细胞,HGF的生血管作用,主要是通过与其受体结合而直接作用于内皮细胞。在缺血损伤的组织中,HGF分泌增多,c-met受体上调,HGF可保护或促进损伤血管内皮细胞的修复及增生,并加快侧支循环的建立。康脑液为临床经验方,由黄芪、当归、丹参、川芎、葛根、钩藤、三七粉等几味中药组成,黄芪补气升阳、益卫固表,为君药;当归善于活血养血,有化瘀而不伤血之妙,为臣药;川芎、葛根、三七、丹参等助当归活血化瘀,为佐药;钩藤引药上行,为使药,君臣佐使共奏补气活血化瘀之功。其中几种中药的单方及鼻祖方补阳还五汤〔8~11〕研究表明,分别具有促进血管新生和改善神经功能的作用。本实验结果提示影响VEGF mRNA及HGF mRNA表达是康脑液抗脑缺血损伤的又一可能机制。
4参考文献
1 Jia Q,Liu LP,Wang YL.Stroke in China〔J〕.Clin Exp Pharmacol Physiol,2010; 37: 259-64.
2 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without cranietomy in rats〔J〕.Stroke,1989; 20( 1) : 84.
3 Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986; 17( 3) : 472-6.
4王永权,孙凤艳.血管内皮生长因子的脑保护及其机制研究进展〔J〕.生理科学进展,2007; 38( 3) : 202-7.
5 Dombrowski SM,Deshpande A,Dingwall C,et al.Chronic hydrocephalusinduced hypoxia: increased expression of VEGFR-2 and blood vessel density in hippocampus〔J〕.Neuroscience,2008; 152( 2) : 346-59.
6 Gao P,Shen F,Gabriel RA,et al.Attenuation of bra in response to vascular endothelial growth factor-mediated angiogenesis and neurogenesis in aged mice〔J〕Stroke,2009; 40( 11) : 3596-601.
7 Hermann DM,Zechariah A.Implications of vascular endothelial growth factor for postischemic neurovascular remodeling〔J〕J Cereb Blood Flow Metab,2009; 29( 10) : 1620-31.
8王盟,刘卫.钩藤总生物碱的研究进展〔J〕.实用医药杂志,2008; 25( 3) : 360-2.
9梁顺利,徐彬,张宇燕.黄芪注射液对梗死灶周脑组织HIF-1A和VEGF的影响〔J〕.心脑血管病防治,2011; 11( 1) : 21-3.
10周赛男,蔺晓源,易健,等.补阳还五汤对脑缺血大鼠神经功能及细胞形态的影响〔J〕.中国实验方剂学杂志,2013; 19( 2) : 251-4.
11高健,王立英,刘洋,等.川芎生物碱对脑缺血再灌注大鼠SOD、MDA、神经功能及脑梗死容积的影响〔J〕.中国老年学杂志,2009; 29( 1) : 22-4.
〔2014-07-19修回〕
(编辑安冉冉/曹梦园)
通讯作者:薛茜( 1968-),女,主任医师,教授,硕士生导师,主要从事缺血性脑血管病研究。
基金项目:河北省卫生厅课题基金资助项( 20090591)
〔中图分类号〕R749
〔文献标识码〕A
〔文章编号〕1005-9202( 2016) 02-0274-03;
doi:10. 3969/j. issn. 1005-9202. 2016. 02. 008
