制首乌诱导肝细胞凋亡的“毒-证”机制
2016-04-09莉彭卫培峰高晓庆白成都中医药大学药学院四川成都637
欧 莉彭 成 卫培峰高晓庆白 杨(成都中医药大学药学院,四川 成都 637)
制首乌诱导肝细胞凋亡的“毒-证”机制
欧莉1彭成卫培峰1高晓庆1白杨1(成都中医药大学药学院,四川成都611137)
〔摘要〕目的研究制首乌诱导肝细胞凋亡的“毒-证”机制。方法皮下注射氢化可的松建立大鼠肾阳虚模型,分为空白对照组、肾阳虚低、中、高剂量组(分别予制首乌10.8,21.6,43.2 g/kg)。连续给药14 d后处死大鼠,制备含药血清。分别采用5,5'-二硫代双( 2-硝基苯甲酸) ( DTNB)法和硫代巴比妥酸( TBA)法测定L02肝细胞内谷胱甘肽( GSH)和丙二醛( MDA)的含量,并通过显微镜和电镜观察肝细胞形态结构及超微结构的改变。结果制首乌肾阳虚各剂量组含药血清(终浓度15%)作用24 h及48 h后,细胞内T-GSH及GSH含量均有不同程度降低,其中肾阳虚中、高剂量组含药血清作用48 h后,细胞内GSH含量与空白对照组比较有统计学差异( P<0.05) ;同时,GSH/GSSG比值与空白组比较,制首乌肾阳虚高剂量组含药血清作用24 h及48 h后均出现显著降低( P<0.01)。给药后,L02肝细胞密度变小,脱壁细胞增多,部分细胞出现坏死、裂解和形态改变;肝细胞超微结构也发生变化,胞质出现空泡,细胞器肿胀、破坏。结论制首乌非对证治疗肾阳虚证候时,对肝脏具有一定毒性作用,肾阳虚证可能是制首乌肝毒性的靶向证候,故临床使用时应注意对证用药,并严格控制制首乌的使用剂量和疗程。
〔关键词〕制首乌;肝细胞;凋亡
1陕西中医学院药学院
第一作者:欧莉( 1980-),女,博士,副教授,主要从事中药药效学及毒性机制研究。
何首乌为蓼科植物何首乌( Polygonum multiflorum Thunb.)的干燥块根。清蒸或用黑豆煮汁拌蒸后晒干入药为制何首乌,具有补益精血,固肾乌须的功效〔1〕。《本草汇言》中记载称何首乌“生用气寒、性敛、有毒;制熟气温无毒”,故历代医家均强调炮制入药〔2〕。目前对何首乌的毒性均借用化学药品毒性研究方法进行研究,忽视了中医基础理论的指导作用,忽视了制首乌毒性(药物偏性)与证候之间的关联性。因此,制首乌肝毒性评价问题的关键,不只是在正常动物上评价其绝对毒性大小,更重要是在疾病模型动物上模拟临床实际情况研究其合理用药减(避)毒的途径和机制。因此,本文以人正常肝细胞株L02为观察对象,探讨制首乌肾阳虚含药血清诱导肝细胞凋亡的“毒-证”相关性,以期为预防制首乌导致药物性肝损伤的发生提供科学依据。
1材料与方法
1. 1材料
1. 1. 1细胞系及培养条件人正常肝细胞株L02购自湘雅中心实验室细胞库,在含10%胎牛血清的RPMI1640完全培养基,37℃、5%CO2及饱和湿度条件下进行常规培养,所有试验均在细胞对数生长期进行。
1. 1. 2药品与试剂RPMI1640完全培养基、胎牛血清、胰蛋白酶,均购自美国Gibco公司;噻唑蓝( MTT)、二甲基亚砜( DMSO),均购自美国Sigma公司;细胞丙二醛( MDA)检测试剂盒及谷胱甘肽( GSH)试剂盒均购自南京建成生物工程研究所,批号分别为20140711及20140628;何首乌药材购自四川成都荷花池药材市场,批号: 1209341405,产地为四川,由陕西中医学院中药教研室卫培峰教授鉴定。
1. 1. 3实验动物SPF级SD大鼠,购自西安交通大学实验动物中心,许可证号: SCXK(陕) 2012-003,饲养于陕西中医学院实验动物中心。饲养环境保持室温20℃~25℃,相对湿度40% ~60%,实验动物自由进食和饮水。
1. 1. 4仪器AE-21倒置显微镜,麦克奥迪公司; CB-150二氧化碳培养箱,德国Binder公司; DHG-9075 A型电热恒温鼓风干燥箱,上海一恒科技有限公司; TGL-16G高速台式离心机,上海安亭科学仪器厂; EX-8080酶标仪,美国BIO-TEK公司。JEM-1230电镜及Quantimet 570图像分析仪,日本电子株式会社。
1. 2方法
1. 2. 1制首乌药材及水煎液的制备将生首乌按照2010版药典方法(清蒸法)进行炮制〔1〕,随后将制首乌分别按照高、中、低剂量进行煎煮:将制首乌置于煎煮容器中,加入相当于药材量5倍的冷水浸泡60 min,煮沸30 min,再加入相当于药材量3倍的冷水继续煎煮20 min后,煎煮液浓缩。
1. 2. 2制首乌含药血清的制备SD大鼠40只,随机分为4组,每组10只。其中3组大鼠皮下注射氢化可的松,1次/d,25 mg/kg,连续14 d,造成肾阳虚证模型〔5〕,另1组为生理盐水组。随后各组分别以高( 43.2 g/kg)、中( 21.6 g/kg)、低浓度( 10.8 g/kg)的制首乌水煎液及生理盐水灌胃,每天给药2次,连续7 d,末次给药1 h后乙醚麻醉大鼠,无菌条件下心脏取血,立即注入无菌管里,室温静置,待血液凝固、血清析出后,吸取上清离心,3 000 r/min,10 min后再吸取上清,即得制首乌含药血清。血清混合后,置于56℃水浴中灭活30 min,用0.22 μm的微孔滤膜过滤除菌。经培养实验证实无微生物污染后,置于-20℃冰箱中保存备用。
1. 2. 3 L02肝细胞的培养及给药将细胞接种于培养瓶中,加入含10%胎牛血清( FBS)的RPMI1640完全培养基5 ml,置37℃、5% CO2饱和湿度的恒温培养箱中培养,镜下观察细胞贴壁生长情况。取生长状态良好的同一批传代细胞,用0.25%胰蛋白酶-EDTA消化液消化,用10% FBS+1640培养液将细胞重悬,以每孔103~104个细胞接种于96孔培养板中,每孔体积为100 μl,继续培养24 h,使细胞同步化。每实验各组分别加入15%的高、中、低浓度的制首乌含药血清及正常大鼠血清,置37℃、5% CO2饱和湿度的恒温培养箱中培养24 h、48 h。
1. 2. 4测定胞内GSH含量收集各实验组肝细胞后将其悬浮于100 μl的PBS中,超声破胞后3 500 r/min离心去除沉淀。上清液采用DTNB法检测GSH含量。GSSG含量=( GSSG测定△A值) /( GSSG标准△A值)×标准品浓度/样本测试前稀释倍数。GSH含量=T-GSH含量-2×GSSG含量。
1. 2. 5测定胞内MDA含量弃去细胞培养上清,用细胞刮将细胞刮下,用移液器将细胞转移到塑料离心管中,加细胞提取液,混匀2 min,将细胞超声破碎制成悬液,取样0.1 ml于1.5 ml离心管中,漩涡混匀器混匀,95℃以上水浴40 min,取出后流水冷却,4 000 r/min离心10 min,吸取0.25 ml各管反应液加入到新的96孔板中,酶标仪530 nm测定各孔吸光度。MDA含量=(测定OD值-空白OD值) /(标准OD值-空白OD值)×标准品浓度/样本蛋白浓度。
1. 2. 6透射电镜观察肝细胞超微结构实验取生长状态良好的同一批传代细胞,对照组于培养箱内继续培养2 h,实验各组分别加入15%的高、中、低浓度的制首乌含药血清培养48 h,空白对照组以空白组大鼠血清代替。用0.25%胰蛋白酶-EDTA消化液消化后收集细胞,预冷PBS洗两次,离心弃上清,立即加入4%戊二醛固定待用,1%锇酸固定后再冲洗。用乙醇梯度脱水,环氧树脂包埋制成电镜切片,切片用枸橼酸铅-醋酸双氧铀染色后,透射电镜下,每组各取4个不同的视野观察肝细胞超微结构并记录。
1. 3统计学处理采用SPSS12.0软件行单因素方差分析。
2结果
2. 1制首乌含药血清对L02肝细胞形态的影响倒置显微镜下观察,与空白对照组中L02肝细胞培养48 h后,细胞贴壁生长,呈梭形或多边形,相邻细胞连接成片,折光均匀。与空白对照组相比,15%的肾阳虚高剂量组含药血清作用48 h后,细胞密度变小,脱壁细胞增多,部分细胞出现坏死、裂解和形态改变,见图1。
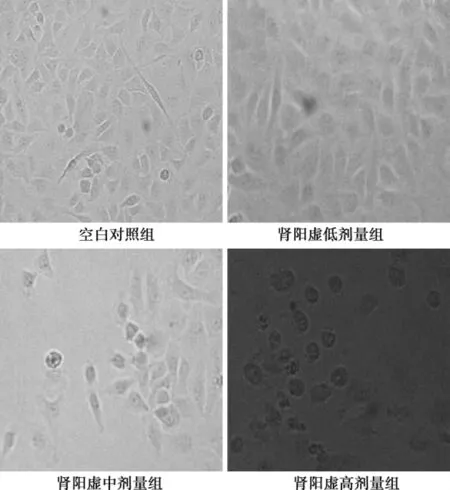
图1制首乌含药血清作用48 h对L02肝细胞形态的影响(×400)
2. 2制首乌含药血清对L02肝细胞胞内T-GSH、GSH含量及GSH/GSSG比值的影响与空白对照组比较,制首乌肾阳虚各剂量组含药血清作用24 h及48 h后,细胞内T-GSH及GSH含量均不同程度降低,其中肾阳虚中、高剂量组含药血清作用48 h后,细胞内GSH含量与空白对照组比较出现统计学差异( P<0.05) ;同时,与空白对照组比较,制首乌肾阳虚高剂量组含药血清作用24 h及48 h后,GSH/GSSG比值均出现显著降低( P<0.01),见表1。
2. 3制首乌含药血清对L02肝细胞胞内MDA含量的影响与空白对照组比较,制首乌肾阳虚低、高剂量组含药血清作用24 h及48 h后,细胞内MDA均增加明显( P<0.05) ;其中,肾阳虚高剂量组含药血清作用48 h后,细胞内MDA含量出现显著性增加( P<0.01),见表2。
2. 4制首乌含药血清对L02肝细胞超微结构的影响正常肝细胞核大而圆,位于中央,核仁明显,核膜清晰,胞质内细胞器丰富。给药后,部分细胞染色质分解稀疏,细胞膜发生破损,胞质出现空泡,细胞器肿胀、破坏,细胞状态差。肾阳虚中、高剂量组的部分细胞染色质在核浆内聚集成致密浓染的大小不等的团块状,出现月牙样边集,细胞质中出现空泡。见图2。
表1制首乌含药血清对L02肝细胞胞内T-GSH、GSH含量及GSH/GSSG比值的影响(±s,n=10)

表1制首乌含药血清对L02肝细胞胞内T-GSH、GSH含量及GSH/GSSG比值的影响(±s,n=10)
与同时间点空白对照组比较: 1) P<0.05,2) P<0.01;下表同
组别 作用时间( h) T-GSH (μmol/L) GSH (μmol/L) GSH/GSSG空白对照组 24 95.12±25.40 89.84±16.77 34.07±11.73 48 94.75±25.66 86.32±18.95 20.41±6.82肾阳虚低剂量组 24 86.93±27.29 73.69±21.42 11.18±5.762)48 79.43±16.56 68.82±19.45 12.95±5.34肾阳虚中剂量组 24 90.21±19.33 80.31±19.20 16.24±7.801)48 80.54±22.92 62.55±14.261)6.99±2.612)肾阳虚高剂量组 24 76.46±19.82 66.57±15.481)13.46±8.542)48 70.81±27.40 58.93±17.841)9.84±4.152)
表2制首乌含药血清对L02肝细胞胞内MDA含量的影响(±s,nmol/mgprot,n=10)
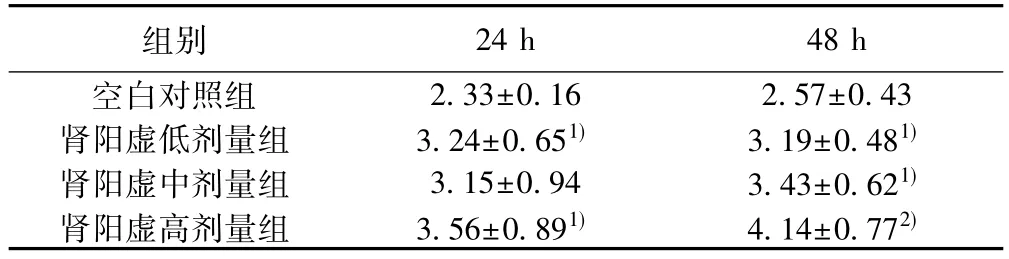
表2制首乌含药血清对L02肝细胞胞内MDA含量的影响(±s,nmol/mgprot,n=10)
组别 24 h 48 h空白对照组 2.33±0.16 2.57±0.43肾阳虚低剂量组 3.24±0.651) 3.19±0.481)肾阳虚中剂量组 3.15±0.94 3.43±0.621)肾阳虚高剂量组 3.56±0.891) 4.14±0.772)

图2制首乌含药血清对L02肝细胞超微结构的影响
3讨论
目前在中药新药临床前安全性评价时,在急性毒性实验和长期毒性实验中,应用的并非是与药物相应的证候模型,而是在正常机体验证药物的毒性。这种筛选方法不符合中药“以偏纠偏”的特性,部分药物会因为其偏性而在正常机体上反映出毒性而被淘汰〔3〕。这种现象导致了现代方法指导下的中药药理毒理和中医临床用药之间的偏差。从长远看,这对中药研究的发展是不利的。中药的现代研究只有将“有故无陨”等思想作为指导,体现中药研究的“辨证”“证治”等特点才能与中医临床的辨证论治相结合,切实有效地指导临床用药〔4〕。
本文采用给大鼠注射外源性糖皮质激素建立肾阳虚模型,动物出现一系列的“耗竭”现象,如拱背、蜷曲、肢尾冷、挤卧在一起、肛温降低、雄性动物睾丸萎缩、反应迟钝、自发活动时间降低,被毛疏松,失去光泽(脱毛),消瘦、尿液白浊等病理状态。这些外观的病态表现符合中医阳虚证的临床表现〔5〕。
GSH是细胞内最重要的抗氧化物质,而且大量存在于各种细胞之中,并在多种生理过程中起着重要的作用。GSH构成细胞防御氧化损伤机制中的第一道防线,而且是普遍存在的细胞类型中的主要氧化还原缓冲剂,其含半胱氨酸的三肽可以减轻蛋白质的二硫化,减轻自由基和内毒素的毒性作用,并维持细胞内氧化还原的平衡。GSH可以中和氧自由基,其本身在GPX作用下被氧化成GSSG,后者通过NADPH,在谷胱甘肽还原酶作用下还原成GSH。在生理条件下GSH和GSSG形成动态平衡,维护着细胞氧化内环境的稳定,因此检测GSH和GSSG的变化可反映组织氧化还原状态的改变〔6,7〕。机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸( PUFA),引发脂质过氧化作用,并因此形成脂质氧化物。氧自由基不但可通过生物膜中PUFA的过氧化引起细胞损伤,而且还能通过脂氢过氧化物的分解产物引起细胞损伤。过氧化脂质降解产物中MDA的含量可以用来反映体内脂质过氧化的程度,同时也可间接地反映出细胞损伤的程度。
本研究结果表明制首乌肾阳虚含药血清作用肝细胞48 h后,肝细胞内GSH含量显著降低,GSH/GSSG比值失衡,MDA含量明显上升,线粒体氧化损伤明显,抗氧化能力明显降低。而且给药后,肝细胞形态出现改变,部分细胞出现裂解坏死;肝细胞超微结构也发生变化,胞质出现空泡,细胞器肿胀、破坏,提示使用制首乌非对证治疗肾阳虚证候时,对肝脏具有一定毒性作用,肾阳虚证可能是制首乌肝毒性的靶向证候,故临床使用时应注意对证用药,并严格控制制首乌的使用剂量和疗程。
4参考文献
1国家药典委员会.中华人民共和国药典(一部)〔S〕.北京:中国医药科技出版社,2010: 165.
2闫二磊,梁生旺.何首乌肝损伤的研究进展〔J〕.广东药学院学报,2014; 30( 6) : 1-4.
3李会芳,邢小燕,金城,等.浅论“有故无殒,亦无殒”的内涵及其在中药安全性评价中的意义〔J〕.中医杂志,2008; 49( 3) : 281-2.
4金磊,刘喜明.论黄帝内经/有故无殒亦无殒的含义及临床意义〔J〕.陕西中医,2013; 34( 2) : 206-7.
5刘欣,张冰,崔一然,等.基于垂体-靶腺轴相关指标动态观察氢考诱导大鼠阳虚状态〔J〕.上海中医药大学学报,2011; 25( 1) : 53-5.
6张照明,张海涛,袁利明.国内谷胱甘肽研究进展〔J〕.广州化工,2009; 37( 3) : 55-7.
7牛磊,汪隽瑛,蒋瑾瑾.白三烯诱导人呼吸道上皮细胞氧化应激及谷氨酰半胱氨酸合成酶的作用研究〔J〕.临床儿科杂志,2012; 30 ( 1) : 66-9.
〔2015-02-11修回〕
(编辑李相军)
The mechanisms related "toxic-targeted syndrome" of medicated serum of Polygonum Multiflorum Thunb on apoptosis of L02 cells
OU Li,PENG Cheng,WEI Pei-Feng,et al.
College of Pharmacy,Chengdu University of TCM,Chengdu 611137,Sichuan,China
【Abstract】Objective To study the mechanisms related " toxic-targeted syndrome" of medicated serum of Polygonum Multiflorum Thunb( PMT) on apoptosis of L02 cells.Methods Rat models with deficiency of kidney-YANG were induced by hydrocortisone.The rats were divided into blank control,low dose( 10.8 g/kg),middle dose( 21.6 g/kg),high dose( 43.2 g/kg) groups of PMT,the rats were killed after administrated 14 d to prepare medicated serum of PMT.The contents of glutathione( GSH) and malondialdehyde( MDA) in L02 cells were tested by dithio-bis-nitrobenzoic acid( DTNB) and 2-Thiobarbituric acid( TBA).The changes of morphology and ultrastructure of L02 cells were observed by microscope and electron microscope.Results Medicated serum of deficiency of kidney-Yang groups( 15%) obviously reduced the contents of T-GSH and GSH in L02 hepatocytes after treated 24 h and 48 h.The contents of T-GSH and GSH were differences between control group and high and middle dose groups( P<0.05).Meanwhile,compared with that of control group,the GSH/GSSG ratio of medicated serum of deficiency of kidney-Yang groups were both significantly reduced after treated 24 h and 48 h( P<0.01).L02 liver cell density was decreased,and more cells falling down from the inner wall of the cell culture flasks,and part of the cell became necrotic,lysis and changed morphology.The ultrastructures of L02 liver cell were also changed,such as empty cytoplasm and swelling organelle appeared.Conclusions The syndrome of deficiency of kidney-YANG might be targeting the liver toxicity syndromes of PMT.PMT should be used in the correct syndrome in clinical and strictly control clinical dose and duration of treatment.
【Key words】Polygonum multiflorum thunb; Hepatocyte; Apoptosis
通讯作者:卫培峰( 1972-),男,博士,教授,主要从事中药毒性机制研究。
基金项目:国家自然科学基金面上项目( 81373988)
〔中图分类号〕R285. 5
〔文献标识码〕A
〔文章编号〕1005-9202( 2016) 02-0262-04;
doi:10. 3969/j. issn. 1005-9202. 2016. 02. 003
