人宫颈癌SiHa细胞荷瘤裸鼠模型的建立及鉴定
2016-04-08侯柏龙杜王琪熊一融蔡一奇宋易玲林晓云薛向阳张丽芳温州医科大学分子病毒与免疫研究所微生物学与免疫学教研室浙江温州35035温州医科大学附属第一医院胃肠外科浙江温州3505
侯柏龙,杜王琪,熊一融,蔡一奇,宋易玲,林晓云,薛向阳,张丽芳(.温州医科大学 分子病毒与免疫研究所、微生物学与免疫学教研室,浙江 温州 35035;.温州医科大学附属第一医院 胃肠外科,浙江 温州 3505)
人宫颈癌SiHa细胞荷瘤裸鼠模型的建立及鉴定
侯柏龙1,杜王琪1,熊一融1,蔡一奇2,宋易玲1,林晓云1,薛向阳1,张丽芳1
(1.温州医科大学 分子病毒与免疫研究所、微生物学与免疫学教研室,浙江 温州 325035;2.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015)
[摘 要]目的:建立人宫颈癌SiHa细胞裸小鼠体表荷瘤模型,并对其成瘤特性进行分析和鉴定。方法:将5×106/mL、1×107/mL及5×107/mL 3个浓度的SiHa细胞悬液分别在3组裸小鼠背部右腋近上肢皮下接种,建立人宫颈癌裸小鼠体表荷瘤模型,观察荷瘤裸鼠的成瘤率并测量肿瘤的大小,5周后取肿瘤组织经病理学方法观察其组织学特性,并采用PCR及免疫组织化学方法对肿瘤组织的HPV16E7 DNA表达进行检测。结果:3组裸小鼠接种SiHa细胞的成瘤率均为100%,5周后肿瘤大小分别达到(77.29±28.34)mm3、(178.91± 61.55)mm3和(305.11±12.62)mm3。3个浓度组间肿瘤体积大小差异有统计学意义(P<0.001)。病理学大体观察可见SiHa肿瘤的生长均以局部浸润为主;组织切片观察新生肿瘤细胞特点呈现体积大、核大深染及易见核分裂相的病理性特征;SiHa新生肿瘤组织经PCR检测证实了HPV16E7 DNA阳性,并经免疫组织化学检测证实了HPV16E7蛋白表达阳性。结论:成功建立了SiHa细胞荷瘤裸鼠模型,为人宫颈癌肿瘤靶向治疗及生物学特性研究提供了理想的动物模型。
[关键词]宫颈肿瘤;动物模型;BALB/c-nu裸小鼠;SiHa细胞
宫颈癌是全球最常见的妇科恶性肿瘤之一,其发病率在女性恶性肿瘤中仅次于乳腺癌排第二位,而我国宫颈癌患病率和病死率约占世界的28.8%,宫颈癌患病人数约占世界三分之一[1]。宫颈癌的发病与人乳头瘤病毒(human papilloma-virus,HPV)感染的相关性已经明确,且基于HPV L1蛋白的宫颈癌预防性疫苗也已经商业化[2],但宫颈癌的治疗尚未获得突破性研究进展。尽管HPV型别众多,其高危型别(HPV16、18、31、33、58等)也具有地域分布特性,但流行病学研究表明HPV16感染为全球宫颈癌致病主要型别[3]。因此,本研究采用人HPV16 DNA阳性的SiHa细胞株接种建立人宫颈癌荷瘤裸鼠模型,为宫颈癌治疗及其发病机制研究提供了基础。
1 材料和方法
1.1细胞株 人宫颈癌SiHa细胞购自上海中科院细胞库(HTB-35)。常规方法从液氮罐中取出SiHa细胞冻存液,迅速经37 ℃水浴后加入RPMI-1640培养液吹打混匀,1 000 r/min离心5 min,弃上清液,加入适量含10%胎牛血清的RPMI-1640培养液,吹打成细胞悬液,置于37 ℃、5% CO2培养箱内培养。观察细胞生长情况,细胞长至80%融合时,用胰酶消化传代后备用。
1.2实验动物 BALB/c裸小鼠购自上海斯莱克实验动物有限责任公司(合格证号:SCXK(沪)2012-0002),21只,雌性未孕,成熟健康,鼠龄5~8周,体质量18~25 g,SPF级,在温州医科大学动物实验中心屏障系统内饲养。所有进入屏障系统的饲料、水、空气、铺垫物及各种用品均需经过高温高压等灭菌处理;所有进入实验室的人、动物均需经过严格的微生物控制。
1.3试剂 RPMI-1640细胞培养液、胎牛血清FBS均购自Gibco公司;各组织DNA提取试剂盒购自天根生化科技有限公司;HPV16 E7特异性兔抗体由本实验室提供;HRP标记的羊抗兔IgG(H+R)抗体购自联科生物技术有限公司。
1.4肿瘤动物模型的建立 裸小鼠适应性生长1周后,随机分为3组,每组7只。取对数生长期的SiHa细胞,用胰酶消化后,用PBS分别配制成5×106/mL、1×107/mL和5×107/mL,即低、中、高3个不同浓度的单细胞悬液,在无菌条件下皮下注射接种于裸小鼠背侧近右腋窝处,每只0.2 mL。
1.5肿瘤特征的观察 每隔1 d观察裸小鼠的精神状态、活动力、反应、饮食、体质量、皮下接种区域外观及触感。每3 d用电子游标卡尺测量瘤体最长径a和最短经b,按公式V=1/2(ab2)计算肿瘤体积[4]。以肿瘤体积和生长周数分别为坐标绘制不同接种浓度下的肿瘤生长曲线。
1.6形态学和组织学检查 ①大体形态检查:接种SiHa细胞悬液5周后处死荷瘤裸鼠,解剖观察肿瘤形态、直径、质地、活动度及脑、肝、肺、肾等转移情况。②组织学检查:将标本送至温州医科大学基础医学院病理解剖学教研室,部分肿瘤组织以4%多聚甲醛固定,石蜡包埋常规切片和HE染色,显微镜观察细胞形态特征;另外部分肿瘤组织进行免疫组织化学检测HPV16E7蛋白的表达情况。剩余肿瘤组织及主要器官(肝脏、肺脏和大脑等)组织置液氮保存,用于PCR检测HPV16E7的DNA表达。
1.7PCR方法检测 根据HPV16E7的全长DNA序列,设计HPV16E7 PCR引物[5],上游引物为:5’-GGAATTCCA TATGCATGGAGATACACCT-3’,下游引物为:5‘-CCGCTC GAGTGGTTTCTGAGAACAGA-3’;各组织DNA提取则采用试剂盒进行,方法按说明书操作,提取本实验中荷瘤裸鼠肿瘤组织及脑、肝、肺、肾等的DNA,分别以这些组织的DNA为模板,通过PCR扩增HPV16 E7 DNA全长基因。PCR反应条件为95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环,72 ℃延伸10 min,PCR反应产物通过琼脂糖凝胶电泳鉴定。
1.8免疫组织化学方法检测 取上述石蜡包埋的各肿瘤组织进行切片(厚度为3 μm),常规脱蜡、固定、抗原修复后,以HPV16E7特异性兔血清多克隆抗体(1:100稀释)为一抗,4 ℃孵育过夜。 以HRP标记的羊抗兔IgG(H+R)抗体(1:500稀释)为二抗,室温孵育2 h,经DAB显色、苏木精复染和脱水后进行封片。同时以PBS兔血清代替一抗作为阴性对照。
1.9统计学处理方法 采用SPSS18.0软件进行统计学处理。实验数据以±s表示,同一时间段各组间肿瘤组织平均体积差异比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1成瘤潜伏期与成瘤率 21只荷瘤裸鼠全部存活,成瘤率均为100%。3个浓度组5×106/mL、1× 107/mL和5×107/mL的荷瘤裸鼠成瘤潜伏期分别为(11.71±1.80)d、(9.00±2.87)d、(6.14±1.07)d。5周后3组荷瘤裸鼠肿瘤大小分别达到(77.29± 28.34)mm3、(178.91±61.55)mm3、(305.11±12.62)mm3,3组间肿瘤体积大小差异有统计学意义(均P<0.001)。
2.2荷瘤裸鼠肿瘤大小及一般特性观察 裸小鼠接种SiHa细胞后,肿瘤呈持续性生长(见图1A)。在第1周5×106/mL组和5×107/mL组肿瘤大小差异有统计学意义(P<0.01),在第2周5×106/mL组和1×107/mL组肿瘤大小差异有统计学意义(P<0.05),在第3周1×107/mL组和5×107/mL组肿瘤大小差异有统计学意义(P<0.001)(见图1B)。所有荷瘤裸鼠接种SiHa细胞后一般状况尚可,活动量正常,反应敏捷,进食及进水量无明显变化,体质量无明显变化。
2.3形态学和组织学检测结果 第5周将荷瘤裸鼠麻醉处死,解剖观察,移植瘤大多呈结节状,与皮肤粘连甚少,肿瘤有清楚的组织界限,外观呈乳头结节或分叶状,血供丰富且易分离,肿瘤组织切面呈鱼肉样;肝、脑、肺和肾等组织未见明显的转移结节。经制备肿瘤组织病理切片,在普通显微镜光镜下观察,可见肿瘤组织癌巢、血管扩张充血、小灶凝固性坏死和少量淋巴细胞和中性粒细胞浸润;肿瘤细胞呈现体积大、核大深染且易见核分裂相等肿瘤病理性特征,肝、脑、肺和肾等均未见明显的转移灶(见图2)。
2.4PCR检测结果 各组裸小鼠肿瘤组织提取DNA后,经HPV16E7特异性引物PCR后进行琼脂糖电泳鉴定,结果在分子质量约300 bp处可见单一条带,与HPV16E7全长基因大小一致(见图3A),而脑、肝、肺、肾和肌肉等组织未见明显的单一DNA条带(见图3B)。

图1 不同浓度组的肿瘤体积生长情况

图2 肿瘤和其他器官组织的病理切片(×400)

图3 肿瘤及各器官组织DNA PCR检测产物电泳图
2.5免疫组织化学检测结果 新生肿瘤组织及肝、脑、肺、肾等组织切片经免疫组化分析,以HPV16E7特异性兔血清抗体为一抗,以HRP标记的羊抗兔IgG(H+R)抗体为二抗(见图4A),同时以PBS兔血清代替一抗作为阴性对照,其余步骤均一样(见图4B)。结果可见,只有图4A肿瘤组织切片中在细胞质和核膜周围出现团状或点块状棕黄色沉淀颗粒,其他切片结果均未见。
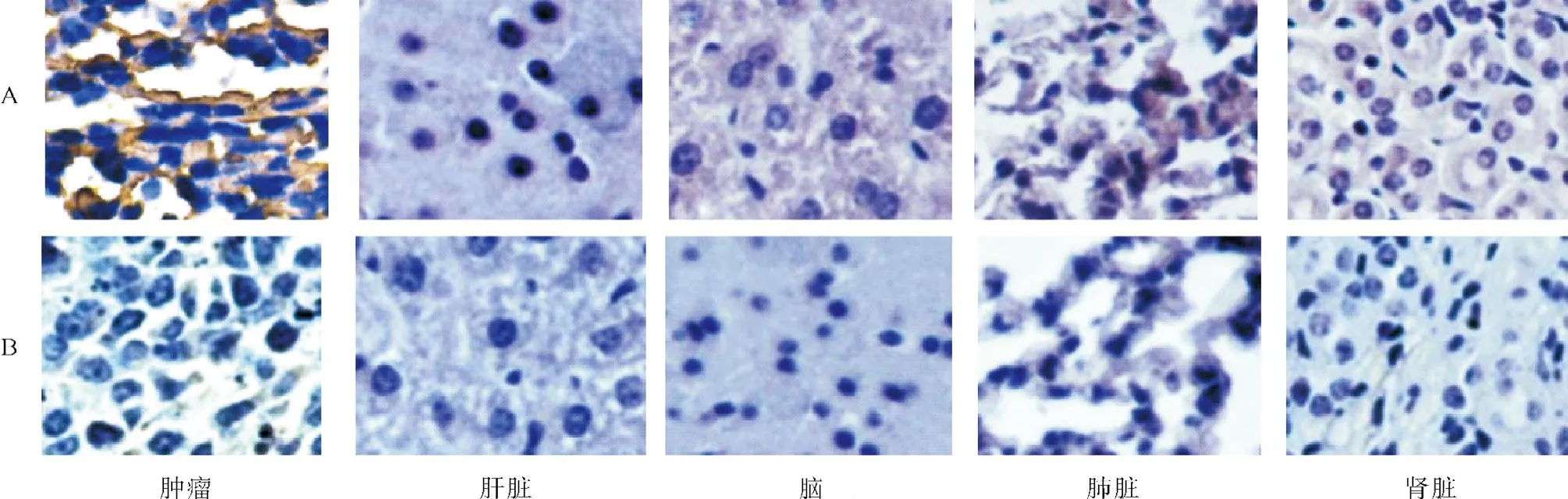
图4 各器官组织细胞中HPV16 E7蛋白的表达(×400)
3 讨论
为了更加深入地研究宫颈癌的发生发展及其治疗,动物模型的建立对基础医学和临床医学研究宫颈癌均有重要的意义。人类理想的动物模型要求其发生部位、类型、病因、发生机制及其生物学行为等方面符合所研究的人类肿瘤[6-7]。至今为止,宫颈癌动物模型的制作主要分为自发性肿瘤模型、诱发性肿瘤模型、基因修饰(转基因)肿瘤模型和移植性肿瘤模型四大类[8],前面三种模型制作方法具有操作复杂,耗时漫长,肿瘤发生率较低且不稳定、发生时间难以预测、个体差异大和成本高昂等缺陷[9]。相比较而言,移植性肿瘤模型具有制作简便的优点。尤其是,裸小鼠的遗传背景明确,性状稳定,因免疫缺陷而不发生免疫排斥反应[10],可进行体表部位肿瘤移植而形成体表移植瘤,是目前应用最广泛的研究动物模型,也是研究肿瘤病因和筛选抗肿瘤新药中最常用的模型[11]。因此,本研究选择裸小鼠作为宫颈癌细胞荷瘤裸鼠进行移植性肿瘤模型的构建。荷瘤裸鼠模型成功率高且对动物损伤小、死亡率低;研究的可重复性好,动物大小、体形及生物学行为等适合于所做的实验研究要求;所用制作方法对人体危害较少,对环境的污染小。
目前报道的人宫颈癌HPV阳性的动物模型主要为HeLa-229荷瘤裸鼠,而人宫颈癌HPV16阳性的SiHa细胞、Caski细胞荷瘤裸鼠模型报道并不深入[12]。本研究采用SiHa(HPV16+)细胞接种裸小鼠建立人宫颈癌动物模型,裸小鼠移植瘤的成功率达100%,移植瘤生长迅速、良好,实验中裸小鼠全部存活,活动良好,体质量逐渐增加,适用于宫颈癌动物模型。实验中,裸鼠成瘤时间与接种的细胞浓度高低有关,浓度越高成瘤时间越短。提示要想短时间建模成瘤,在一定浓度范围内接种细胞浓度越高越好。同时,移植瘤体积大小和接种细胞数呈剂量依赖性(见图1),即同一时间点,肿瘤大小与接种细胞浓度呈正相关;同一浓度的组内,各裸小鼠肿瘤大小也存在差异,甚至差异可达到263.72 mm3,笔者认为此与裸小鼠个体之间的差异有关。在制备动物模型进行肿瘤靶向治疗及生物学特性等研究时,裸小鼠数量足够,才能选择肿瘤大小较一致的个体进行后续实验。此外,随着时间的推移,肿瘤的体积也在不断增大,但达到一定的程度时,肿瘤体积增长速度减缓,而裸小鼠开始出现恶病质的情况,笔者考虑这是由于裸小鼠进入恶病质阶段后,摄取营养能力下降,肿瘤细胞摄取营养的量也较前减少,增长速度减慢。
宫颈癌是一个由癌前病变逐渐衍变为癌的连续性病理过程。目前大量研究已证实HPV是感染宫颈癌的主要危险因素。已有的研究[13]表明,90%以上的宫颈癌标本中有HPV DNA的存在。高危型HPV持续感染及多重感染是导致宫颈癌变的重要原因之一。HPV高危型别的E7是诱导宫颈癌细胞转化的肿瘤原性蛋白,也是转化细胞持续表达的病毒特异性蛋白,因此E7是宫颈癌治疗研究的靶位点[14]。本研究除了一般移植瘤的特性检测之外,对HPV16 E7的特异性指标(即HPV16 E7 DNA和蛋白表达)采用PCR和免疫组化的方法进行鉴定,从而从分子水平进行了人宫颈癌荷瘤裸鼠模型的鉴定。
此外,本研究中荷瘤裸鼠经5周观察,并经解剖大体、病理切片组织学、免疫组化和PCR检测(见图3-4),均未发现有体表肿瘤向各主要器官转移的证据。这表明SiHa细胞荷瘤裸鼠在建模的5周内基本不发生远处转移,可能与本研究采用单细胞悬液皮下接种的方法有关。我们将SiHa细胞悬液移植于腋部皮下,在起初的第1~第4天,裸小鼠皮下有囊性包膜形成,由于血供不丰富,淋巴引流较差,肿瘤细胞在原接种部位生长,而不易造成浸润和转移。肿瘤细胞接种后的第6天,可观察到接种部位囊性包块被吸收而呈现实质性、米粒大小的瘤体。之后,随着裸小鼠周龄的增加,肿瘤也开始增大(见图1)。整个实验过程当中,未发现裸小鼠有偏瘫、行走不稳(脑转移)、呼吸费力、发绀(肺转移)、摄食减退、黄疸、活动度下降(肝转移)等重要器官肿瘤转移的迹象,也未发现生物学行为有较大的变化。我们认为采用单细胞悬液皮下接种的方法具有操作简单、肿瘤表浅、便于观察及测量瘤体大小、潜伏期短、肿瘤生长速度较快且不易转移的优点。
现在,人类已经在HPV的基础研究、病原学诊断等诸多方面有了极大进步,在流行病学领域也得到了准确的资料。本研究通过裸小鼠接种SiHa细胞成功建立了宫颈癌动物模型,以5×107/mL浓度接种最快可在3 d时触摸到米粒大小的瘤体,经观察21 d,瘤体大小可达(200.61±48.04)mm3,可以进行后续的治疗和特性研究。经5周观察,荷瘤裸鼠一般状态良好,没有发生远处转移。同时本实验对HPV16 E7 DNA和蛋白表达分别采用PCR和免疫组化的方法进行鉴定,进一步从分子水平进行了人宫颈癌荷瘤裸鼠模型的鉴定。本实验为宫颈癌相关研究的后续工作,提供了快速建模的剂量-时间数据。和其他报道[15-16]相比,本实验数据更多更细化。相比其他研究者一般仅从组织水平进行验证报道,本研究则分别从分子水平、组织水平及动物的大体水平进行了验证,为后期宫颈癌靶向治疗研究奠定了基础。本研究的技术方法以及实验结果可为建立人宫颈癌HPV16阳性的荷瘤裸鼠模型提供理论依据。
参考文献:
[1]BOSCH F X,MANOS M M.MUÑOZ N,et al.Prevalence of human papillomavirus in cervical cancer:a worldwide perspective.International biological study oncervical cancer (IBSCC) Study Group[J].J Natl Cancer Inst,1995,87(11):796-802.
[2]赵超,魏丽惠.HPV疫苗的安全性问题[J].实用妇产科杂志,2010,26(3):174-177.
[3]邵华江,石一复.人乳头状瘤病毒与子宫颈癌防治进展[J].实用肿瘤杂志,2010,25(1):5-7.
[4]于洪升,费从合,沈方臻,等.低剂量辐射对肿瘤细胞凋亡、细胞周期以及凋亡相关蛋白bcl-2的影响[J].中华放射医学与防护杂志,2003,23(3):171-174.
[5]王冰冰,涂建欣,吕艳,等.HPV16型E7重组蛋白的表达及其多克隆抗体的制备[J].细胞与分子免疫学杂志,2014,30(2):167-170,175.
[6]高晓会,于世英,许三鹏,等.Celecoxib在人癌裸鼠移植瘤抗癌与放射增敏的作用机制研究[J].肿瘤防治研究,2005,32(1):4-7.
[7]CHRISTOFFERSON R H,SKOLDENBERG E G,NILSSON B O.Tumor growth in a defined microcirculation[J].APMIS,1997,105(6):487-496.
[8]KAUFMANN Y,LUO S,JOHNSON A,et al.Timing of oral glutamine on DMBA-induced tumorigenesis[J].J Surg Res,2003,111(1):158-165.
[9]XIE W H,ZHANG B,WANG L H,et al.Biodistribution characteristics and SPECT imaging of (99m) Tc-RET and (99m) Tc-REG in human lung cancer xenografts[J].Cancer Biother Radiopharm,2015,30(3):117-124.
[10]HAO G W,CHEN Y S,He D M,et al.Growth of human colon cancer cells in nude mice is delayed by ketogenic diet with or without omega-3 fatty acids and medium-chain triglycerides[J].Asian Pac J Cancer Prev.2015,16(5):2061-2068.
[11]徐立新,叶云飞,马戎,王海琳.裸小鼠人宫颈癌组织模型的建立及其生物学特性初探[J].肿瘤防治研究,2010,37(9):1017-1021.
[12]LEDOUX D,HAMMA-KOURBALI Y,DI BENEDETTO M,et al.A new dimethyl ester bisphosphonate inhibits angiogenesis and growth of humane epidermoid carcinoma xenograft in nude mice[J].Antieaneer Drugs,2006,17(4):479-485.
[13]STOLER M H.Human papillomaviruses and cervical neoplasia:a model for carcinogenesis[J].Int J Gynecol Pathol,2000,19(1):16-28.
[14]MUNAGALA F,AQIL F,JEYABALAN J,et al.Tanshinone IIA inhibits viral oncogene expression leading to apoptosis and inhibition of cervical cancer[J].Cancer Lett,2015,356 (2 Pt B):536-546.
[15]STONE S C,ROSSETTI R A,LIMA A M,et al.HPV associated tumor cells control tumor microenvironment and leukocytosis in experimental models[J].Imm Inflamm Dis,2014,2(2):63-75.
[16]姜育燊.宫颈癌SiHa细胞系β-hCG表达体系在肿瘤监控动物模型中的应用[D].山东大学,2007.
(本文编辑:吴昔昔)
Establishment and identification of human cervical cancer SiHa cells tumor bearing model in nude mice
HOU Bailong1,DU Wangqi1,XIONG Yirong1,CAI Yiqi2,SONG Yilin1,LING XiaoYun1,XUE Xiangyang1,ZHANG Lifang1.1.Institute of Molecular Virology and Immunolog,Department of Microbiology and Immunology,Wenzhou Medical University,Wenzhou,325035; 2.Department of Gastrointestinal Surgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Abstract:Objective:To establish human cervical cancer SiHa cells tumor bearing model on the body surface area in nude mice,and analyze its tumor characteristics.Methods:Three groups nude mice were subcutaneous inoculated with 5×106/mL,1×107/mL and 5×107/mL concentrations of cervical cancer SiHa cells in the right axillary close to upper limbs,to establish human cervical cancer SiHa cells tumor bearing model in nude mice.The tumor of nude mice was observed and the size of tumor was measured.The histological characteristics of tumor tissue was observed by pathological method after 5 weeks.HPV16E7 DNA of tumor tissue was comfirmed by PCR assay,and the expression of HPV16 E7 protein in tumor tissue was detected by immunohistochemistry method.Results:The tumor rate of 3 groups of nude mice inoculation with SiHa cell line was 100%.Their tumor sizes reached up (77.29±28.34) mm3,(178.91±61.55) mm3and (305.11±12.62) mm3after 5 weeks,and there was a significant difference among 3 groups (P<0.001).Pathology observation showed the growth of SiHa cell tumors were mainly in local infiltration.Histopathological of slice observation showed the new SiHa cells tumor tissue appeared pathological characteristics of large volume,large nucleus,nucleus deep dyeing and the mitotic phase.HPV16E7 DNA and the protein expression were positive comfirmed by PCR and immunohistochemistry detection respectively in tumor tissue.Conclusion:Human cervical cancer SiHa cells tumor bearing model in nude mice was established successfully,and provide an ideal animal model for human cervical cancer tumor targeted therapy and biological research.
Key words:uterine cervical neoplasms; animal models; BALB/c nude mice; SiHa cells
通信作者:张丽芳,教授,Email:wenzhouzlf@126.com。
作者简介:侯柏龙(1988-),女,山西晋城人,检验技师,硕士。
基金项目:国家自然科学基金资助项目(81176423)。
收稿日期:2015-03-24
[中图分类号]R3
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.02.004
