全肺去细胞生物支架的制备与鉴定
2016-04-08陈婵王志斌翁杰虞青徐恩盼陈纳孟卓杜晓红陈世新温州医科大学附属第一医院老年医学科浙江温州505温州医科大学解剖学教研室浙江温州505温州医科大学附属第二医院急诊科浙江温州507温州医科大学第二临床医学院临床医学系浙江温州505
陈婵,王志斌,翁杰,虞青,徐恩盼,陈纳,孟卓,杜晓红,陈世新(.温州医科大学附属第一医院 老年医学科,浙江 温州 505;.温州医科大学 解剖学教研室,浙江温州 505;.温州医科大学附属第二医院 急诊科,浙江 温州 507;.温州医科大学 第二临床医学院临床医学系,浙江 温州 505)
全肺去细胞生物支架的制备与鉴定
陈婵1,王志斌2,翁杰3,虞青4,徐恩盼4,陈纳4,孟卓4,杜晓红1,陈世新2
(1.温州医科大学附属第一医院 老年医学科,浙江 温州 325015;2.温州医科大学 解剖学教研室,浙江温州 325035;3.温州医科大学附属第二医院 急诊科,浙江 温州 325027;4.温州医科大学 第二临床医学院临床医学系,浙江 温州 325035)
[摘 要]目的:通过聚乙二醇辛基苯基醚(TritonX-100)、十二烷基磺酸钠(SDS)灌注法制备大鼠全肺去细胞生物支架,并对其进行鉴定。方法:20只SD大鼠随机数字表法分成去细胞组与正常对照组,每组10只,分别取心、肺联合体,去细胞组经右心室置入留置针至肺主动脉,恒温37 ℃依次灌注肝素化PBS溶液、1% TirtonX-100、0.8% SDS及去离子水。进行DNA定量分析,HE染色及免疫荧光观察残留细胞及细胞核成分,丙烯腈-丁二烯-苯乙烯树脂(ABS)铸型观察肺内血管分布情况。结果:去细胞组DNA含量为(40.37±5.01)ng/mg,较正常对照组的(846.64±65.70)ng/mg下降95%以上;HE染色及免疫荧光染色见去细胞组肺生物支架保留了大量细胞外基质,未见明显细胞及细胞核成分残留;血管铸型标本显示去细胞组血管分布与正常对照组相仿,其分支完整、清晰。结论:TritonX-100、SDS灌注法可有效清除肺内细胞成分,较好地保留细胞外基质(ECM)和血管网络结构,是一种简便且较为理想的制备组织工程肺生物支架方法。
[关键词]去细胞;肺;细胞外基质;组织工程;大鼠
肺移植被认为是终末期肺疾病唯一有效的治疗手段,但临床上供体肺来源匮乏[1],患者移植后的免疫抑制、慢性排斥和潜在的疾病传播等问题严重制约肺移植术的开展。随着组织工程技术的发展,应用人工肺替代移植肺成为肺移植治疗的新方向[2]。人工肺的构建主要依赖复杂的细胞源、支架材料及培养环境三个要素,其中适宜的支架材料是构建人工肺的重要基础[3]。近年来,有研究报道利用去细胞技术制备天然生物支架材料,其生物相容性好,能被异种宿主耐受,且可被机体降解[4]。因此,去细胞技术逐渐成为组织工程研究领域的热点。本研究主要采用化学去垢剂洗涤法成功制备大鼠全肺去细胞生物支架,为研究组织工程肺的生物支架材料提供了一种较理想的方法。
1 材料和方法
1.1材料
1.1.1实验动物:健康雄性SD大鼠20只,体质量(290±20)g,购自温州医科大学实验动物中心,SPF级无菌环境饲养,动物生产许可证号:SCXK(浙)2010-0044。
1.1.2主要试剂:十二烷基磺酸钠(SDS)、聚乙二醇辛基苯基醚(Triton-X100,美国Sigma公司);青霉素-链霉素抗生素混合液(上海博蕴生物有限公司);DNA检测试剂盒(美国Omega公司);兔抗胶原IV蛋白抗体、层粘连蛋白(laminin,LN)抗体、弹性蛋白抗体、4’,6-二脒基-2-苯基吲哚(DAPI)染色液、丙烯腈-丁二烯-苯乙烯树脂(ABS)苏丹红溶剂(美国Invitrogen公司)。
1.2方法
1.2.1动物分组与处理方法:20只SD大鼠按随机数字表法分成去细胞组与正常对照组,每组10只。对照组SD大鼠按0.3 mL/100 g 10%水合氯醛行腹腔注射麻醉,全麻后打开胸腔,分离出下腔静脉,从下腔静脉注射肝素2 mL,行全身肝素化处理,分离切取新鲜全肺和心脏。去细胞组在正常对照组基础上,采用去细胞技术制备全肺去细胞支架。
1.2.2肺脏去细胞生物支架制备:参考文献[5],将分离切取新鲜全肺和心脏,从右心室插入动脉22 G留置针,置管至肺主动脉后结扎固定,肝素PBS冲洗肺脏残留血液至肺呈土黄色。采用TritonX-100、SDS灌注法,将灌注液从肺主动脉按下列顺序灌注,先500 mL 1% TirtonX-100灌注,再2 000 mL 0.8%的SDS灌注,最后去离子水灌注4 h,整个灌注过程恒温37 ℃,灌注压控制在8 mmHg以内,灌注液流速约8 mL/min。灌注过程中观察各时间点肺脏颜色及形态的变化,将制备的肺去细胞生物支架用PBS冲洗干净,4 ℃含抗生素PBS保存备用。
1.2.3去细胞全肺生物支架的观察与鉴定方法:①大体观察:观察新鲜全肺及灌注过程各时间点全肺的颜色及形态变化。②基因组DNA含量分析:分别切取正常对照组与去细胞组肺组织约100 mg,经匀浆、细胞裂解、去蛋白及纯化后,提取基因组DNA(参照DNA试剂盒说明操作),紫外分光光度计测定其浓度。③HE染色观察:正常对照组及去细胞组肺组织经4%多聚甲醛固定,酒精梯度脱水、二甲苯透明、浸蜡、包埋、切片,常规HE染色后光镜下观察。④免疫荧光染色观察:分别制备正常对照组及去细胞组肺组织石蜡切片,DAPI免疫荧光染色2组肺组织细胞核。⑤去细胞组同时行胶原IV、LN及弹性蛋白免疫荧光染色,具体参考试剂说明书操作,荧光显微镜下观察,细胞核呈蓝色荧光,细胞外基质(extracellular matrix,ECM)主要蛋白成分免疫荧光染色出现绿色荧光为阳性表达。⑥肺动脉血管铸型观察:正常对照组及去细胞组全肺组织分别经肺动脉灌注10% ABS苏丹红溶剂2~3 mL,灌注时保持压力恒定,PBS液冲洗冷却,50%盐酸腐蚀l~3 d,清水冲洗干净,体视显微镜下观察2组肺内血管形态及分布。
1.3统计学处理方法 采用SPSS18.0统计软件对数据分析处理,正态分布的计量资料用±s表示,组间参数比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.12组大体观 正常对照组肺呈淡粉红色,血管内可见残留血液;去细胞组肺在灌注过程中逐渐由外至内变白,且逐渐变半透明,灌注完毕全肺变为乳白色半透明状,肉眼可清晰观察到肺内血管大体分支形态,见图1。
2.22组基因组DNA含量分析 去细胞组肺支架DNA含量显著低于正常对照组肺组织(P<0.01);去细胞的比例可达95%以上,2组提取的DNA标本A260/ A280比值均在1.8~2.0,标本DNA纯度较高,见表1。2.3 2组HE染色观察 HE染色显示正常对照组肺组织结构呈网格状分布,细胞核清晰;去细胞组肺组织仅可见网格状结构,去细胞支架上未见残存细胞及细胞核等结构,见图2。
2.42组免疫荧光观察 正常对照组肺组织DAPI荧光显示蓝色胞核清晰;去细胞组未见明显DAPI与细胞核结合后发出的蓝色强荧光,见图3A-B。LN、胶原IV及弹性蛋白主要表达于系膜、基膜及ECM中,去细胞组LN、胶原IV蛋白及弹性蛋白免疫荧光染色呈绿色网格状,结构完整,见图3C-E。
2.5肺血管铸型观察 正常对照组及去细胞组肺血管均呈“树枝样”分布,正常对照组肺血管分布密集,形态完整;去细胞组肺内血管分布与正常对照组相仿,血管分支清晰可见,形态完整,见图4。

图1 全肺去细胞过程中肉眼观察变化
表1 2组肺组织DNA含量测定(n=10,±s)

表1 2组肺组织DNA含量测定(n=10,±s)
与正常对照组比:aP<0.01
组别 D N A含量(n g / m g干重) A 2 6 0 A 2 8 0 A 2 6 0 / A 2 8 0正常对照组 8 4 6 .6 4 ± 6 5 .7 0a 1 9 .3 7 8 ± 1 .6 6 9 1 0 .2 9 4 ± 1 .0 3 9 1 .8 8 6 ± 0 .0 5 9去细胞组 4 0 .3 7 ± 5 .0 1a 0 .3 0 8 ± 0 .0 4 5 0 .1 6 6 ± 0 .0 2 1 1 .8 5 3 ± 0 .0 5 5

图2 肺组织病理学HE染色(×200)
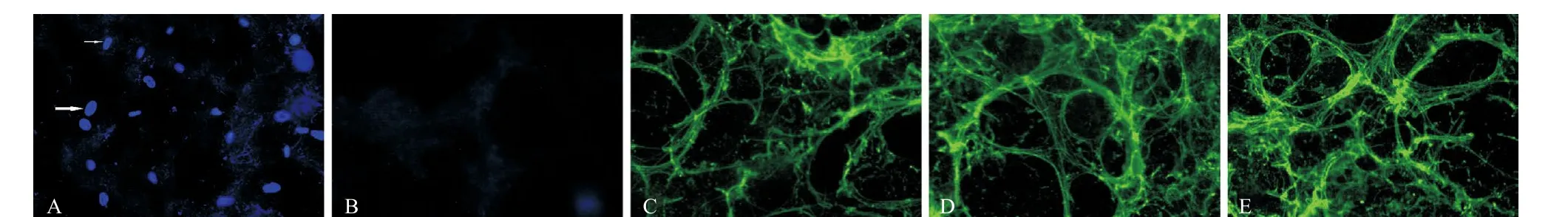
图3 免疫荧光染色(×400)

A:正常对照组:肺动脉分布密集,形态完整;B:去细胞组:肺动脉血管分布与正常对照组相仿,血管分支清晰完整
3 讨论
去细胞生物支架制备技术主要是通过酶学法和化学法浸泡灌注组织器官,去除组织器官实质细胞及可溶性蛋白成分,保留其不溶性ECM[6],其主要成分包括胶原蛋白、弹性蛋白、纤维蛋白、LN等[7],这些蛋白质通过正常比例排列成空间构象,为组织脏器实质细胞提供生长发育的附着点,是维持脏器正常结构与功能的组织学基础。2008年Ott等[8]采用小鼠离体心脏,经去细胞技术制备心脏ECM,并重新注入新生小鼠细胞,体外培养后使心脏复跳,这一研究使体外器官组织再生成为可能。
目前,国内外学者已经成功制备了肺脏、心脏、肾脏、皮肤、血管、神经、肌腱等组织器官的去细胞生物支架。制备方法主要通过胰蛋白酶、脱氧核糖核酸。去细胞组肺支架DNA含量显著低于正常对照组肺组织(P<0.01),去细胞的比例可达95%以上,2组提取的DNA标本A260/A280比值均在1.8~2.0,表明标本DNA纯度较高。
胰蛋白酶消化水解,联合灌注SDS、Trition X-100、Trition X-200、脱氧胆酸钠等化学去垢剂[9-10]。胰蛋白酶的主要作用是使细胞间的蛋白质水解,从而使细胞离散,但有研究报道,胰蛋白酶可水解胶原蛋白和弹力蛋白,对组织ECM结构破坏严重[10],而胶原和弹性蛋白是决定肺基质力学性能的最主要成分[11]。为了较好地保留肺组织ECM成分,本研究未使用胰蛋白酶,仅使用TritonX-100、SDS化学去垢剂,其中离子型去污剂SDS的使用被认为能减轻ECM超微结构的破坏[12]。值得注意的是利用离子型化学去垢剂去细胞后,残存的去垢剂会产生细胞毒性[13],因此需将制备的去细胞肺支架反复用去离子水及PBS液冲洗干净。另外,理想的去细胞生物支架除保留关键的ECM功能组分外,也应除尽富含DNA的核酸成分[14]。文献报道,去细胞支架DNA浓度小于50 ng/mg(干重),DAPI免疫荧光染色或HE染色未见明显细胞核结构,可有效防止移植后的免疫排斥反应[15],但大多数方法制备的肺去细胞支架上仍保留残存的细胞质、细胞核等成分[16]。本课题组制备的全肺去细胞支架经HE染色、免疫荧光染色等鉴定,结果表明能较完全地去除肺组织细胞及细胞核结构,同时较完整地保留ECM主要成分(弹性蛋白、LN、IV型胶原等)。组织工程肺构建的另一关键点是肺血管网络的重建,这需要制备的肺去细胞生物支架具备完整的肺血管三维空间结构,以便组织工程肺能更好地参与血液运输和气体交换[17]。通过血管铸型实验表明,去细胞后的肺支架血管网络结构保留完整,肉眼观察与正常肺血管网络结构相仿。
本研究制备全肺去细胞支架的方法简便易行,且成本低,是一种较理想的制备组织工程肺生物支架材料的方法,为将来进一步制备替代移植肺的生物学功能材料提供实验基础。
参考文献:
[1]VALAPOUR M,PAULSON K,SMITH J M,et al.OPTN/ SRTR 2011 annual data report:lung[J].Am J Transplant,2013,13(Suppl 1):149-177.
[2]CHISTIAKOV D A.Endogenous and exogenous stem cells:a role in lung repair and use in airway tissue engineering and transplantation[J].J Biomed Sci,2010,17(1):92.
[3]丁斐.再生医学[M].2版.北京:人民卫生出版社,2012,6-10.
[4]BADYLAK S F,GILBERT T W.Immune response to biologic scaffold materials[J].Semin Immunol,2008,20(2):109-116.
[5]张建色,王辉,邵培刚,等.去细胞全肾生物支架的制备与鉴定[J].解剖学报,2012,43(2):253-257.
[6]MIRZARAFIE A,GRAINGER R K,THOMAS B,et al.A fast and mild decellularization protocol for obtaining extracellular matrix[J].Rejuvenation Res,2014,17(2):159-160.
[7]O’NEILL J D,ANFANG R,ANANDAPPA A,et al.Decellularization of human and porcine lung tissues for pulmonary tissue engineering[J].Ann Thorac Surg,2013,96(3):1046-1055.
[8]OTT H C,MATTHIESEN T S,GOH S K,et al.Perfusion-decellularized matrix:using nature’s platform to engineer a bioartificial heart[J].Nat Med,2008,14(2):213-221.
[9]PRICE A P,ENGLAND K A,MATSON A M,et al.Development of a decellularized lung bioreactor system for bioengineering the lung:the matrix reloaded[J].Tissue Eng Part A,2010,16(8),2581-2591.
[10]SARRAF C E,HARRIS A B,MCCULLOCH A D,et al.Heart valve and arterial tissue engineering[J].Cell Prolif,2003,36(5):241-254.
[11]PETERSEN T H,CALLE E A,NIKLASON L E.Strategies for lung regeneration[J].Materials Today,2011,14(5):196-201.
[12]BADYLAK S F,TAYLOR D,UYGUN K.Whole-organ tissue engineering:decellularization and recellularization of three-dimensional matrix scaffolds[J].Annu Rev Biomed Eng,2011,13:27-53.
[13]CRAPO P M,GILBERT T W,BADYLAK S F.An overview of tissue and whole organ decellularization processes[J].Biomaterials,2011,32(12):3233-3243.
[14]NICHOLS J E,NILES J A,CORTIELLA J.Production and utilization of acellular lung scaffolds in tissue engineering[J].J Cell Biochem,2012,113(7):2185-2192.
[15]CRAPO P M,GILBERT T W,BADYLAK S F.An overview of tissues and whole organ decellularization processes[J].Biomaterials,2011,32(12):3233-3243.
[16]GILBERT T W,FREUND J M,BADYLAK S F.Quantification of DNA in biologic scaffold materials[J].J Surg Res,2009,152(1):135-139.
[17]WAGNER W R,GRIFFITH B P.Reconstructing the lung[J].Science,2010,329(5991):520-522.
(本文编辑:吴彬)
Preparation and identification of a whole lung decellularized scaffold
CHEN Chan1,WANG Zhibin2,WENG Jie3,YU Qing4,XU Enpan4,CHEN Na4,MENG Zhuo4,DU Xiaohong1,CHEN Shixin2.1.Department of Geriatric Medicine,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015; 2.Department of Anatomy,Wenzhou Medical University,Wenzhou,325035; 3.Department of Emergency,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou,325027; 4.The Second Clinical Medical College,Wenzhou Medical University,Wenzhou,325035.
Abstract:Objective:To prepare a whole lung decellularized scaffold that was perfused with TritonX-100 and SDS,and to perform preliminary identification.Methods:Twenty SD rats were divided into two groups of 10 case in each randomly (decellularization and control group).Hearts and lungs were harvested from SD rats.In decellularization group,the arterial catheters were inserted through the aortopulmonary to establish channels for whole lung perfusion successively with heparinized PBS solution,1% TirtonX-100,0.8% SDS and deionized water in 37 ℃.The DNA concentration was determined after decellularization,and the scaffold and native lung were observed by HE staining,immunotluorescence and vascular cast.Results:Quantitative analysis of DNA content within the decellularized scaffold was (40.37±5.01) ng/mg,which showed a significant decrease compared to the native lung [(846.64±65.70) ng/mg].A lot of collagen fibers could be observed with HE and immunohistochemistry stain but no visible cell nuclei remained after decellularization.Cast specimen showed that pulmonary arteries were still full and clear compared with the native lung.Conclusion:The method of perfusion with TritonX-100 and SDS can effectively remove all cellular components,and retain the extracellular matrix and vascular network structure well.It’s a convenient and ideal preparation method on decellularized lung scaffold for tissue engineering.
Key words:decellularization; lung; extracellular matrix; tissue engineering; rats
通信作者:陈世新,教授,Email:CSX8260723@163.com。
作者简介:陈婵(1981-),女,浙江温州人,主治医师,硕士。
基金项目:浙江省自然科学基金资助项目(LY14H180008);浙江省卫生厅科研基金资助项目(2014KYB153);温州市公益性科技计划项目(Y20140688)。
收稿日期:2015-09-15
[中图分类号]R322.3
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.02.003
