芳姜黄酮对照品制备
2016-04-08潘博文王慧娟刘雄伟刘雄利
石 洋, 潘博文, 王慧娟, 刘雄伟, 曹 煜, 刘雄利, 周 英*
(1.贵州大学药学院,贵州省中药民族药创制工程中心,贵州贵阳550025;2.贵阳医学院附属医院皮肤科,贵州贵阳550025)
芳姜黄酮对照品制备
石 洋1, 潘博文1, 王慧娟1, 刘雄伟1, 曹 煜2, 刘雄利1, 周 英1*
(1.贵州大学药学院,贵州省中药民族药创制工程中心,贵州贵阳550025;2.贵阳医学院附属医院皮肤科,贵州贵阳550025)
摘要:目的 以姜黄挥发油为原料,建立高纯度芳姜黄酮对照品的制备方法。方法 硅胶柱层析和制备型HPLC法对姜黄挥发油进行分离纯化,EI-MS、1H-NMR和13C-NMR等手段确认对照品结构,TLC和HPLC法检测对照品纯度,温度、湿度和光照试验考察对照品稳定性,HPLC法研究芳姜黄酮含有量测定的色谱条件。结果 所得芳姜黄酮的纯度大于99%,其外观性状无变化,含有量稳定。另外经考察,确定色谱条件为Hedera C18色谱柱(4.6 mm×200 mm,5 μm);检测波长242 nm;流动相甲醇-水(80∶20);进样量10 μL;柱温25℃;体积流量0.8 mL/min。结论 该方法制得的芳姜黄酮对照品符合中药化学对照品相关要求,可用于姜黄药材及其制剂的质量控制。
关键词:姜黄挥发油;芳姜黄酮;对照品;制备工艺
dol:10.3969/j.issn.1001-1528.2016.02.054
姜黄为姜科姜黄属植物姜黄Curcuma longa L.的干燥根茎[1],始载于《唐本草》[2],其根茎入药,具有破血行气,通经止痛功效。现代医学研究表明,姜黄具有抗炎、抗氧化、抗菌及抗肿瘤作用。姜黄属植物主要包含姜黄挥发油和姜黄素两大类成分[3-8],其中姜黄挥发油中含有芳姜黄酮、姜烯等化合物[9-12],不仅有抗肿瘤、抗癌、抗菌和止咳平喘的作用,而且还能增强免疫功能[13-15]。
在现有的制剂(如“姜黄消痤搽剂”)企业质量标准中,含有量测定项主要是针对姜黄素和芦丁两种成分,但芦丁为“姜黄消痤搽剂”的非专属性成分,另外仅以姜黄素为含有量测定指标时,难以全面反映该复方制剂的质量。由于芳姜黄酮在“姜黄消痤搽剂”中的含有量相对较高,并且为专属性的活性成分,因此在测定项中新增芳姜黄酮的含有量测定,将能以多监控指标的评价方式来实现“姜黄消痤搽剂”的质量控制。
本实验研究了从姜黄挥发油中分离和纯化芳姜黄酮的方法,现已成功制备出芳姜黄酮对照品,可为其制备提供借鉴和参考。
1 材料与仪器
1.1 材料 姜黄挥发油(贵阳舒美达制药厂有限公司);柱色谱、薄层色谱硅胶(青岛海洋化工有限公司);乙腈、甲醇为色谱纯(德国Merck公司);其它试剂均为分析纯。
1.2 仪器 Agi1ent1260分析型、制备型HPLC色谱仪,包括四元及二元泵、自动及手动进样器、柱温箱、DAD及可变紫外检测器、ChemStation色谱工作站(美国Agi1ent Techno1ogies公司);FA2004型电子天平(上海良平仪器仪表有限公司);RE-2000A型旋转蒸发仪(上海亚荣生化仪器厂);ZF-20D型三用紫外分析仪(上海予正仪器设备有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司);Bruker-400核磁共振仪,TMS为内标(德国Bruker公司);HP-5973质谱仪(美国惠普公司)。
2 方法与结果
2.1 芳姜黄酮的分离纯化
2.1.1 硅胶柱层析分离 取姜黄挥发油10 g,用石油醚溶解,置于瓷蒸发皿中,以12 g硅胶拌样,挥干溶剂后湿法上柱,石油醚-乙酸乙酯(15∶1)开始洗脱,TLC展开剂为石油醚-乙酸乙酯(15∶1),254 nm下观察。根据TLC显示结果,收集Rf=0.7处的混合物,得到组分1 7.3 g,继续以石油醚-乙酸乙酯(50∶1)洗脱,收集Rf=0.5处的混合物,得到组分2 5.2 g。然后,HPLC法对组分2进行定性分析,色谱柱为Hedera C18(4.6 mm×200 mm,5 μm);流动相为甲醇-水(90∶10);柱温25℃;检测波长254 nm;进样量15 μL,结果见图1。

注:图中的3个峰从左至右,分别定为组分1、组分2和组分3图1 姜黄挥发油的HP L C图谱
2.1.2 制备型HPLC色谱分离 应用制备型HPLC色谱柱对Fr.2进行分离,色谱柱为Agi1ent ZORBAX SB-C18(21.2 mm×250 mm,5 μm);流动相甲醇-水(80∶20);体积流量10 mL/min;检测波长254 nm;进样量0.4 mL。结果,共收集得到3个组分,浓缩蒸干,即得组分1、组分2和组分3,然后对其进行EI-MS、1H-NMR、13C-NMR测定。
2.1.3 结构确认 通过EI-MS、1H-NMR、13C-NMR测定,确定组分1为芳姜黄酮。其中,EI-MS m/z: 216(M+,6),201(M+-Me,7),132(11),119(44),91(25),83 (100),77(14),55(70),与谱库中芳姜黄酮数据的匹配率为98%。1H-NMR(CDC13,400 MHz)δ: 1.17(3H,d,J=7.2 Hz),1.78(3H,d,J=1.2 Hz),2.03(3H,d,J= 0.8 Hz),2.23(3H,s),2.50-2.56(1H,m),2.61-2.66 (1H,m),3.19-3.24(1H,m),5.95(1H,dd,J=1.2,0.8 Hz),7.03(4H,d,J=1.2 Hz)。13C-NMR(CDC13,100 MHz)δ: 20.7,21.0,22.0,27.7,35.3,52.7,124.1,126.7,129.1,135.6,143.7,155.1,199.9。
2.2 芳姜黄酮的纯度检测
2.2.1 薄层色谱法 取芳姜黄酮适量,加甲醇溶解,制成每1 mL含1 mg化合物的溶液,作为供试品。然后,分别吸取2、5、10、15、20 μL,点于硅胶GF254薄层板上,采用上行展开方式,依次以石油醚-乙酸乙酯(15∶1)、正己烷-丙酮(25∶1)、正己烷-氯仿(5∶1)为展开剂,254 nm下观察,碘蒸气显色。结果,经3个展开系统、2种显色方式检测时,TLC上均呈现单一斑点,而且未见杂质。
2.2.2 HPLC色谱法 采用分析型Agi1ent1260型HPLC色谱仪,色谱柱为Hedera C18(4.6 mm×200 mm,5 μm);柱温25℃;流动相甲醇-水(80∶20);进样量10 μL;体积流量1.0 mL/min;分别设定204、220、254、280、310 nm 5个信号通道检视,用于考察芳姜黄酮的纯度。
取芳姜黄酮适量,加甲醇溶解,制成每1 mL含1 mg化合物的溶液,作为供试品,然后取空白溶剂(甲醇)和供试品溶液各10 μL,按上述色谱条件测定。结果,扣除溶剂干扰峰后,芳姜黄酮的色谱峰面积归一化含有量在各波长均大于99%,见表1。

表1 芳姜黄酮在各波长下归一化含有量的测定结果
2.3 芳姜黄酮稳定性考察 按照《中国药典》2010年版二部附录XIXC“原料药与药物制剂稳定性试验指导原则”,对芳姜黄酮进行室温、高湿、强光照射影响因素试验。然后,按“2.2.2”项下方法检测芳姜黄酮的纯度。
2.3.1 室温试验 由于芳姜黄酮为挥发性成分,故将温度设定为室温25℃,放置10 d,然后分别于第0、5、10天取样分析。结果表明,芳姜黄酮在该条件下放置10 d后,外观性状无变化,含有量稳定,见表2。

表2 芳姜黄酮温度试验的结果(峰面积归一化结果,%)
2.3.2 高湿试验 在温度25℃、相对湿度90%下放置10 d,然后分别于第0、5和10天取样分析。结果表明,芳姜黄酮在该条件下放置10 d后,外观性状无变化,含有量稳定,吸湿增重小于5%,见表3。

表3 芳姜黄酮高湿试验(峰面积归一化结果,%)
2.3.3 强光照试验 于照度(4 500±500)1x下放置10 d,然后分别于第0、5和10天取样分析。结果表明,芳姜黄酮在该条件下放置10 d后,外观性状无变化,含有量稳定,见表4。

表4 芳姜黄酮光照试验(峰面积归一化结果,%)
2.4 芳姜黄酮对照品含有量测定色谱条件考察
2.4.1 检测波长考察 利用DAD二极管阵列检测器的全波长扫描功能,对芳姜黄酮供试液进行190~400 nm下的全波长扫描,进行考察。结果表明,供试液在242 nm处有最大吸收,故选择242 nm作为检测波长。
2.4.2 流动相考察 取芳姜黄酮供试液适量,分别以乙腈-水(80∶20)、甲醇-水(80∶20)、甲醇-0.05%磷酸水溶液(80∶20)、甲醇-0.1%磷酸水溶液(80∶20)、甲醇-0.3%磷酸水溶液(80∶20)为流动相,在242 nm下检测,进行考察,结果见表5。由表可知,以甲醇-水(80∶20)为流动相时,对称因子最高。
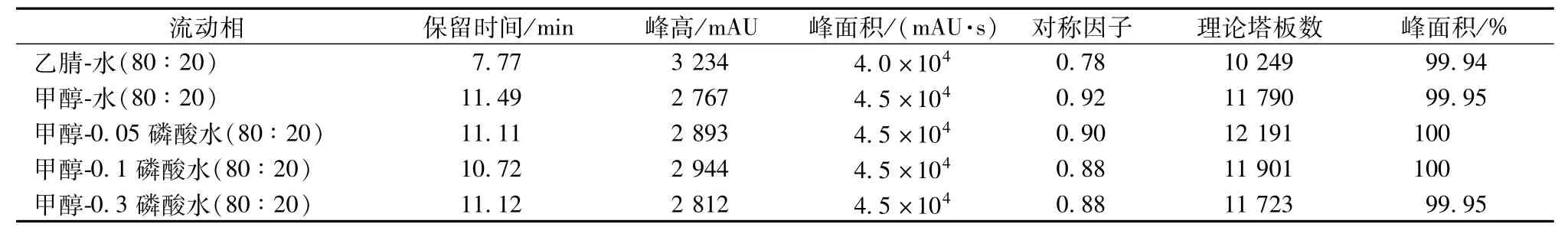
表5 流动相研究结果
2.4.3 柱温的考察 取芳姜黄酮供试液适量,分别设置柱温为25、30、35℃,进行考察,结果见表6。由表可知,当柱温为25℃时,基线稳定,对称因子最高。

表6 柱温研究结果
2.4.4 流量的考察 取芳姜黄酮供试液适量,分别设置体积流量为0.8、1.0、1.2 mL/min,进行考察,结果见表7。由表可知,当体积流量为0.8 mL/min时,对称因子和理论塔板数最高。

表7 流量研究结果
2.4.5 色谱柱的考察 取芳姜黄酮供试液适量,以检测波长242 nm、柱温25℃、流动相甲醇-水(80∶20)、体积流量0.8 mL/min、进样量10 μL为色谱条件,分别采用Hedera C18(4.6 mm×200 mm,5 μm)、Agi1ent C8(4.6 mm× 150 mm,5 μm)、Waters C18(4.6 mm×250 mm,5 μm)色谱柱进行测定,结果见表8。由表可知,当色谱柱为Hedera C18(4.6 mm×200 mm,5 μm)时,对称因子和理论塔板数最好。

表8 色谱柱研究结果
2.5 结果 本实验通过反复硅胶柱层析和制备型HPLC法,分离得到芳姜黄酮,其对照品为淡黄色液体,易溶于二氯甲烷和丙酮。然后,对其进行了结构鉴定、纯度检测、稳定性和色谱条件考察。
经EI-MS测定,它与谱库中的芳姜黄酮数据匹配率为98%,而且1H-NMR和13C-NMR测定结果与标准数据一致。
在硅胶GF254薄层板上,经3个展开系统、2种显色方式检测时,均呈现单一斑点,而且未见杂质。然后HPLC检测时发现,芳姜黄酮的色谱峰面积归一化含有量在各波长下均大于99%。
考察了室温、高湿和强光照,分别于第0、5和10 d取样分析。结果表明,芳姜黄酮的外观性状无变化,含有量稳定。
考察了色谱柱、检测波长、流动相、柱温和流量,结果确定色谱条件为Hedera C18色谱柱(4.6 mm×200 mm,5 μm);检测波长242 nm;流动相甲醇-水(80∶20);进样量10 μL;柱温25℃;体积流量0.8 mL/min。
3 结论
本实验制备得到的芳姜黄酮对照品的纯度大于99%,符合国家标准要求,而且路线简单可靠,可用于姜黄药材及其制剂的质量控制。
参考文献:
[1] 汤敏燕,汪洪武,孙凌峰.中药姜黄挥发油化学成分研究[J].江西师范大学学报(自然科学版),2000,24(8): 274-277.
[2] 明·李时珍.本草纲目(校点本):第2册[M].北京:人民卫生出版社,1979: 880.
[3] 陈铁晖,严国鸿,陈 华.姜黄的化学成分及抗肿瘤作用研究进展[J].海峡预防医学志,2004,10(6): 23-25.
[4] 羊 青,晏小霞,王茂媛,等.不同采收期海南姜黄挥发油的GC-MS分析[J].热带作物学报,2014,35(9): 1866-1870.
[5] 李瑞敏,李湘洲,张 胜.姜黄油的不同提取方法及其化学成分的研究[J].中南林业科技大学学报,2013,33(4): 114-116.
[6] 韩 婷,宓鹤鸣.姜黄的化学成分及药理活性研究进展[J].解放军药学学报,2001,17(2): 95-97.
[7] 张印辉,孙 宁.姜黄多种生物活性及其机制的研究进展[J].中国医药指南,2013,11(9): 441-442.
[8] 夏文娟,肖小河,刘峰群,等.国产姜黄属植物的化学成分分析[J].中国中药杂志,1999,24(7): 423,424,434.
[9] A1-Reza S M,Rahman A,Sattar M A,et al.Essentia1oi1com-Position and antioxidant activities of Curcuma aromatica Sa1isb [J].Food Chem Toxicol,2010,48(6): 1757-1760.
[10] 石雪蓉,顾 健,谭 睿.姜黄挥发油抗肿瘤作用机制研究[J].中药药理与临床,2003,19(6): 15-16.
[11] 高丽红,张玉梅,刘艳霞,等.用GC-MS法分析姜黄和片姜黄中挥发油成分并研究其体外抗肿瘤作用[J].药学服务与研究,2014,14(1): 18-21.
[12] 孙秀燕,李秀琴,王金辉,等.姜黄挥发油抗癌活性成分研究[J].中草药,2006,37(7): 982-983.
[13] Kim D,Suh Y,Lee H,et al.Immune activation and antitumor resPonse of ar-turmerone on P388D1 1ymPhob1ast ce11 imP1anted tumors[J].Int JMol Med,2013,31(2): 386-392.
[14] Negi P S,JayaPrakasha G K,Jagan Mohan Rao L,et al.Antibacteria1 activity of turmeric oi1: a byProduct from curcumin manufacture[J]. J Agric Food Chem,1999,47(10): 4297-4300.
[15] Shamim A,A1i M,Shahid H A.Vo1ati1e oi1 comPosition and antimicrobia1activity of Curcuma oligantha var.1utea rhizomes [J].Int JRes Ayurveda Pharm,2012,3(5): 742.
[医院药房]
*通信作者:周 英(1971—),女,教授,博士生导师,从事中药新剂型研究。Te1: 13595102335,E-mai1: yingzhou71@126.com
作者简介:石 洋(1989—),女,硕士,从事天然药物成分及活性生理研究。E-mai1: xiaoyewater@163.com
基金项目:贵州省中药现代化科技产业研究开发专项项目(黔科合中药字[2012]5040)
收稿日期:2014-12-15
中图分类号:R284.1
文献标志码:B
文章编号:1001-1528(2016)02-0464-03
