青蒿素联合顺铂对胃癌细胞增殖、凋亡及上皮间质转化的影响
2016-04-08魏艳霞任佳伟万里新
郭 锰, 魏艳霞, 任佳伟, 万里新*
(1.南阳市中心医院河南473009;2.华北电力大学医院北京102206)
青蒿素联合顺铂对胃癌细胞增殖、凋亡及上皮间质转化的影响
郭 锰1, 魏艳霞1, 任佳伟2, 万里新1*
(1.南阳市中心医院河南473009;2.华北电力大学医院北京102206)
摘要:目的 探讨青蒿素联合顺铂对胃癌SGC-7901细胞增殖、凋亡及上皮间质转化(EMT)的影响。方法 采用青蒿素(50 μmo1/L)、顺铂(10 mg/L)单药或联合处理SGC-7901细胞,根据实验设计将SGC-7901细胞分为4组:对照组、青蒿素组、顺铂组和青蒿素+顺铂组,对照组仅加入培养基;采用噻唑蓝(MTT)比色法检测各组SGC-7901细胞经处理24、48、72、96 h的增殖情况并计算增殖抑制率,采用Annexin V/PI双染流式细胞术检测各组处理24、48 h的凋亡率,免疫印迹法检测各组处理48 h后的EMT相关标记分子(E-cadherin、N-cadherin及Vimentin),采用酶联免疫吸附法(ELISA)测各组处理24、48、72及96 h的细胞上清液中纤连蛋白(FN)水平。结果 与对照组相比,青蒿素组、顺铂组和青蒿素+顺铂组均可呈时间依赖方式提高增殖抑制率,青蒿素+顺铂组在24、48、72和96 h后的增殖抑制率均高于青蒿素组和顺铂组(P<0.05);3组处理后的早、晚期凋亡率及E-cadherin水平均高于对照组,而N-cadherin、Vimentin水平及上清液FN水平均低于对照组,差异有统计学意义(P<0.05);与青蒿素组和顺铂组相比,青蒿素+顺铂组的早、晚期凋亡率及E-cadherin水平较高,N-cadherin和Vimentin水平及上清液FN水平较低,以上差异均有统计学意义(P<0.05)。结论 青蒿素和顺铂对胃癌SGC-7901细胞均有细胞毒性,如抑制增殖、诱导凋亡及抑制EMT;同时,青蒿素联合顺铂对胃癌细胞具有协同增效的作用。
关键词:青蒿素;顺铂;胃癌;增殖;凋亡;上皮间质转化
dol:10.3969/j.issn.1001-1528.2016.02.044
胃癌是目前困扰全球的恶性肿瘤,作为最常见的消化系统恶性肿瘤,其死亡率位居恶性肿瘤第2位;而我国作为胃癌高发国家之一,近年来其发病率有逐年上升的趋势,防治形势严峻[1]。顺铂是治疗恶性肿瘤的常用化疗药物,其可抑制癌细胞的DNA复制过程,具有较强的广谱抗癌作用,但化疗耐药在临床上较为常见[2]。青蒿素是一种从中药青蒿中分离出来的活性成分,临床上用于疟疾的治疗,近年来研究发现该药还具有较强的抗癌活性[3-5]。故推测青蒿素对胃癌也有较好的作用,因此,本研究探讨青蒿素联合顺铂对胃癌SGC-7901细胞增殖和凋亡的影响,并进一步验证其对胃癌细胞上皮间质转化(ePithe1ia1mesenchyma1 transition,EMT)的作用,现将结果报告如下。
1 材料与仪器
1.1 细胞株 胃癌SGC-7901细胞株购自中国科学院上海细胞所。
1.2 药物和试剂 青蒿素、MTT及十二烷基硫酸钠(SDS)购自美国Sigma-A1drich公司;顺铂购于江苏豪森药业股份有限公司;PMI-1640培养基、胎牛血清及双抗(青霉素、链霉素)均购自美国Hyc1one公司;Annexin-FITC/PI凋亡检测试剂盒购自美国BD公司;胎牛血清来自杭州四季青生物工程公司;E-cadherin、N-cadherin、Vimentin、FN及GAPDH抗体购自美国Ce11Siga1ing Techno1ogy公司。
1.3 仪器 BX51型倒置显微镜(日本O1ymPus公司);ZS-2型全自动酶标仪(中国科学院生物物理研究所);FACSCa1ibur型式细胞仪(美国BD公司);BG-sub MIDI型多用途水平电泳仪,(美国Baygene公司)。
2 方法
2.1 细胞培养 将SGC-7901细胞置于RPMI-1640培养基中常规条件培养,具体为10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素,37℃、5% CO2饱和湿度,每隔2~3 d换液,待其达80%~85%融合时进行后续实验。
2.2 细胞增殖检测 取对数生长期SGC-7901细胞,胰蛋白酶消化细胞后制备单细胞悬液,以1×105个/孔接种96孔培养板,待其稳定培养24 h后,分别进行50 μmo1/L青蒿素、10 mg/L顺铂单用或联合处理,根据实验设计将SGC-7901细胞分为4组:对照组、青蒿素组、顺铂组和青蒿素+顺铂组,对照组仅加入培养基,不给予任何药物处理;在常规条件下依次培养24、48、72和96 h后,每孔加入10 μL质量浓度为5 mg/mLMTT溶液,孵育4 h后在全自动酶标仪上以492 nm波长读取吸光值A,根据公式计算增殖抑制率(%)=1-A给药组/A对照组×100%。各浓度设3个复孔,实验重复3次。
2.3 流式细胞术 将SGC-7901细胞按1×106个/孔接种培养板中,根据以上分组实施相应处理,于处理24、48 h后收集各组细胞,依次经PBS冲洗、冷乙醇固定及核糖核酸酶(RNase)处理后,根据凋亡检测试剂盒说明书进行后续操作,加入Annexin V/FITC和PI进行染色,避光染色15 min后上机,采用流式细胞仪测定凋亡率。
2.4 免疫印迹 收集处理48 h后的各组细胞,冰上加入细胞裂解液,裂解后高速离心(10 000 r/min,30 min),收集上清液后采用二喹啉甲酸(BCA)法检测蛋白浓度,取等量蛋白行常规十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,半干转法转膜处理后,根据膜面积依次加入适量E-cadherin、N-cadherin、Vimentin(除E-cadherin为1∶200外,其余均为1∶100),4℃孵育过夜,加入二抗(1∶3 000)室温下摇荡孵育2 h,化学发光法显影后,IPP 6.0软件分析条带光密度,最终结果表示为各条带光密度与内参GADPH的比值。
2.5 酶联免疫吸附法 收集各组处理24、48、72和96 h后的细胞上清液,采用针对FN的检测试剂盒,根据试剂盒说明书检测各组不同处理时间的上清液FN水平。
2.6 统计学处理 采用SPSS 19.0软件对本研究数据进行分析。数据均以“均数±标准差”表示,多组比较采用单因素方差分析(one way ANOVA),两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
3 结果
3.1 青蒿素联合顺铂对SGC-7901细胞增殖的影响 采用MTT法检测发现,与对照组相比,青蒿素组、顺铂组和青蒿素+顺铂组均可呈时间依赖方式提高增殖抑制率(P<0.05);其中青蒿素+顺铂组在24、48、72和96 h后的增殖抑制率均高于青蒿素组和顺铂组(P<0.05)。见表1。

表1 青蒿素联合顺铂对SGC-7 9 0 1细胞增殖抑制率的影响
3.2 青蒿素联合顺铂对SGC-7901细胞凋亡的影响 采用Annexin-FITC/PI双染法检测发现,与对照组相比,其余三组处理24 h、48 h后的早晚期凋亡率均升高,差异有统计学意义(P<0.05);青蒿素+顺铂组处理24 h、48 h后的早晚期凋亡率均高于青蒿素组和顺铂组,差异均有统计学意义(P<0.05)。见表2。

表2 各组处理2 4、4 8 h后细胞凋亡情况分析(%)
3.3 青蒿素联合顺铂对EMT相关标记分子的影响 采用免疫印迹法检测发现,与对照组相比,其余三组处理48 h后的E-cadherin水平升高,N-cadherin和Vimentin水平降低,差异均有统计学意义(P<0.05);青蒿素+顺铂组处理后的E-cadherin水平高于青蒿素组和顺铂组,而N-cadherin和 Vimentin水平均低于青蒿素组和顺铂组,差异有统计学意义(P<0.05);顺铂组的Vimentin水平低于青蒿素组(P<0.05),E-cadherin和N-cadherin水平与青蒿素组的差异无统计学意义(P>0.05)。见表3。
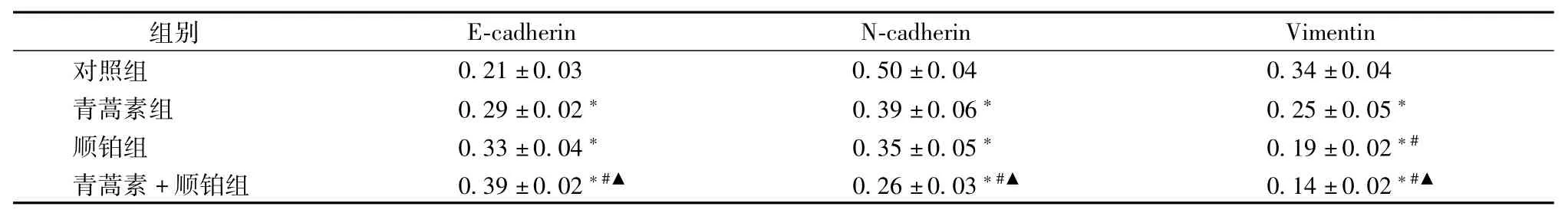
表3 各组处理4 8 h后EMT相关标记分子的表达情况
3.4 青蒿素联合顺铂对细胞上清液FN水平的影响 采用ELISA检测发现,与对照组相比,在24~96 h的时间范围内,其余三组的FN水平均降低,差异均有统计学意义(P<0.05);青蒿素+顺铂组处理后的FN水平均低于青蒿素组和顺铂组(P<0.05);除48 h外,顺铂组处理后的FN水平均低于青蒿素组(P<0.05);随着处理作用时间的增加,青蒿素组、顺铂组和青蒿素+顺铂组的FN水平均降低(P<0.05),呈时间依赖方式。见表4。

表4 各组处理不同时间后细胞上清液FN水平变化(n g/m L)
4 讨论
胃癌是一种恶性消化道肿瘤,由于其发病隐匿且缺乏有效筛查手段,目前大多数患者确诊时已属晚期,无法进行手术,故化疗成为主要的治疗手段。但较强毒副作用及耐药是影响化疗效果的主要因素,而开发抗癌效果强且毒副反应较轻的药物是肿瘤临床工作者的当务之急[6]。青蒿素是世界范围内用于治疗恶性疟疾的临床用药,由于其具有副作用少,在临床上使用较为广泛。随着研究的发现,青蒿素及其衍生物具有较强的抗癌效果,如抑制细胞增殖、诱导凋亡、抑制血管和淋巴结生成[7-8]。王燕等[3]发现青蒿素类药物对结肠腺癌细胞LS174T有细胞毒作用,可呈浓度和时间依赖性抑制细胞增殖。Tan等[4]发现青蒿素可通过激活蛋白激酶信号来抑制神经母细胞瘤增殖。故综合以上证据,本研究推测青蒿素对胃癌有细胞毒性,同时可增强顺铂的细胞毒性。
本研究采用常用胃癌细胞株SGC-7901来探讨青蒿素联合顺铂的抗癌效果,发现青蒿素可增强顺铂对胃癌SGC-7901的细胞毒性,如呈时间依赖方式抑制细胞增殖,表现为细胞的增值抑制率升高,这与其他癌肿的细胞学研究结果一致,如结肠腺癌、神经母细胞瘤及宫颈癌[3-5]。以上提示青蒿素具有较广泛的抗癌效果,但也有研究表明青蒿素对不同种类癌细胞的细胞毒性存在差异,如小鼠肥大细胞瘤(P815)对该药的敏感性强于地鼠肾细胞腺癌(BSR)[9],表明青蒿素的细胞毒作用与癌细胞有关。此外,相关研究发现其类似物二氢青蒿素同样具有较强的抗癌效果,如王爱军等[10]发现该药物可抑制胃癌细胞增殖、粘附及侵袭等过程,而王红钰等[11]发现该药物同样可抑制胃癌的增殖。本研究发现青蒿素可增强顺铂对胃癌的细胞毒性,提示两者在抗肿瘤上具有协同作用,而Suberu等[12]在乳腺癌细胞中也发现了相同结论,如其发现青蒿素联合顺铂处理乳腺癌MCF-7细胞的效果强于两者单独使用。以上表明青蒿素类药物对胃癌细胞有确切的细胞毒作用,由于该药物本身已用于临床,故在抗癌药物的开发及应用上有较为广阔的前景。
除抑制增殖外,本研究发现青蒿素还可诱导胃癌细胞SGC-7901的凋亡,如其处理后的早、晚期凋亡率均升高,其中在处理48 h后的早、晚期凋亡率均高于顺铂组,表明青蒿素诱导胃癌细胞凋亡的能力要强于顺铂,此结果与陈卫强[13]等人的研究结果相符;同时,本研究发现,青蒿素可增强顺铂对胃癌细胞凋亡的诱导作用。顺铂为细胞周期非特异性药物,可通过抑制癌细胞的DNA复制过程来诱导其凋亡,而对于青蒿素的作用机制目前尚无定论,有研究发现其可通过活性氧依赖途径来诱导癌细胞凋亡[14]。此外,相关研究发现青蒿素类似物可通过影响凋亡相关蛋白的表达或线粒体依赖性途径来诱导癌细胞凋亡[15-16]。笔者将在下一步研究中探讨青蒿素联合顺铂诱导胃癌凋亡的机制。
EMT是癌细胞发生侵袭转移的重要步骤,作为生理病理现象,以上皮细胞特性丧失及间质细胞特性获得为重要特征。EMT过程中介导上皮细胞间紧密连接的胞膜蛋白E-cadherin表达下调,间质细胞间的连接蛋白如N-cadherin表达上调[17]。本研究发现青蒿素、顺铂单用或联合使用均可升高上皮标记分子E-cadherin水平,同时降低间质标记分子N-cadherin和Vimentin水平,以上结果表明青蒿素和顺铂均可抑制胃癌细胞的EMT过程。本研究采用ELISA法观察另一间质标记分子FN的水平动态变化,同样发现青蒿素、顺铂单用或联用均可降低其水平,进一步表明两药物均可抑制EMT过程。总体上两者联用效果强于单独使用,表明青蒿素可增强顺铂对EMT过程的抑制作用。
综上所述,青蒿素和顺铂对胃癌SGC-7901细胞均有细胞毒性,如抑制增殖、诱导凋亡及抑制EMT,同时,青蒿素联合顺铂对胃癌细胞具有协同增效的作用。
参考文献:
[1] 邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4): 408-415.
[2] 李恩喜,尹威民,王 旭,等.吉西他滨联合顺铂方案在非小细胞肺癌术后辅助化疗中的疗效及影响因素分析[J].吉林大学学报:医学版,2013,39(1): 122-127.
[3] 王 燕,薛 丹,王锐利,等.青蒿素类药物对结肠腺癌细胞LS174T的细胞毒作用[J].中国医药导报,2013,10 (7): 14-16.
[4] Tan W Q,Chen G,Jia B,et al.Artemisinin inhibits neurob1astoma Pro1iferation through activation of AHP-activated Protein kinase(AMPK)signa1ing[J].Pharmazie,2014,69 (6): 468-72.
[5] Goodrich S K,Sch1ege1CR,Wang G,etal.Use ofartemisinin and its derivatives to treat HPV-infected/transformed ce11s and cervica1 cancer: a review[J].Future Oncol,2014,10(4): 647-654.
[6] 金晓红,朱志图,史 毅,等.胃癌细胞TRAIL耐药机制以及TRAIL联合化疗应用的研究进展[J].吉林大学学报:医学版,2014,40(1): 215-218.
[7] 陆金健.青蒿素类化合物抗肿瘤研究进展[J].中国药理学通报,2010,26(6): 818-820.
[8] 吕江涛,杨 华,郎景和,等.青蒿素衍生物对宫颈癌细胞血管形成相关分子表达和人脐静脉内皮细胞血管形成能力的影响[J].现代妇产科进展,2013,22(11): 877-880.
[9] Ti1aouiM,Mouse H A,Jaafari A,et al.Differentia1effect of artemisinin against cancer ce111ines[J].Nat Prod BioProsPect,2014,4(3): 189-96.
[10] 王爱军,冯俊伟,刘 萱,等.二氢青蒿素体外抑制胃癌细胞的黏附、迁移和侵袭[J].中国老年学杂志,2012,32 (17): 3716-3719.
[11] 王红钰,王爱军,刘 萱,等.二氢青蒿素联合顺铂对胃癌SGC7901细胞增殖和耐药因子表达的影响[J].中国全科医学,2012,15(27): 3130-3134.
[12] Suberu JO,Romero-Cane1ón I,Su11ivan N,etal.ComParative cytotoxicity of artemisinin and cisP1atin and their Interactions with ch1orogenic acids in MCF7 breast cancer ce11s[J].Chem Med Chem,2014,9(12): 2791-2797.
[13] 陈卫强,戚好文,吴昌归,等.双氢青蒿素和顺铂诱导人肺腺癌A549/CDDP细胞凋亡[J].现代肿瘤医学,2007,15 (5): 616-619.
[14] Gangu1i A,Choudhury D,Datta S,et al.Inhibition of autoPhagy by ch1oroquine Potentiates synergistica11y anti-cancer ProPerty of artemisinin by Promoting ROS dePendent aPoPtosis[J]. Biochimie,2014,107(12): 338-349.
[15] 刘静静,费爱梅,聂瑞敏,等.新型青蒿素衍生物SM1044诱导Kasumi-1细胞凋亡及机制的研究[J].中国实验血液学杂志,2011,19(3): 607-611.
[16] 王爱军,冯俊伟,王红钰,等.二氢青蒿素通过线粒体依赖性途径诱导人胃癌细胞凋亡的机制[J].中华实验外科杂志,2012,29(7): 1312-1314.
[17] TiwariN,Ghe1dof A,TatariM,etal.EMT as the u1timate surviva1mechanism of cancer ce11s[J].Semin Cancer Biol,2012,22(3):194-207.
*通信作者:万里新(1967—),女,硕士,主任医师,从事肿瘤生物治疗方面的研究。Te1:(0377)63200007,E-mai1: nanyang1967 @163.com
作者简介:郭 锰(1981—),男,硕士,副主任医师,从事肿瘤临床与用药方面的研究。Te1: 13838708698,E-mai1: 2558692910@ qq.com
收稿日期:2015-03-28
中图分类号:R966
文献标志码:B
文章编号:1001-1528(2016)02-0431-04
