结缔组织病相关间质性肺病的生物标志物
2016-04-08吴超琛
吴超琛,张 晓
(广东省人民医院风湿内科,广州 510080)
间质性肺病(interstitial lung disease,ILD)是一类具有相似的影像学、病理学和临床表现特点的肺脏薄壁组织炎症性疾病。结缔组织病(connective tissue disease,CTD)作为一类病因明确的疾病,包括硬皮病(systemic sclerosis,SSc)、皮肌炎/多发性肌炎(dermatomysitis/polymysitis,DM/PM)、类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、原发性干燥综合征(primary Sjögren syndrome,pSS)、混合性结缔组织病(mixed connective tissue disease,MCTD)和未分化的结缔组织病(undifferentiated connective tissue disease,UCTD)等,其合并ILD的发生率分别为SSc 55%~65%,DM/PM 5%~30%,RA 10%~12%,SLE 3%,pSS 0.1%~3%[1]。研究认为,结缔组织病相关间质性肺病(connective tissue disease-associated interstitial lung disease,CTD-ILD)的发生、发展由炎症启动,造成肺泡上皮受损,激活原位肺成纤维细胞及肌成纤维细胞,通过转化生长因子β(transforming growth facfor-β,TGF-β)依赖的经典通路调节受损肺组织的纤维化相关的微环境;此外还发现,自身抗体与CTD-ILD具有相关性,但是具体机制尚不明确[2]。2013年美国胸科学会-欧洲呼吸学会(American Thoracis-European Respiratory Society,ATS-ERS)对特发性间质性肺炎的分类进行了重新修订,这次新分类把特发性间质性肺炎分为主要的、罕见的和不可分类三大类,而所有肺间质病变的病理类型在CTD-ILD中都可找到,并且在同一例患者身上可同时出现多种病理类型,目前主要分为寻常型间质性肺炎(usual interstitial pneumonia,UIP)、非特异性间质性肺炎(fibrotic non-specific interstitial pneumonia,NSIP)及其他类型如淋巴细胞性间质性肺炎(lymphoid interstitial pneumonia,LIP)、隐源性机化性肺炎(cryptogenic organizing pneumonia,COP)等[3]。目前临床上诊断CTD-ILD主要依靠高分辨率CT(high-resolution computed tomography,HRCT)、肺活检和肺功能检测。HRCT和肺活检病理在UIP的诊断上特异度高达96%,由于HRCT高度敏感,一些亚临床的征象被过度解读,且其具有放射性,费用较高,患者接受度不佳[2]。目前获取肺组织的方法包括开胸肺活检、胸腔镜下肺活检及CT引导下经皮肺穿刺活检三种,开胸肺活检创伤大且患者不易接受,现临床已很少开展;胸腔镜下肺活检极少引起开胸肺活检常见的并发症,同时取材满意,但患者对有创检查的接受度及配合度低;而CT引导下经皮肺活检,简单易行且损伤小,并可提前确定和调整进针角度及深度,具有更高的安全性,但缺点是无法做到多点取材。肺功能检查安全易行,且弥散功能下降是诊断CTD-ILD公认的依据之一,但肺功能检查的重复性较差,在不同实验室进行的肺功能检查,一氧化碳弥散量(carbon monoxide diffusing capacity,DLCO)变异很大,这种差异受具体机器型号及患者的配合程度等影响[2]。肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的细胞计数由于变化大、特异性小,其诊断和预后价值仍具有争议[4]。因此寻找简便、易行、可靠的早期诊断方法成为一种趋势。
肺泡上皮蛋白
表面活性蛋白A和表面活性蛋白D
表面活性蛋白A(surfactant protein A,SP-A)和SP-D是由Ⅱ型肺泡上皮细胞合成和分泌的一种脂蛋白,不仅能够降低肺泡表面张力,而且在肺的宿主防御反应中起重要作用。在SSc-ILD患者中,SP-D检测ILD的敏感度高于SP-A,特异度低于SP-A[5- 6];SP-D水平与HRCT最大纤维化评分呈正相关,与用力肺活量(forced vital capacity,FVC)、肺活量(vital capacity,VC)、DLCO等指标呈负相关[5]。研究表明,在SSc-ILD、DM/PM-ILD患者中血清SP-A和SP-D升高,提示肺纤维化的活动度及恶化趋势[5,7]。Arai等[7]证实,DM/PM-ILD患者SP-D水平在开始治疗4周内持续升高,提示治疗效果不佳,应当结合其他指标考虑调整治疗方案。
糖蛋白
糖蛋白(Krebs vonden lungen- 6,KL- 6)是由Ⅱ型肺泡细胞和呼吸性细支气管上皮细胞分泌的一种大分子量糖蛋白(200 kDa),在细胞增生或损伤后增加,具有促进纤维母细胞增殖,抑制其凋亡,介导成肌纤维细胞分化的功效,且在不同类型的CTD-ILD疾病中均升高。一项单中心的回顾性纵向研究显示,SSc-ILD患者KL- 6滴度升高的试验组死亡风险增加,环磷酰胺治疗后滴度可降低,故认为KL- 6有望成为肺纤维化严重程度评估的指标,但此研究对ILD的活动度评价价值尚不能确定[8]。亦有研究表明,血清KL- 6升高同SSc-ILD患者的BALF嗜酸粒细胞计数增加及HRCT显示磨玻璃样变的结果相一致,认为KL- 6对ILD的发生和发展有评估作用[9];Oyama等[10]研究发现,血清KL- 6值升高的RA患者大部分被诊断为活动性间质性肺炎,且随着肺间质改变累及范围的增加血清值亦升高,认为KL- 6的异常升高可反映间质性肺炎肺细胞损伤及肺部受累的程度。另外DM/PM-ILD患者血清KL- 6水平与其肺功能参数呈负相关,且对诊断ILD的敏感度及特异度均较高[11]。
自身抗体
目前已经认识到自身抗体参与CTD的病理生理过程和组织损伤,其中不同类型的抗体提示不同CTD-ILD的发生、发展及预后情况。现有研究发现,与DM/PM-ILD相关的自身抗体有:抗临床无肌病性皮肌炎-140(clinically amyopathic DM-140,CADM-140)、抗氨酰tRNA合成酶(aminoacyl-tRNA synthetases antibodies,ARS)、抗Mi-2、抗p155/140(TIF1γ)抗体;与SSc-ILD相关的自身抗体有:抗U11/U12 RNP、抗Scl-70、抗ACA/CENP(A-E)、抗histone抗体;与RA-ILD相关的自身抗体有:抗环瓜氨酸肽(cysic citrullinated peptides,CCP)、抗PAD3/4XR抗体[12](表1)。其中相关性较高、预测能力较强的抗体为抗ARS、抗CADM-140、抗CCP抗体。

表1 自身抗体与CTD-ILD的关系Table 1 Relationship of autoantibody and CTD-ILD
++表示严重ILD;+表示与ILD相关;SSc:硬皮病;RA:类风湿关节炎;PM/DM:多发性肌炎/皮肌炎;MCTD:混合性结缔组织炎;pSS:原发性干燥综合征;SLE:系统性红斑狼疮;UCTD:未分化的结缔组织病;CTD-ILD:结缔组织病-间质性肺病
抗ARS抗体
抗ARS抗体属于肌炎特异性抗体(myositis-specific autoantibodies,MSAs),目前已经确认和报道的有八种类型:抗Jo-1、抗PL-7、抗EJ、抗PL-12、抗KS、抗OJ、抗ZO和抗Ha抗体[13]。其中抗Jo-1抗体对肌炎相关的ILD预测能力最强[13];而抗PL-7、抗EJ抗体阳性与有肺脏受累的肌炎患者更相关[14];抗PL-12、抗KS和抗OJ抗体在人群中阳性率低,但抗体检测阳性高度提示孤立性的ILD[15]。有研究发现,抗ARS抗体阳性患者的预后及免疫抑制剂对其治疗效果好[16]。而抗Jo-1抗体阴性组患者的生存率比抗Jo-1抗体阳性组低,作者将其归因于对抗Jo-1抗体阴性组ILD诊断的滞后[17]。
抗CADM-140黑色素瘤分化相关基因5抗体
抗CADM-140抗体以黑色素瘤分化相关基因5 anti-citrullinated protein/peptide autoantibodies,(melanoma differentiation-associated gene 5,MDA5)为靶抗原,多见于东亚地区人群。在DM患者中,抗CADM-140抗体是急性进展性ILD(rapidly progressive interstitial lung disease,RPILD)的独立危险因素,抗体滴度高可提示疾病活动及严重程度,治疗后抗体滴度水平下降可表明疾病缓解[18]。
抗CCP抗体
抗瓜氨酸化蛋白/肽抗体(ACPAs)是机体针对瓜氨酸化的蛋白、肽链产生的抗体。RA-ILD患者中,抗CCP抗体滴度越高的患者其CT评分越高,且这些患者常伴有肺功能障碍和弥散功能受损[12]。英国一项多中心研究纳入230例RA-ILD患者,研究发现抗CCP抗体与是否合并ILD具有强相关性(OR=4)[19]。
Harlow等[20]从RA患者的瓜氨酸化抗CCP抗体的蛋白提取物中分离出抗瓜氨酸化的热休克蛋白90的同型抗体(anti-citrullinated Hsp90 α/β antibodies),认为该抗体在肺脏产生和成熟,可将其作为区分ILD阳性组与ILD阴性组的自身抗体标志物,其诊断RA-ILD的敏感度和特异度分别为54%和75%。
基质金属蛋白酶及基质金属蛋白酶组织抑制因子
基质金属蛋白酶(matrixmetalloproteinases,MMPs)是一类锌依赖的蛋白酶,具有降解细胞外基质和裂解胶原分子的功能,基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinasas,TIMPs)是MMPs抑制剂,在炎症反应时炎性细胞和巨噬细胞MMPs和TIMPs表达增加,加剧炎症反应和促进纤维化进程,引起肺组织损伤和重构,导致肺功能下降[21]。在SSc-ILD患者中,血清MMP-12水平的上升与FVC的下降更为相关,而BALF中MMP-9浓度上升与中性粒细胞、肥大细胞计数升高保持一致,与肺总量(total lung capacity,TLC)下降也呈明显正相关性[22]。RA-ILD患者MMP-7的血清浓度上升时,患者肺部临床表现加重,DLCO和FVC也下降显著[21]。Oka等[23]研究发现CTD-ILD死亡组中,处于急性起病期的患者血清MMP-3/TIMP-1比值相较于稳定期患者明显下降,而在生存组中不同疾病时期的比值无差异,所以认为该比值可反映CTD-ILD患者急性起病的预后。
去整合素样金属蛋白酶12(A disintegrin and metalloproteinase domain 12,ADAM12)又称融合素α,是一类细胞膜表面具备多功能的糖蛋白家族成员之一,具有金属蛋白酶的特性,在细胞分化、黏附、融合和相互作用过程中发挥重要作用。Taniguchi等[24]对61例SSc患者血清ADAM12-S进行检测,发现病程≤6年的SSc患者血清ADAM12-S水平相对于健康组有明显升高,且与HRCT评分、FVC、C-反应蛋白(C-reactive protein,CRP)水平有显著相关性,但病程>6年的SSc患者ADAM12-S水平同健康组并无明显差异,所以认为ADAM12-S的血清值能一定程度反映ILD疾病的炎症活动情况。
趋化因子CCL家族和CXCL家族
CCL和CXCL家族的趋化因子对单核细胞、T淋巴细胞等有较强的趋化作用,参与CTD患者受损肺组织的修复和重构过程,其血清和BALF的水平变化能反映ILD疾病的活动及预后情况。
趋化因子CCL家族
CCL2又称为单核细胞趋化因子(monocyte chemotactic protein 1,MCP1),SSc-ILD疾病终末期的CCL2浓度升高相对于稳定期和进展期有统计学意义,同时伴有HRCT评分升高,DLCO、FVC、TLC下降,对临床上评估ILD严重程度有一定的提示作用[25]。CCL18又称肺活化调节的趋化因子(pulmonary and activation regulated chemokine,PARC),一项回顾性队列研究发现,血清CCL18水平>187 ng/ml时能独立预测SSc-ILD的病情恶化,敏感度和特异度分别为53%和96%,随后对该组患者平均随访(33.4±10.8)个月,患者肺功能恶化风险增加,校正风险比为5.36[26]。
趋化因子CXCL家族
CXCL10又称为干扰素γ诱导蛋白10(interferon gamma-induced protein 10,IP10),由Th1淋巴细胞分泌,Antonelli等[27]将72例新诊断的SSc患者与健康者进行性别和年龄的配对后,检测发现SSc新确诊患者血清CXCL10水平相对健康组有明显上升,其中SSc-ILD的患者CXCL10水平显著高于未合并ILD的患者,研究人员认为CXCL10高水平有助于临床判断SSc合并肺受累,随后对SSc患者随访5年,复测CXCL10水平反而明显下降,考虑疾病由早期炎症主导阶段(Th1为主)向后期非炎症和纤维化阶段(Th2为主)转换。CXCL12又称为基质细胞衍生因子-1(stromal cell derived factor 1,SDF-1),SSc-ILD患者肺组织CXCL12及其受体CXCR4表达上调,通过CXCL12/CXCR4生物轴能促进纤维细胞向肌成纤维细胞转化和细胞外基质沉积,加速肺纤维化发病进程[28]。
CXCL4即血小板因子4(platelet factor 4),抑制具有抗纤维化功能的细胞因子INF-γ表达,上调白细胞介素(interleukin,IL)- 4、IL-13,刺激抑制功能受损的调节性T细胞增殖,van Bon等[29]研究发现,CXCL4不仅与SSc患者皮肤和肺部疾病强相关,还能预测不同类型SSc的疾病进展,提出检测CXCL4对SSc-ILD早期诊断、纤维化评估和采取何种临床治疗方案均有较好的指导作用。
其 他
IL是由单核巨噬细胞和T淋巴细胞分泌的具有某些非特异性免疫调节作用且在炎症反应中起关键作用的细胞因子,对细胞的生长、分化起重要调节作用。SSc-ILD患者血清IL-21水平升高,IL-17、IL-23水平明显降低,且IL-17水平与疾病病程长短呈负相关,与HRCT评分呈正相关,IL-23浓度与DLCO、TLC、6分钟步行试验呈负相关,认为这些Th17相关的细胞因子参与SSc-ILD的发生[30]。DM/PM-ILD患者IL- 6、IL- 8水平明显升高,其中IL- 8水平在抗MDA5抗体相关的ILD组显著高于抗ARS抗体相关的ILD组,而IL- 4/IFN-γ比值结果相反,故认为IL- 4、IFN-γ之间的平衡和IL- 8参与不同抗体相关的ILD组的病理生理过程[31]。
赖氨酰氧化酶(lysyl-oxidase,LOX)是铜离子依赖的胺氧化酶,能够在细胞外基质氧化胶原蛋白和弹性蛋白上的特殊氨基酸残基,目前有望成为预测SSc相关纤维化和疾病严重程度的新兴生物标志物。已有研究报道SSc患者血清LOX水平升高与皮肤纤维化明确相关,Rimar等[32]研究发现,大部分血清LOX水平升高的患者合并有肺纤维化,且同时伴有FVC下降,但仍需后续研究证实LOX与肺纤维化的关系。
小窝蛋白-1(caveolin-1)是支架蛋白,介导单核细胞及其来源的细胞的功能和信号转导。SSc-ILD患者,单核细胞中caveolin-1水平下降,单核细胞表型及迁移活性改变,分化为纤维细胞聚集于肺脏促进ILD的发生[28]。此外,非裔美国人单核细胞中caveolin-1基线水平低,使得SSc患者更易合并ILD[33]。
几丁质酶1(chitinase 1)为真性甲壳素酶,甲壳质酶3类似物1(YKL- 40)属于甲壳素酶样蛋白。Nordenbk等[34]研究发现,SSc-ILD组患者血清YKL- 40水平较非ILD组明显升高,平均生存时间缩短。
S100A8/A9又名钙结合蛋白(calprotectin),是Toll样受体4(TLR4)的内源性配体,而TLR4信号通路能促进纤维母细胞增殖和肺纤维化的发生[35]。而在SSc-ILD患者中,发现血清和BALF中S100A8/A9浓度明显升高[9,35]。
另外,有研究发现生长分化因子15(GDP-15)、Clara细胞蛋白16(Clara-cell protein 16,CC16)、固生蛋白(tenascin-C)、软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)、胸腺素(thymosin β4)、可溶性选择素糖蛋白配体(soluble p-selection glycoprotein ligand-1,sPSGL-1)等与CTD-ILD发病机制可能相关,是否可成为生物标志物还有待进一步研究。
目前,KL- 6、SP-D等作为ILD的生物标志物,因其较高的敏感度和特异度已被广泛证实且逐步应用于临床,对并发ILD发生率较高的SSc和DM/PM具有较好的指导意义,但大多数生物标志物尚处于实验室研究认证阶段,且缺乏疾病特异性(表2)。生物标志物在CTD-ILD的诊断、严重度的评估、疾病进展的预测、治疗效果的评估等方面的作用尚需多中心、大样本的研究及长期的随访去验证。近年精准医学被重视,基因组学、蛋白质组学等多种技术平台逐渐应用于生物标志物的研究,这也给发现有价值的生物标志物带来了契机。
[1]Bryson T,Sundaram B,Khanna D,et al.Connective Tissue Disease-Associated Interstitial Pneumonia and Idiopathic Interstitial Pneumonia:Similarity and Difference[J].Semin Ultrasound CT MR,2014,35:29-38.
[2]Wells AU,Denton CP.Interstitial lung disease in connective tissue disease—mechanisms and management[J].Nat Rev Rheumatol,2014,10:728-739.
[3]Travis WD,Costabel U,Hansell DM,et al.An official American Thoracic SocietyEuropean Respiratory Society statement:Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias[J].Am J Respir Crit Care Med,2013,188:733-748.
[4]Bonella F,Costabel U.Biomarkers in Connective Tissue Disease-Associated Interstitial Lung Disease[J].Semin Respir Crit Care Med,2014,35:181-200.
[5]Elhaj M,Charles J,Pedroza C,et al.Can Serum Surfactant Protein D or CC-Chemokine Ligand 18 Predict Outcome of Interstitial Lung Disease in Patients with Early Systemic Sclerosis?[J].J Rheumatol,2013,40:1114-1120.
[6]Takahashi H,Kuroki Y,Tanaka H,et al.Serum levels of surfactant proteins A and D are useful biomarkers for interstitial lung disease in patients with progressive systemic sclerosis[J].Am J Respir Crit Care Med,2000,162:258-263.
[7]Arai S,Kurasawa K,Maezawa R,et al.Marked increase in serum KL- 6 and surfactant protein D levels during the first 4 weeks after treatment predicts poor prognosis in patients with active interstitial pneumonia associated with polymyositisdermatomyositis[J].Mod Rheumatol,2013,23:872- 883.
[8]Kumanovics G,Gorbe E,Minier T,et al.Follow-up of serum KL- 6 lung fibrosis biomarker levels in 173 patients with systemic sclerosis[J].Clin Exp Rheumatol,2014,32:138-144.
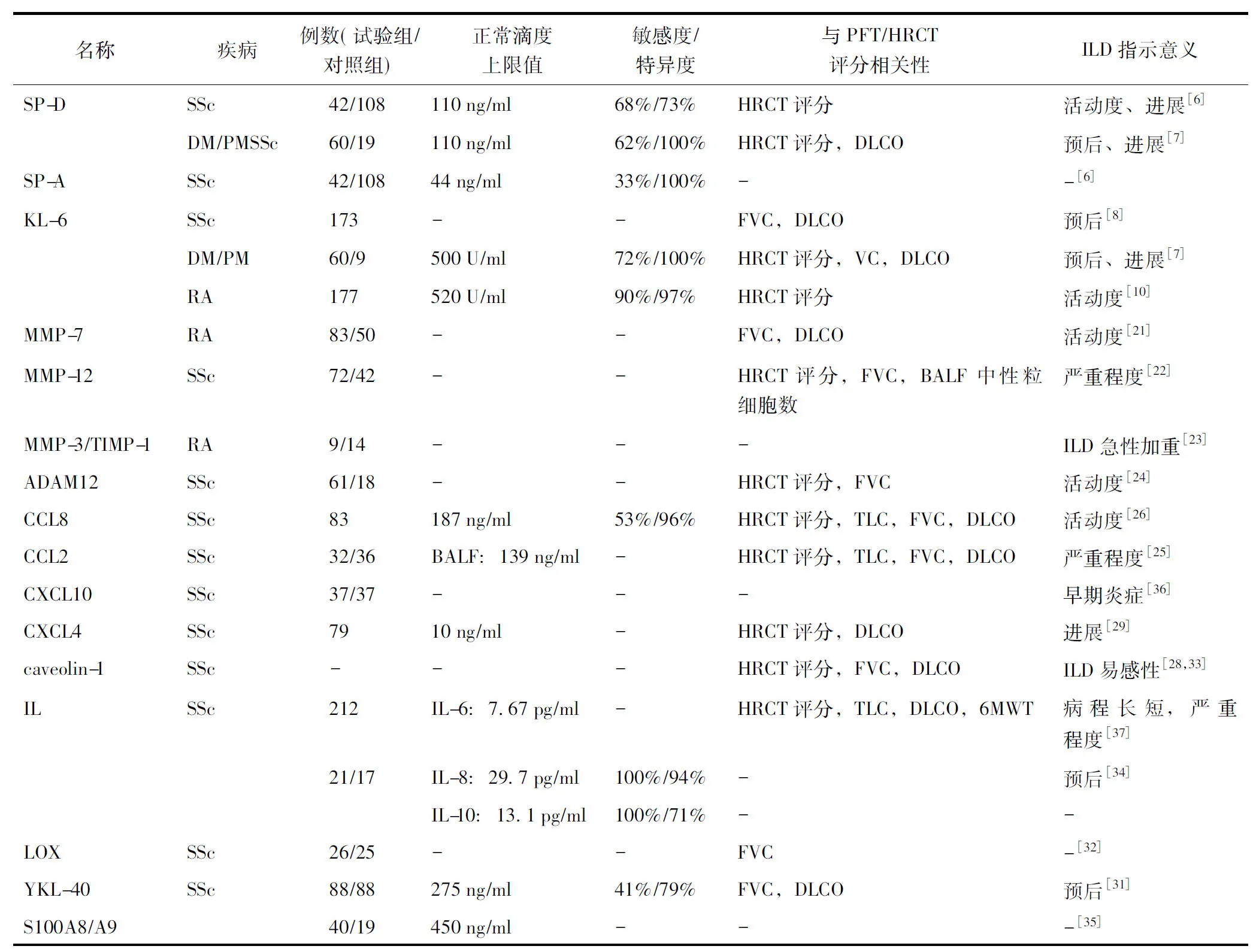
表2 CTD-ILD相关的主要生物标志物Table 2 Key biomarkers related to CTD-ILD
DLCO:一氧化碳弥散量;FVC:用力肺活量;PFT:肺功能检测;TLC:肺总量;6MWT:6分钟步行试验;CTD-ILD:结缔组织病-间质性肺病;SSc:硬皮病;DM:多发性肌炎;RA:类风湿关节炎;MCTD:混合性结缔组织炎;BALF:支气管肺泡灌洗液
[9]Hesselstrand R,Wildt M,Bozovic G,et al.Biomarkers from bronchoalveolar lavage fluid in systemic sclerosis patients with interstitial lung disease relate to severity of lung fibrosis[J].Respir Med,2013,107:1079-1086.[10] Oyama T,Kohno N,Yokoyama A,et al.Detection of interstitial pneumonitis in patients with rheumatoid arthritis by measuring circulating levels of KL- 6,a human MUC1 mucin[J].Lung,1997,175:379-385.
[11] Fathi M,Barbasso Helmers S,Lundberg IE.KL- 6:a serological biomarker for interstitial lung disease in patients with polymyositis and dermatomyositis[J].J Intern Med,2012,271:589-597.
[12] Giles JT,Danoff SK,Sokolove J,et al.Association of fine specificity and repertoire expansion of anticitrullinated peptide antibodies with rheumatoid arthritis associated interstitial lung disease[J].Ann Rheum Dis,2014,73:1487-1494.
[13] Cruellas M,Viana V,Levy-Neto M,et al.Myositis-specific and myositis-associated autoantibody profiles and their clinical associations in a large series of patients with polymyositis and dermatomyositis[J].Clinics (Sao Paulo),2013,68:909-914.
[14] de Souza F,Cruellas M,Levy-Neto M,et al.Anti-synthetase syndrome:anti-PL-7,anti-PL-12 and anti-EJ[J].Rev Bras Reumatol,2013,53:352-357.
[15] Hamaguchi Y,Fujimoto M,Matsushita T,et al.Common and distinct clinical features in adult patients with anti-aminoacyl-tRNA synthetase antibodies:heterogeneity within the syndrome[J].PLoS One,2013,8:e60442.
[16] Schneider F,Yousem SA,Bi D,et al.Pulmonary pathologic manifestations of anti-glycyl-tRNA synthetase (anti-EJ)-related inflammatory myopathy[J].J Clin Pathol,2014,67:678- 683.
[17] Aggarwal R,Cassidy E,Fertig N,et al.Patients with non-Jo-1 anti-tRNA-synthetase autoantibodies have worse survival than Jo-1 positive patients[J].Ann Rheum Dis,2013,73:227-232.
[18] Sato S,Kuwana M,Fujita T,et al.Anti-CADM-140MDA5 autoantibody titer correlates with disease activity and predicts disease outcome in patients with dermatomyositis and rapidly progressive interstitial lung disease[J].Mod Rheumatol,2013,23:496-502.
[19] Kelly CA,Saravanan V,Nisar M,et al.Rheumatoid arthritis-related interstitial lung disease:associations,prognostic factors and physiological and radiological characteristics-a large multicentre UK study[J].Rheumatology (Oxford),2014,53:1676-1682.
[20] Harlow L,Gochuico BR,Rosas IO,et al.Anti-citrullinated heat shock protein 90 antibodies identified in bronchoalveolar lavage fluid are a marker of lung-specific immune responses[J].Clin Immunol,2014,155:60-70.
[21] Chen J,Ascherman DP.Peripheral blood biomarkers of rheumatoid arthritis-associated interstitial lung disease[J].Arthritis Rheumatol,2013,6510:S174.
[22] Manetti M,Guiducci S,Romano E,et al.Increased serum levels and tissue expression of matrix metalloproteinase-12 in patients with systemic sclerosis:correlation with severity of skin and pulmonary fibrosis and vascular damage[J].Ann Rheum Dis,2012,71:1064-1072.
[23] Oka S,Furukawa H,Shimada K,et al.Serum biomarker analysis of collagen disease patients with acute-onset diffuse interstitial lung disease[J].BMC Immunol,2013,14:9.
[24] Taniguchi T,Asano Y,Akamata K,et al.Serum levels of ADAM12-S:possible association with the initiation and progression of dermal fibrosis and interstitial lung disease in patients with systemic sclerosis[J].J Eur Acad Dermatol Venereol,2013,27:747-753.
[25] Schmidt K,Martinez-Gamboa L,Meier S,et al.Bronchoalveoloar lavage fluid cytokines and chemokines as markers and predictors for the outcome of interstitial lung disease in systemic sclerosis patients[J].Arthritis Res Ther,2009,11:R111.
[26] Tiev KP,Hua-Huy T,Kettaneh A,et al.Serum CC chemokine ligand-18 predicts lung disease worsening in systemic sclerosis[J].Eur Respir J,2011,38:1355-1360.
[27] Antonelli A,Ferri C,Fallahi P,et al.CXCL10 (α) and CCL2 (β) chemokines in systemic sclerosis a longitudinal study[J].Rheumatology (Oxford),2008,47:45- 49.
[28] Tourkina E,Bonner M,Oates J,et al.Altered monocyte and fibrocyte phenotype and function in scleroderma interstitial lung disease:reversal by caveolin-1 scaffolding domain peptide[J].Fibrogenesis Tissue Repair,2011,4:15.
[29] van Bon L,Affandi AJ,Broen J,et al.Proteome-wide Analysis and CXCL4 as a biomarker in systemic sclerosis[J].N Engl J Med,2014,370:433- 443.
[30] Olewicz-Gawlik A,Danczak-Pazdrowska A,Kuznar-Kaminska B,et al.Interleukin-17 and interleukin-23:importance in the pathogenesis of lung impairment in patients with systemic sclerosis[J].Int J Rheum Dis,2014,17:664- 670.
[31] Gono T,Kaneko H,Kawaguchi Y,et al.Cytokine profiles in polymyositis and dermatomyositis complicated by rapidly progressive or chronic interstitial lung disease[J].Rheumatology (Oxford),2014,53:2196-2203.
[32] Rimar D,Rosner I,Nov Y,et al.Brief report:lysyl oxidase is a potential biomarker of fibrosis in systemic sclerosis[J].Arthritis Rheumatol,2014,66:726-730.
[33] Reese C,Perry B,Heywood J,et al.Caveolin-1 Deficiency May Predispose African Americans to Systemic Sclerosis-Related Interstitial Lung Disease[J].Arthritis Rheumatol,2014,66:1909-1919.
[35] van Bon L,Cossu M,Loof A,et al.Proteomic analysis of plasma identifies the Toll-like receptor agonists S100A8A9 as a novel possible marker for systemic sclerosis phenotype[J].Ann Rheum Dis,2014,73:1585-1589.
[36] Antonelli A,Fallahi P,Ferrari SM,et al.Systemic sclerosis fibroblasts show specific alterations of interferon-gamma and tumor necrosis factor-alpha-induced modulation of interleukin 6 and chemokine ligand 2[J].J Rheumatol,2012,39:979-985.
[37] De Lauretis A,Sestini P,Pantelidis P,et al.Serum interleukin 6 is predictive of early functional decline and mortality in interstitial lung disease associated with systemic sclerosis[J].J Rheumatol,2013,40:435- 446.
