别嘌呤醇引起发疹型药疹8例及相关基因HLA-B*5801检测
2016-04-08王宝玺
罗 阳,韩 悦,王宝玺,姚 煦,刘 军
(南京大学医学院附属鼓楼医院皮肤性病科,南京 210008)
别嘌呤醇是一种常用的治疗高尿酸血症、痛风、急性尿酸性肾病的药物。随着该药在临床上的应用,其引发药物过敏的临床报道多见。据文献报道,此药是一些严重皮肤不良反应(severe cutaneous adverse drug reactions,SCARs),如药物超敏反应综合征(hypersensitivity syndrome,HSS)、Stevens-Johnson综合征(Stevens-Johnson syndrome,SJS)和中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)的常见致敏药物[1]。近年来药物遗传学研究发现,一些药物严重不良反应与HLA-B特定的基因型密切相关,如别嘌呤醇引起的SJS和TEN被证实与HLA-B*5801有着明显的相关性[2]。在台湾汉族人群中,别嘌呤醇引起的SJS/TEN患者携带HLA-B*5801基因型为100%,远高于国际组织相容性工作组(International Histocompatibility Working Group,IHWG)在2010年报道的世界不同人种HLA-B*5801的平均携带率,其中非洲人2%~4%,白种人1%~6%,亚洲印度人3%~15%,华人8.8%~10.9%。相似的结果在我国、韩国和泰国等国家也陆续被证实[3]。但是,目前尚不明确别嘌呤醇引起的发疹型药疹与此基因型的相关性。为此,对8例别嘌呤醇引起的发疹型药疹患者进行HLA-B*5801基因型的检测。
资料与方法
一般资料
本研究经过本院伦理委员会的批准。所有入组者均签署知情同意书。共筛选别嘌呤醇引起的发疹型药疹患者8例(A组),其中男5例,女3例,临床症状见图1,排除其他药物致敏的可能和排除与药疹相似的其他疾病的皮疹。同时还筛选了30例服用别嘌呤醇未发生药疹的痛风患者(B组)和120名健康体检者(C组)。所有入组者均为汉族。
研究方法
DNA提取:采集EDTA抗凝的新鲜抗凝血,用TIANamp Blood DNA Kit提取试剂盒提取全血DNA,测DNA纯度和浓度,-20 ℃保存。
仪器与试剂:HLA-B*5801检测试剂盒(台湾Pharmigene,Inc.,PG-5801C- 024);qPCR仪7300(美国Applied Biosystem);凝胶电泳图像分析系统(美国BIO-RAD GelDocTM XR+System)。
PCR反应:PCR反应体系分两种:内参体系25 μl:阳性对照模板2 μl,2×PCR Master Mix 12.5 μl,10×内参检测mix 2.5 μl,除酶H2O 8 μl;样本基因型检测体系25 μl:DNA 2 μl,2×PCR Master Mix 12.5 μl,10×内参检测mix 2.5 μl,除酶H2O 8 μl。PCR反应程序:95 ℃预变性10 min,95 ℃变性15 s,71 ℃退火/延伸1 min,共35个循环。
PCR扩增产物电泳检测:配制2%的琼脂糖凝胶,取PCR扩增产物7 μl进行电泳,采用凝胶电泳图像分析系统分析结果。
结果分析:每个样本有两个Ct值,一个是基因型,一个是内参。Ct的差值计算:△Ct=Ct(基因型)-Ct(内参)。根据以下情况判定结果是否为阳性,如果Ct(内参)≤27,Ct(基因型)≤35,△Ct≤7,则HLA-B*5801阳性,△Ct>7则HLA-B*5801阴性;Ct(内参)≤27,Ct(基因型)>35(undetermined),则HLA-B*5801阴性;如果CT(内参)>27,可能存在PCR抑制剂,需重新检测。
统计学分析
采用SPSS 20.0软件进行统计学处理。基因频率用相对数表示。因为有一组期望频数小于1,故比较差异采用Fisher精确概率法,按α=0.05的水准进行假设检验,以P<0.05为差异有统计学意义。相关性分析采用比值比(odds ratio,OR)值卡方检验,计算组间的OR值及其95%CI、P值,根据总体OR值与1之间的差别来判定别嘌呤醇引起的发疹型药疹与HLA-B*5801等位基因的相关性是否有统计学意义。
结 果
所有病例内参全部扩增成功。各组标本的HLA-B*5801检出结果见表1。根据HLA-B*5801检测试剂盒的判定方法进行结果判读。
别嘌呤醇引起发疹型药疹患者HLA-B*5801等位基因阳性率与对照组差异比较
在别嘌呤醇引起发疹型药疹的8例患者(A组)中,有3例患者HLA-B*5801阳性(表2)。对3例HLA-B*5801检测阳性患者PCR扩增产物进行琼脂糖凝胶电泳分析,内参扩增及样本扩增全部成功,PCR产物大小正确(图2)。进一步证实3例患者HLA-B*5801阳性。30例服用别嘌呤醇未发生药疹的痛风患者(B组)中,有2例患者HLA-B*5801阳性。120名健康体检者中,有13名体检者HLA-B*5801阳性。采用卡方检验,χ2=4.931,P>0.05。
别嘌呤醇引起发疹型药疹患者与HLA-B*5801的基因携带相关性比较
药疹组与非药疹组HLA-B*5801基因型阳性率的比值OR=8.400,95%CI1.107~63.735,P<0.05;药疹组与健康体验组的HLA-B*5801基因型阳性率OR=4.938,95%CI1.056~23.100,P<0.05。可以认为该型药疹与HLA-B*5801的基因型携带具有相关性。
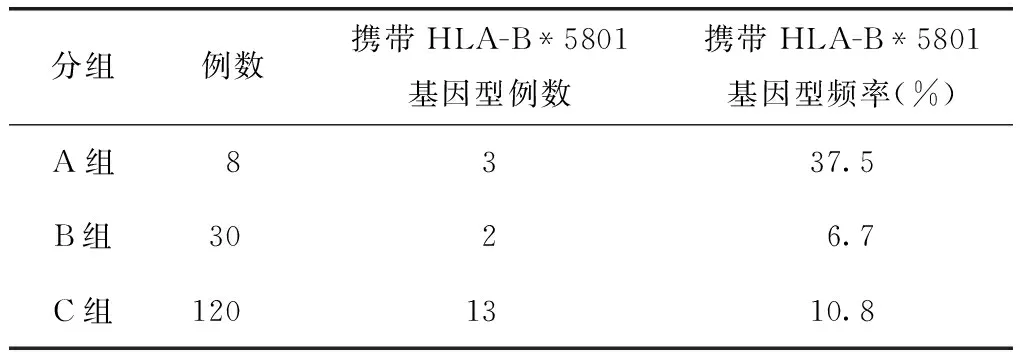
表1 各组标本HLA-B*5801基因检出情况
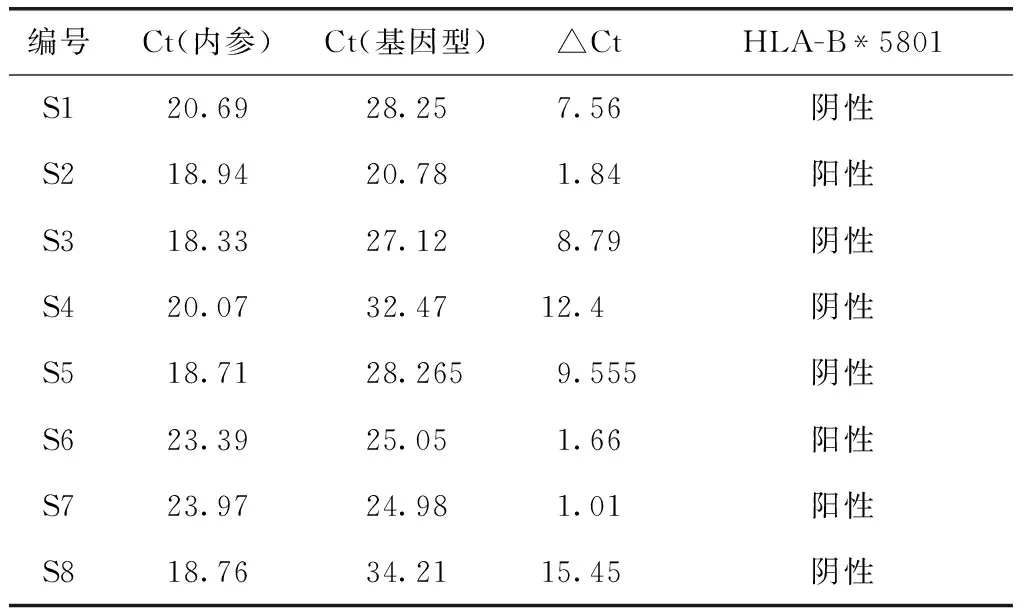
表2 别嘌呤醇引起发疹型药疹患者PCR检测结果
讨 论
药物过敏是临床常见问题,皮肤是主要受累器官。药疹的临床表现类型多种多样,轻症者以红斑、丘疹为主,重症者可以出现表皮松解和大疱。SJS和TEN属于重症药疹,虽然发生率不高,但症状严重,死亡率高[4]。别嘌呤醇是治疗痛风的常用药物,该药物引起的药疹发生率大约为2%~5%[5- 6]。别嘌呤醇药疹可分为重症药疹与非重症药疹两类。其中非重症药疹包括:红斑发疹型、多形红斑型及紫癜型;重症药疹包括:重症多形红斑型、剥脱性皮炎型及TEN。其中发疹型药疹占35%左右[7]。鉴于HLA分子在免疫反应中扮演着重要的角色,参与将药物抗原呈递给T细胞表面受体从而引发免疫反应,故HLA等位基因型别与药物过敏的相关性成为药物不良反应研究领域的热点。1989年,Chan等[8]首次报道了HLA与别嘌呤醇引起不良反应相关性的研究。2005年Hung等[3]首次在台湾汉族人群中发现别嘌呤醇引起的SJS/TEN与HLA-B*5801之间具有强相关性。随后在韩国、泰国及日本患者中也证实了SJS/TEN与HLA-B*5801之间存在关联性,但是关联性要比Hung等[3]的研究弱得多[9-11]。
轻症药疹虽然临床危害较小,但是反复多次发病后可向重型发展。很多重型药疹发病初期仅表现为轻症皮损,所以明确别嘌呤醇过敏的发疹型患者的HLA-B*5801基因型携带率,可能有助于判断疾病预后和发生重症药疹的风险。虽然大量研究表明HLA-B*5801与重症药疹的强相关性,但是与轻症药疹的关联还有待更多的临床研究证据,并且不同种族间的关联性也不相同,有必要进行我国人群此基因型与别嘌呤醇引发的轻症药疹间的相关性研究。本研究初步分析了HLA-B*5801基因型在别嘌呤醇引发的发疹型药疹患者中的分布频率,研究纳入8例别嘌呤醇引起的发疹型药疹患者,并以别嘌呤醇耐受的痛风患者和健康体检者为对照。显示8例患者中3例患者HLA-B*5801检测阳性,阳性率为37.5%,与之前部分报道[12]相符。而对照组该基因型的分布频率分别为6.7%和10.8%,虽然各组间比较差异没有统计学意义(P>0.05),但别嘌呤醇所致的发疹型药疹与HLA-B*5801的基因型携带率具有相关性(OR=8.400,95%CI:1.107~63.735,P<0.05),提示携带此基因型的别嘌呤醇所致的发疹型患者发展为重症药疹的风险可能高于非携带者。值得一提的是,本研究纳入的3例HLA-B*5801检测阳性发疹型药疹患者中,1例患者由于不能停药,在发疹型药疹反复发作2年后,出现了SJS型药疹。本研究纳入的样本数量偏少,还有待于扩大样本量进行验证。
(本文图1、2见插页Ⅰ)
[1]Ramasamy SN,Korb-Wells CS,Kannangara DR,et al.Allopurinol hypersensitivity:a systematic review of all published cases,1950—2012[J].Drug Safety,2013,36:953-980.
[2]Mungall AJ,Palmer SA,Sims SK,et al.The DNA sequence and analysis of human chromosome 6[J].Nature,2003,425:805- 811.
[3]Hung SI,Chung WH,Liou LB,et al.HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol[J].Proc Natl Acad Sci U S A,2005,102:4134- 4139.
[4]Roujeau JC.Immune mechanisms in drug allergy[J].Allergol Int,2006,55:27-33.
[5]谢建翔.别嘌呤醇严重不良反应19例分析[J].药学与临床研究,2013,21:94-95.
[6]Mcinnes GT,Lawson DH,Jick H.Acute adverse reactions attributed to allopurinol in hospitalised patients[J].Ann Rheum Dis,1981,40:245-249.
[7]陶斯静,吴剑波,张松松,等.314例别嘌呤醇药疹的临床分析[J].中国医药指南,2013,8:85- 86.
[8]Chan SH,Tan T.HLA and allopurinol drug eruption[J].Dermatologica,1989,179:32-33.
[9]Kang HR,Jee YK,Kim YS,et al.Positive and negative associations of HLA class Ⅰ alleles with allopurinol-induced SCARs in Koreans[J].Pharmacogenet Genomics,2011,21:303-307.
[10] Tassaneeyakul W,Jantararoungtong T,Chen P,et al.Strong association between HLA-B*5801 and allopurinol-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in a Thai population[J].Pharmacogenet Genomics,2009,19:704-709.
[11] Ueta M,Tokunaga K,Sotozono C,et al.HLA class Ⅰ and Ⅱ gene polymorphisms in Stevens-Johnson syndrome with ocular complications in Japanese[J].Mol Vis,2008,14:550-555.
[12] 邓智远,杨健,杨文林.中国大陆汉族别嘌呤醇重症药疹病人HLA-B*5801等位基因的检测[J].皮肤性病诊疗学杂志,2013,6:379-382.
