雨生红球藻虾红素的制备及其稳定性研究*
2016-04-07李学敏周庆新薛长湖
李学敏, 周庆新, 徐 杰, 杨 鲁, 杨 澍, 张 婷, 薛长湖
(中国海洋大学食品科学与工程学院, 山东 青岛 266003)
雨生红球藻虾红素的制备及其稳定性研究*
李学敏, 周庆新, 徐杰, 杨鲁, 杨澍, 张婷, 薛长湖**
(中国海洋大学食品科学与工程学院, 山东 青岛 266003)
摘要:以雨生红球藻提取物为原料,利用皂化法和溶剂分配法制备虾红素,并研究其结构及稳定性。通过优化皂化过程中的碱液浓度、反应时间和反应温度,得到最佳的工艺条件:碱液浓度7%,皂化时间120min,温度15℃。此条件下,虾红素的转化率达96.12%,制备的虾红素得率为62.16%,纯度达80.36%。用HPLC-DAD-(APCI)MS/MS分析反应产物,解析虾红素的质谱裂解规律,研究光照条件、金属离子和温度对虾红素稳定性的影响。结果表明:紫外光照处理对虾红素稳定性影响显著;Fe3+、Ca2+、Cu2+对虾红素有不同程度的破坏作用,Zn2+、Mg2+、Na+、Fe2+对虾红素影响较小;pH在3~8范围内,随着pH升高,虾红素稳定性提高;随着温度的升高,虾红素的保留率下降。本研究为虾红素的活性、毒理及其在食品中的应用等研究提供了重要参考。
关键词:雨生红球藻;虾红素;液相色谱-串联质谱;稳定性
虾红素(Astacene,3,3’-dihydroxy-2,3,2’,3’-tetradehydro-β,β’-carotene-β,β-dione)也被称为喇蛄素,分子式为C40H48O4,属于非维生素A源类胡萝卜素的一种[1],广泛存在于自然界中,在虾[2-3]、蟹[4]、鲑鱼[5]等水产动物以及藻类植物、花和水果中都有分布。在实际研究过程中,虾红素通常作为虾青素的脱氢氧化产物存在,两者的结构非常相似(见图1)。研究发现,虾红素结构中长共轭双键链末端环上的羟基和酮基以及由其所构成的α-羟基酮,是其发挥各种生物学功能的主要原因[6]。虾红素较虾青素发现晚,目前在这方面研究报道和应用以虾青素为主,虾红素则鲜为报道。由于虾红素的吸收特性与其他类胡萝卜素类似,对动物和人体安全。在日本,虾红素已被用于食品和动物饲料中,美国FDA、欧盟、加拿大食品监察局已批准虾红素作为水产动物饲料添加剂。国内关于虾红素研究应用起步较晚,现在大多还在生产提取研究阶段,药理试验研究和市场应用较少,研究应用市场前景广阔。另一方面,虾红素具有鲜亮的红色,并且由于其分子极性低的特性,而使其在油相介质中具有良好的溶解性,加之其特有的生物活性,因此,可作为功能性着色剂用于食品和水产行业。
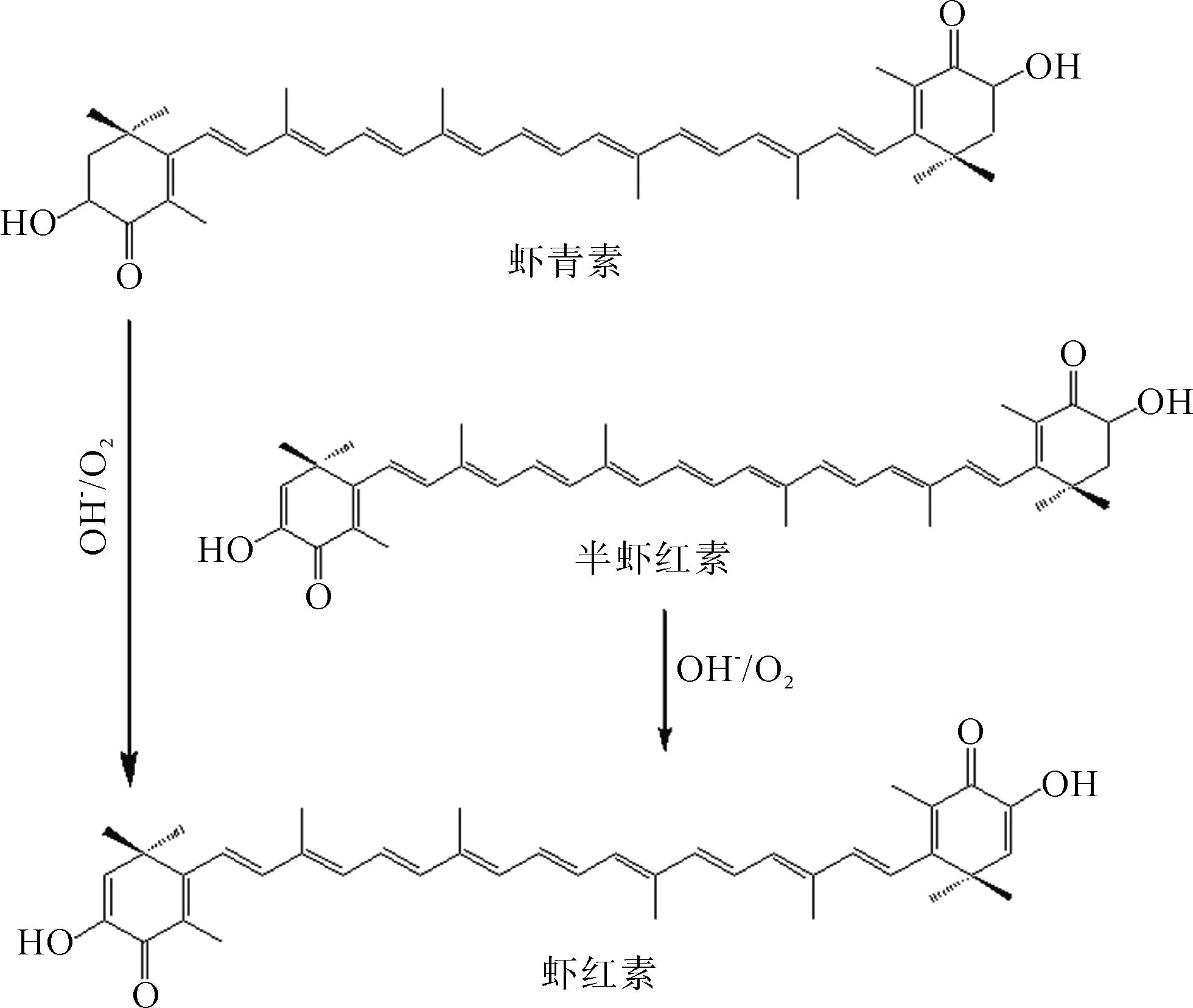
图1 虾红素的转化及化学结构[7]
本文以雨生红球藻为原料,通过皂化和溶剂分配法制备分离虾红素,并对其理化特性进行了较为系统的研究,这对今后研究虾红素生物活性和构效关系以及将虾红素作为功能添加剂用于食品工业具有重要意义。
1实验材料与仪器
1.1 材料与试剂
雨生红球藻提取物,含虾青素酯5%,购自云南爱尔发生物技术有限公司;虾红素标准品(1mg),上海臻准生物科技有限公司;甲醇、甲基叔丁基醚均为色谱纯,德国Merck公司;KOH、乙醇、二甲基亚砜、二氯甲烷均为国产分析纯。
1.2 主要仪器
1100型高效液相色谱仪,配置二极管阵列检测器(DAD)和荧光检测器(FLD),美国Agilent公司;YMC Carotenoid-C30(4.6mm×250mm,S-5μm)液相柱,日本YMC公司;T10 S25涡旋振荡器,德国IKA公司;HH-8数显恒温水浴锅(可震荡),国华电器有限公司;DTU-1C氮吹仪,日本TAITEC公司;ALPHA1-4LD冷冻干燥机,德国CHRIST公司;TDL-5-A飞鸽牌系列离心机,上海安亭科学仪器厂制造;6410 Triple Quard LC/MS,1260型高效液相色谱仪,配置二极管阵列检测器(DAD),美国Agilent公司;UV-2550分光光度计,日本岛津公司;AL204电子天平,梅特勒-托利多仪器(上海)有限公司;Millipore Q超纯水器,美国Millipore 公司;PH3-3C pH计,上海雷磁仪器厂。
2方法
2.1 虾红素的制备
取5g雨生红球藻油,加入1∶10(W∶V)的7%的KOH-乙醇溶液,在一定温度下磁力搅拌进行皂化反应。反应一段时间后,将皂化液于4℃环境中静置过夜,利用冷却结晶的原理使虾红素充分析出,然后经5000r/min离心5min,弃上清,收集沉淀物,沉淀用10%的HCl-乙醇溶液洗涤4~5次,中和皂化液,之后再用50%的乙醇洗涤4~5次以除去皂化过程中产生的脂肪酸盐等极性杂质,最后用蒸馏水将沉淀中的盐等杂质洗去,冻干,即得暗紫色粉末,即为虾红素样品。
2.2 皂化反应条件优化
分别对影响皂化反应程度的碱液浓度、反应时间和反应温度3个因素,进行单因素实验,确定最佳皂化工艺。
2.2.1 碱浓度分别配制浓度为3%、5%、7%、9%、11%的KOH-乙醇溶液。取2g雨生红球藻油,分别加入20mL上述不同浓度的碱液,于15℃下磁力搅拌,反应120min后,取样,HPLC法检测虾红素转化率。
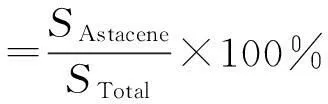
式中:SAstacene为虾红素在液相谱图中峰面积;STotal为液相谱图中总峰面积。
2.2.2 皂化时间取2g雨生红球藻油,加入20mL 7%的KOH-乙醇溶液,15℃下反应,分别于60、80、100、120、140min取样,HPLC法检测虾红素转化率。
2.2.3 温度取2g雨生红球藻油,加入20mL 7%的KOH-乙醇溶液,分别于5、15、25、35和45℃下磁力搅拌反应120min,取样,HPLC法检测虾红素转化率。
2.3 虾红素HPLC分析
样品前处理:取100μL皂化液,加入1mL二氯甲烷进行萃取,用饱和食盐水洗涤至中性后,将二氯甲烷萃取液用N2吹干,用1mL甲醇/甲基叔丁基醚(色谱纯)(1∶1,V/V)复溶,用0.22μm的有机膜过滤后上样检测。
色谱条件[8]:色谱柱为YMC Carotenoid-C30(4.6mm×250mm,S-5μm);流动相A为甲醇,流动相B为甲基叔丁基醚,流动相C为1%磷酸水溶液。洗脱梯度为:0~15min,88%A,10%B,2%C;15~25min,0%A,100%B,0%C;25~35min,88%A,10%B,2%C。洗脱时间30min;流速1mL/min;进样体积20μL;柱温35℃;检测波长480nm。
2.4 虾红素HPLC-(+)APCI-MS/MS分析
将虾红素粉末样品用二氯甲烷溶解后进行液相色谱质谱联用(LC-MS)分析。液相与虾红素标准品进行对照。色谱条件:色谱柱为YMC Carotenoid-C30(4.6mm×250mm,S-5μm);流动相为100%甲醇,等度洗脱,检测波长480nm。质谱条件:APCI源,正离子模式;雾化气40psi;干燥气流速5L/min,干燥气温度350℃,离子源温度450℃;毛细管电压4500V,裂解电压60V,碰撞能量15ev;扫描范围m/z100~1000。
2.5 虾红素纯度测定
将虾红素标准品用二氯甲烷/甲醇(1∶9,V/V)配成20μg/mL的标准溶液,HPLC法分别进样5、10、15、20、25μL,以液相峰面积为纵坐标,以虾红素质量为横坐标绘制标准曲线。取1mg虾红素样品用二氯甲烷/甲醇(1∶9,V/V)定容至50mL,HPLC法进样20μL进行测定。
2.6 虾红素光谱特性分析
取少量虾青素和虾红素溶于二甲基亚砜使溶液颜色呈橙黄色,用紫外可见分光光度计扫描溶液最大吸收波长λmax,比较两者λmax差异。
2.7 虾红素稳定性
2.7.1光照条件将少量虾红素粉末溶于二甲基亚砜,使初始吸光值介于0.2和0.8之间,并测定初始吸光值。分别在避光、太阳光、室内自然光、灯光和紫外光5种条件下处理,8h后测定其在495nm下的吸光值,计算色素保留率,评价其稳定性。
色素保留率计算公式:

2.7.2 金属离子将少量虾红素粉末溶解于二甲基亚砜,使其在495nm下的初始吸光值介于0.2和0.8之间。取3mL虾红素溶液,各加入0.01mol/L的Ca2+、Mg2+、Zn2+、Cu2+、Na+、Fe3+、Fe2+的硫酸盐水溶液1mL,室温避光放置2d后,测定其在495nm下的吸光值,计算色素保留率。
2.7.3 pH配制3%的虾红素乙酸乙酯溶液,之后按体积比1∶9加入15%的吐温水溶液(含7%乙醇,pH=7.0)配成虾红素母液,用缓冲液调整其pH为3.0、4.0、5.0、6.0、7.0、8.0,室温避光放置2d后,测定其吸光值,计算色素保留率。
2.7.4 温度将少量虾红素粉末溶解于二甲基亚砜,使其在495nm下的初始吸光值在0.6左右。测定虾红素在15、40、60和80℃下的稳定性,计算色素保留率。
3结果与讨论
3.1 虾红素制备工艺条件优化研究皂化反应条件优化
前期试验表明,由于皂化反应是界面反应,皂化在水溶液中进行会导致碱和虾青素酯接触不充分降低皂化效率,故皂化助溶剂选取有机溶剂。本实验采用无毒的乙醇作为溶剂。且比较发现KOH比NaOH的皂化效果更好,所以选择KOH-乙醇溶液进行雨生红球藻油的皂化。
皂化过程中碱浓度、皂化时间和温度对皂化反应的影响如图2所示。由图中结果可知,随着碱浓度的升高,皂化液中虾红素含量逐渐增加,后期趋于稳定。由于碱浓度过高会造成后续脱盐较困难,因此,综合考虑选择碱液浓度为7%;皂化过程中,随反应时间延长,虾红素生成量增加,140和120min皂化液中虾红素含量相差不大,考虑时间过长可能会导致虾红素二次氧化降解,因此,选择120min作为合适的皂化时间;通过对比反应温度对虾红素生成量的影响发现,4℃下皂化反应速率缓慢,虾红素生成量明显低于其他温度,15℃下虾红素含量最高,当温度高于15℃时,温度升高虾红素含量反而略有下降,推测温度升高有可能加快虾红素降解,故选择15℃作为合适的皂化温度。综上所述,制备虾红素的最佳工艺条件为:碱液浓度7%,反应温度15℃,反应时间为120min。在此条件下制备虾红素,计算虾红素得率为62.16%。
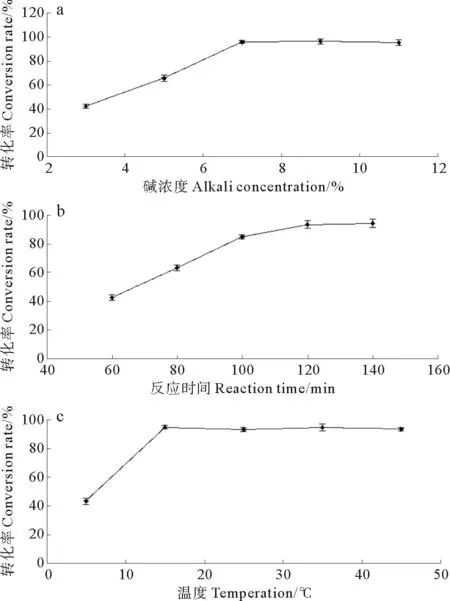
图2 碱浓度、皂化时间和温度对雨生红球藻藻油皂化反应的影响
3.2 虾红素制备过程表征
采用HPLC法检测皂化液中虾红素在虾青素类物质中的含量。图3为皂化前(a)和皂化过程中(b)的HPLC图。皂化前全部为虾青素酯,皂化后虾青素酯降解,产生了游离的虾青素和虾红素,随反应时间延长,酯全部水解,虾青素含量逐渐降低,虾红素含量逐渐升高。经HPLC-DAD-(APCI)MS/MS分析表明,峰1(保留时间8.634min)为虾青素([M+H]+597.5),峰2(保留时间9.565min)为半虾红素(分子量[M+H]+595.5),峰3(保留时间10.718min)为虾红素([M+H]+593.3)。
3.3 LC-MS/MS结果
虾红素粉末与标准品液相对照结果(见图4)表明所得粉末成分主要为虾红素。结合文献[3],由皂化液纯化后得到的粉末MS谱图分析虾红素裂解规律如图5所示。m/z593.4为虾红素质子化的分子离子峰,m/z575.5为[M+H-H2O]+,即虾红素分子失去一分子水所产生的碎片离子峰,为虾红素骨架的特征碎片离子,因此推断粉末成分为虾红素。根据虾红素的二级质谱图分析其裂解规律,发现虾红素的裂解易发生在共轭不饱和双键的长链上,分析其特征碎片可以为研究其降解机理提供理论基础。
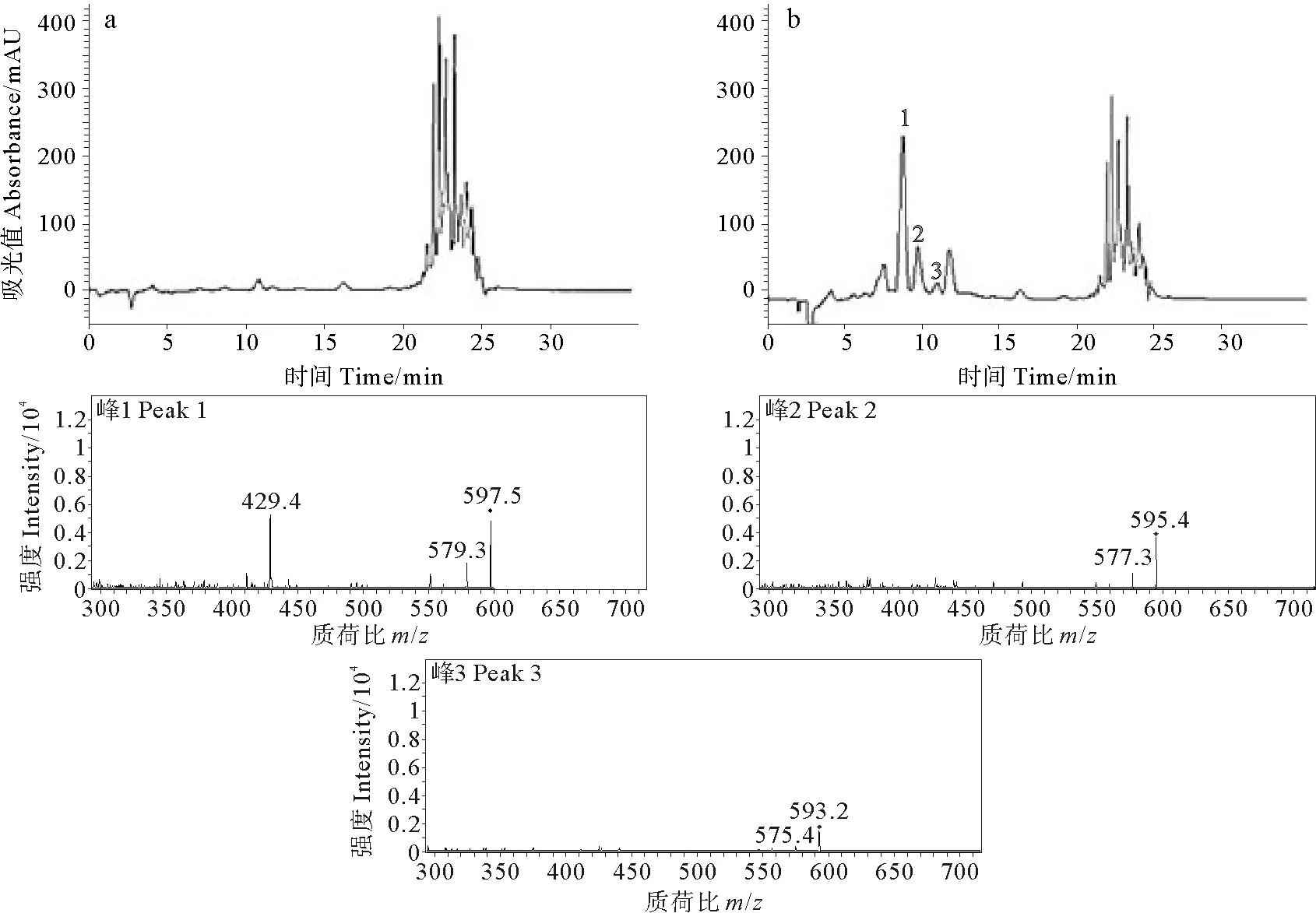
图3 雨生红球藻藻油皂化前(a)和皂化过程中(b)HPLC-DAD图谱及峰1、2和3的质谱图
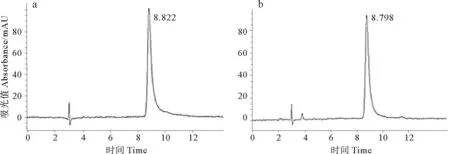
图4 虾红素标准品(a)和样品(b)HPLC图谱
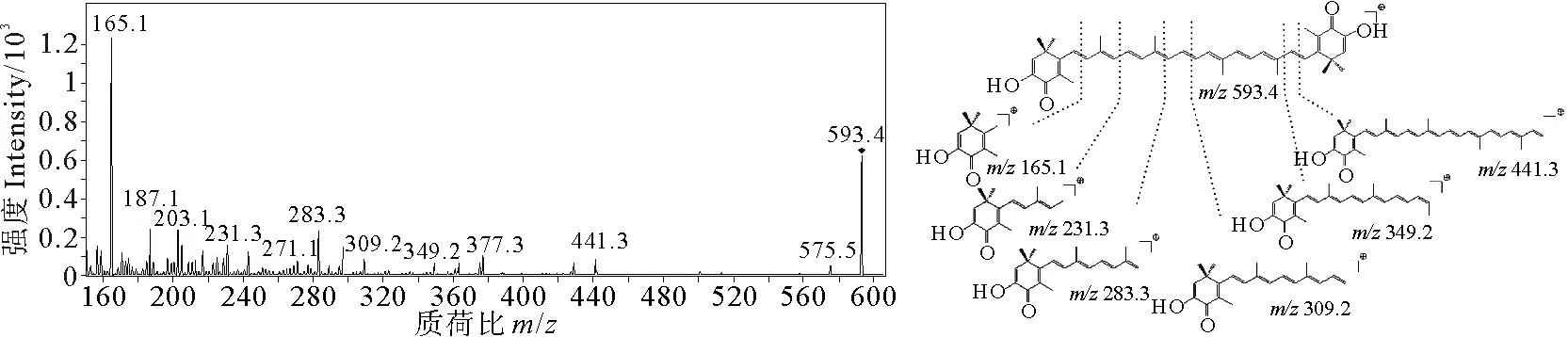
图5 样品二级质谱图及虾红素裂解规律
3.4 虾红素纯度
绘制的虾红素标准曲线方程为y=4.000 9x-20.700,且R2=1.000 0,经计算,制得的样品中虾红素纯度为80.36%。
3.5 虾红素光谱特性
光谱扫描结果(见图6)显示虾青素的最大吸收波长为480nm左右,虾红素最大吸收波长为495nm,表明虾红素增加2个双键后吸收光谱发生了红移,所以虾红素比虾青素在溶剂中颜色更为鲜艳。
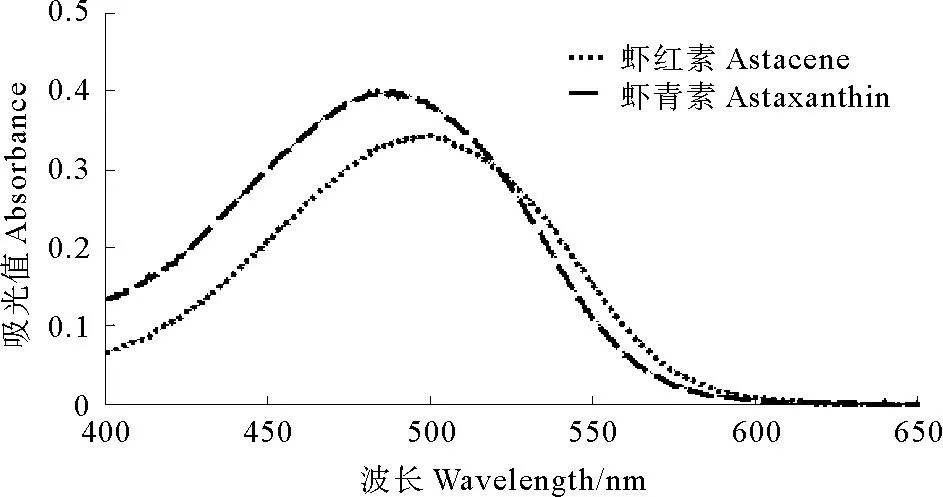
图6 虾青素和虾红素光谱扫描结果
3.6 稳定性
3.6.1光照条件由图7(a)比较不同光源照射8h后虾红素的稳定性。紫外光对虾红素破坏最严重,在连续照射8h后虾红素完全变为无色。日光对虾红素也有一定的破坏作用,原因可能是日光中有一定紫外线。而自然光和灯光相对较柔和,因此自然光、灯光和避光条件对虾红素影响较小。与其他类胡萝卜素相似,虾红素对光的敏感性归结于其分子内部不饱和双键等特殊结构在光作用下自身的氧化分解,从而导致双键消失,使得吸收光谱发生变化,吸收波长不再出现于可见区域,色泽消褪[9-11]。所以虾红素要尽量避光保存,虾红素着色的食品在运输和储藏过程中也要注意避光以保证其品质。
3.6.2 金属离子在色素的提取加工及应用的过程中往往要接触到金属离子,研究色素在金属离子存在条件下的稳定性对加工应用而言是很有参考价值的。如图7(b)所示,Fe3+存在时虾红素损失最严重,保留率仅为19.47%,其次是Ca2+、Cu2+,而Mg2+、Zn2+、Na+和Fe2+对虾红素影响不大。宋素梅等[12]研究结果表明,Cu2+、Fe2+和Fe3+对南极磷虾虾壳中的虾青素破坏最为严重,其中Fe3+对虾青素的影响最大,对虾红素而言,同样是Fe3+对其稳定性影响最大,猜测可能是与Fe3+氧化能力有关。因此在虾红素制取和应用过程中要尽量避免使用铁器。
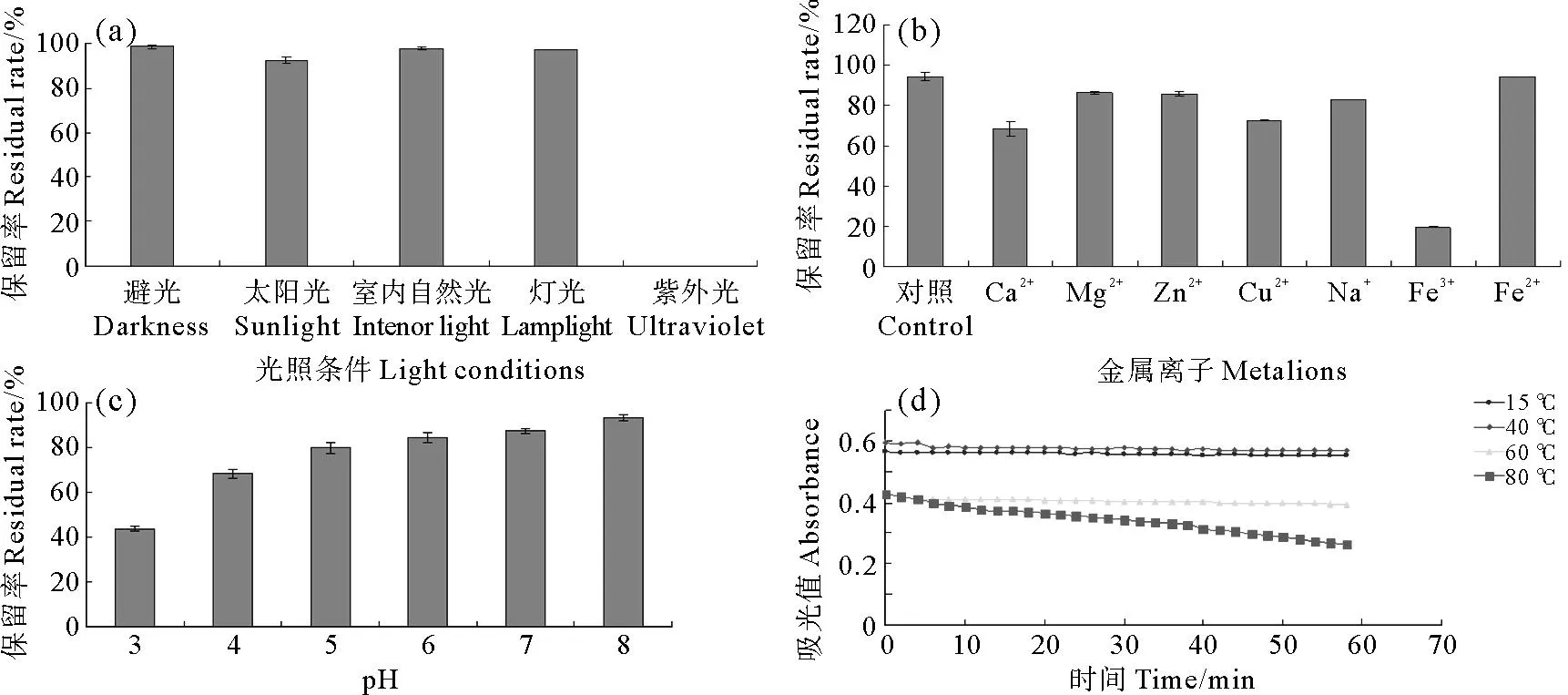
图7 光照(a)、金属离子(b)、pH(c)和温度(d)对虾红素稳定性的影响
3.6.3 pH考虑到虾红素在食品中的应用,测定其在pH为3~8范围内的稳定性。图7(c)表明,虾红素在pH为3~8范围内,随pH升高,虾红素保留率提高,故弱碱性有利于虾红素的稳定,而过酸则会对虾红素产生破坏作用。
3.6.4 温度由图7(d)可知,在温度为15 和40℃时虾红素较为稳定,加热60min时吸光值分别下降了1.89%和4.04%。而60和80℃时虾红素会产生降解,吸光值下降7.77%和38.20%。表明虾红素对温度具有一定的稳定性,在较低温度下稳定性较好,温度越高,虾红素越不稳定,越容易发生降解从而褪色,影响其着色效果。所以虾红素的保存和使用要避免高温。
4结语
本文创新性地以雨生红球藻为原料,采用皂化法和溶剂分配法分离制备高纯度虾红素,确定了最佳皂化工艺:碱液浓度为7%,皂化时间为120min,温度为15℃,并采用酸洗、醇洗和水洗的方法纯化出虾红素。此方法较合成法操作更为简便,且能够得到较高纯度的虾红素,适合工业化生产。采用HPLC-DAD-MS/MS方法对纯化后粉末进行分析,确定虾红素结构及裂解规律。另外,本文系统研究了虾红素的稳定性,考察了光照条件、金属离子、pH和温度对其稳定性的影响。发现紫外光对虾红素的破坏作用最强,其次是太阳光,灯光和室内自然光在考察期内对虾红素无明显影响;Fe3+存在时虾红素损失严重,Ca2+、Cu2+有一定破坏作用;弱碱性条件有利于虾红素的稳定;在较高温度(80℃)下虾红素会产生降解。上述研究结果可以为虾红素生物活性研究及其应用奠定基础。
参考文献:
[1]Danielli J F, Fox D L. Surface chemistry of carotenoids. 1. Astacene[J]. Biochemical Journal, 1941, 35(12): 1388.
[2]Grynbaum M D, Hentschel P, Putzbach K, et al. Unambiguous detection of astaxanthin and astaxanthin fatty acid esters in krill (EuphausiasuperbaDana)[J]. Journal of Separation Science, 2005, 28(14): 1685-1693.
[3]Holtin K, Kuehnle M, Rehbein J, et al. Determination of astaxanthin and astaxanthin esters in the microalgaeHaematococcuspluvialisby LC-(APCI) MS and characterization of predominant carotenoid isomers by NMR spectroscopy[J]. Analytical and Bioanalytical Chemistry, 2009, 395(6): 1613-1622.
[4]Goodwin T W, Srisukh S. The biochemistry of locusts. I. The carotenoids of the integument of two locust species (Locustamigratoriamigratorioides R. & F. andSchistocercagregariaForsk.)[J]. Biochemical Journal, 1949, 45(3): 263.
[5]Schiedt K, Vecchi M, Glinz E. Astaxanthin and its metabolites in wild rainbow trout[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1986, 83(1): 9-12.
[6]Britton G. Structure and properties of carotenoids in relation to function[J]. The FASEB Journal, 1995, 9(15): 1551-1558.
[7]Rao R N, Alvi S N, Rao B N. Preparative isolation and characterization of some minor impurities of astaxanthin by high-performance liquid chromatography[J]. Journal of Chromatography A, 2005, 1076(1): 189-192.
[8]孙伟红, 肖荣辉, 冷凯良, 等. 雨生红球藻中虾青素的C30-反相高效液相色谱法测定[J]. 分析测试学报, 2010, 29(8): 841-845.
SUN Wei-Hong, XIAO Rong-Hui, LENG Kai-Liang, et al. Determination of AstaxanthininHaematococcuspluvialisby C30 Reversed-Phase High Performance Liquid Chromatographic Method[J]. Journal of Instrumental Analysis, 2010, 29(8): 841-845.
[9]姜启兴, 夏文水. 龙虾壳中色素的稳定性研究[J]. 食品科学, 2006, 27(7): 61-64.
JIANG Qi-Xing, XIA Wen-Shui. Study on Pigment Stability of Crayfish Offal[J]. Journal of Food Science, 2006, 27(7): 61-64.
[10]Caris-Veyrat C, Schmid A, Carail M, et al. Cleavage products of lycopene produced by in vitro oxidations: characterization and mechanisms of formation[J]. Journal of Agricultural and Food Chemistry, 2003, 51(25): 7318-7325.
[11]Rodriguez E B, Rodriguez-Amaya D B. Formation of apocarotenals and epoxycarotenoids from β-carotene by chemical reactions and by autoxidation in model systems and processed foods[J]. Food Chemistry, 2007, 101(2): 563-572.
[12]宋素梅, 刘富俊, 姜启兴, 等. 南极磷虾虾壳中虾青素稳定性的研究[J]. 食品工业科技, 2012, 33(18): 96-98.
SONG Su-Mei, LIU Fu-Jun, JIANG Qi-Xing, et al. Study on the stability of astaxanthin from Antarctic krill shells[J]. Science and Technology of Food Industry, 2012, 33(18): 96-98.
责任编辑朱宝象
Preparation of Astacene fromHaematococcuspluvislisand Analysis of its Stability
LI Xue-Min, ZHOU Qing-Xin, XU Jie, YANG Lu, YANG Shu, ZHANG Ting, XUE Chang-Hu
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:Astacene is a kind of carotenoid which can be used as colorant and antioxidant. Its structure is similar to astaxanthin. While astaxanthin has been studied for years, no much attention has been paid on astacene. The purpose of this study is to prepare astacene from Haematococcus pluvislis extract and to study some properties of it. In this study, Haematococcus pluvislis extract was used as the raw material of preparing purifying astacene with saponification method and solvent distribution method with its structure and stability determined. In terms of the saponification condition, alkali concentration, reaction time and reaction temperature were optimized. The optimal condition was as follows: the concentration of alkali was 7%, saponification time was 120 min, and the temperature was 15 ℃. After saponification under this condition, the saponification solution was placed under 4 ℃ overnight to make astacene precipitate as much as possible. Then the solution was centrifuged and the sediment was washed with HCl-ethonal solution(v/v, 1∶9)and 50% ethonal for 4~5 times to remove alkali and impurities. At last, the sediment was freeze-dried and astacene was obtained. The conversion rate of astacene was up to 96.12% with a 62.16% yield of astacene. The purity of the sample was 80.36%. The product was analyzed by HPLC-DAD-(APCI)MS/MS, and the MS decomposition rule of astacene was parsed. It was found that astacene mainly lost water and ruptured on its conjugated double bonds in MS/MS. Finally, the effects of light conditions, metal ions, pH and temperature on astacene stability were studied. The results showed that ultraviolet had the strongest damaging effect on astacene. Fe3+, Ca2+and Cu2+caused damage to astacne at different degrees, while Zn2+, Mg2+, Na+and Fe2+had little effect on it. Acidity between pH 3 and 8, the stability of astacene increased with pH. With the increase of temperature, retention rate of astacene decreased. This study provided a reference for the research of astacene in terms of its activity, toxicology and application in food.
Key words:Haematococcus pluvislis; astacene; HPLC-MS; stability
中图法分类号:TS254.9
文献标志码:A
文章编号:1672-5174(2016)01-049-07
作者简介:李学敏(1991-),女,硕士。E-mail: haidalixuemin@163.com
收稿日期:2014-12-18;
修订日期:2015-05-03
*基金项目:国家自然科学基金项目(U1406402;31571864);“泰山学者”建设工程专项经费项目资助
DOI:10.16441/j.cnki.hdxb.20140415
引用格式:李学敏, 周庆新, 徐杰, 等. 雨生红球藻虾红素的制备及其稳定性研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(1): 49-55.
LI Xue-Min, ZHOU Qing-Xin, XU Jie, et al.An integrative evaluation of ecological effect of artificial reefs with entropy-weighted fuzzy matter-element method[J]. Periodical of Ocean University of China, 2016, 46(1): 49-55.
Supported by National Natural Science Foundation of China(U1406402;31571864); Special Financial Fund of Taishan Scholars Construction Program
**通讯作者: E-mail: xuech@ouc.edu.cn
