光照强度和温度对巨藻幼孢子体的生长和生化组成的影响*
2016-04-07芦薇薇王巧晗宫庆礼
芦薇薇, 王巧晗, 宫庆礼
(中国海洋大学水产学院, 山东 青岛 266003)
光照强度和温度对巨藻幼孢子体的生长和生化组成的影响*
芦薇薇, 王巧晗**, 宫庆礼
(中国海洋大学水产学院, 山东 青岛 266003)
摘要:本文研究了在不同光照强度和温度条件下巨藻(Macrocystis pyrifera)的特定生长率和生化组成,揭示了光照强度和温度对巨藻幼孢子体的生长及生化组成的影响规律。实验共设置4个光照强度处理组(50、100、150和200μmol/(m2·s))和4个温度处理组(5、10、15和20℃),采用完全交叉分组的方法。结果表明:不同光照强度和温度组合对巨藻幼孢子体生长和生化组成有不同影响,且光照强度和温度对巨藻幼孢子体生长和生化组成具有交互作用。光照强度一定时,随着温度的增加,特定生长率均呈先上升后下降的趋势,各光照强度处理组均在15℃时达到最大值。蛋白质含量呈逐渐上升趋势,各光照强度处理组在20℃时达到最大值;叶绿素a和叶绿素c含量总体呈先上升后下降的变化趋势,除150μmol/(m2·s)光照强度处理组外,其他光照强度处理组的叶绿素a和叶绿素c均在15℃时达到最大值;碳含量呈先上升后下降的趋势,在10或15℃时达到最高值;氮的含量呈逐渐递减趋势;碳水化合物含量呈先上升后下降趋势,各光照强度组均在15℃时达到最大值。均在温度一定时,随着光照强度的增加,特定生长率均先上升后下降,各温度处理组均在光照强度100μmol/(m2·s)时达到最大值。蛋白质含量也呈先上升后下降趋势,各温度处理组均在光照强度100μmol/(m2·s)时达到最大值;叶绿素a和叶绿素c的在不同温度组变化趋势不同;碳含量呈先上升后下降的趋势,各温度处理组均在光照强度150μmol/(m2·s)时达到最大值;氮含量在光照强度50~150μmol/(m2·s)呈递减趋势,在200μmol/(m2·s)时升高,并达到最大值;碳水化合物含量呈先上升后下降趋势,各温度组在光照强度150μmol/(m2·s)时达到最大值。光照强度、温度及二者的交互作用对巨藻的生长及部分生化组成有显著影响(P<0.05),但对巨藻的物质积累没有显著影响(P>0.05)。
关键词:光照强度;温度;巨藻幼孢子体;生长;生化组成;物质积累
巨藻(Macrocystispyrifera)是一种生活在潮下带的大型海藻[1],分布于大洋洲和南美洲南部沿海以及北美洲太平洋沿岸有上升冷水流的水域[2],成熟的巨藻一般长70~80m,最长可达到100m[3]。巨藻在海洋生态和现代水产动物的养殖中有着重要的作用。大量巨藻可以形成巨藻林[4],巨藻林有多重功能,例如成为各种生物的避难所并为其提供食物[5-8],成为减小海水流速的物理屏障[9-11],还有研究发现,巨藻林可以改变水体内的非生物条件,增加无脊椎动物的生物补充量[7]。因为巨藻林形状巨大,形态美观,所以巨藻也可以作为观赏类植物在水族馆展出,目前,巨藻林在世界范围内只有少数几家水族馆展出,包括加利福尼亚的蒙特利湾水族馆、南非的两洋水族馆、日本的登岛水族馆、台湾的国立海洋生物博物馆和2014青岛世界园艺博览会植物馆。巨藻还可以成为一些水产养殖动物的饲料,如智利养殖的红鲍螺和皱纹盘鲍都依靠人工采集的巨藻作为饲料[12-14],墨西哥的凡那滨虾养殖用巨藻作为饲料取代传统的绿藻饲料,均得到良好效果[15]。
巨藻属于外来的引进藻类[16],它的养殖在中国沿海地区获得成功,但是由于育苗等原因,目前中国的巨藻养殖尚属于停滞状态[17]。巨藻的幼孢子体是卵受精后形成的合子经细胞分裂形成的,具有叶片小而薄的特点。巨藻幼孢子体培养是巨藻的养殖中至关重要的环节。在藻类的养殖过程中,水环境中的光照和温度都会对藻类的生长和生化组成产生深刻的影响,这2个环境因子,除了具有自身合适的范围外,还有可能存在交互作用。对于巨藻这种引进藻类来说,如何在养殖环境中设定合适的光照强度和温度,对于它的成功养殖有着重要意义[18-20]。
本研究的目的就是探究不同光照强度与温度交互作用对巨藻幼孢子体生长率、生化组成及物质积累的影响,以期为巨藻在中国的养殖和展馆展出的前期培养提供理论依据。
1材料和方法
1.1 材料和暂养
本实验所用的巨藻幼孢子体由中国水产科学院黄海水产研究所王飞久研究员提供。2013年10月8日将巨藻幼孢子体放入充满灭菌过滤海水的水槽(62cm×47cm×41cm)内,海水温度为11℃,光照强度90μmol/(m2·s),光暗周期12L∶12D,每天更换过滤海水,充气,暂养3d。
1.2 实验设计
暂养结束后,选取健康的不超过2cm的藻片用蒸馏水冲洗叶片,去除附生植物,称重,每0.5g放于1L过滤海水的锥形瓶中,不添加营养盐,充气、温度,光照如上所述,在光照培养箱(型号为GXZ-280D,宁波江南仪器厂)中培养,以便控制光照强度和温度。24h后首次添加1/4PESI营养盐,设置4个光照强度分别为50,100,150,200μmol/(m2·s),每个光照强度下再设置4个温度,分别为5、10、15和20℃,设置3个平行组,培养12d,每3d更换一次灭菌海水和营养盐。
培养实验结束后,从锥形瓶中取出巨藻幼孢子体,迅速放置于吸水纸上小心吸干藻体表面的水分,称取藻体湿重,记录数据,并将藻体存放于耐低温聚乙烯封存袋中,放至-20℃冰箱中冻存样品。
1.3 测定及计算方法
生长率的计算依照以下公式计算特定生长率:
SGR=(lnWt-lnW0)/t×100。
式中:Wt是实验结束时藻体湿重;W0是实验开始时藻体的湿重;t为培养天数。
蛋白质含量的测定采用考马斯亮蓝试剂盒法测定,以血清蛋白作为标准[21]。
叶绿素含量的测定采用丙酮萃取法测定[22]。
物质积累的测定采用元素分析仪分析测定[23]。
碳水化合物含量的测定采用蒽铜-浓硫酸法测定[24]。
1.4 实验数据的处理及分析方法
使用统计软件SPSS 17.0对实验数据进行统计学分析。由于所得数据受光照和温度2个环境条件的影响,因此采用双因素方差分析。设定P<0.05为差异显著性水平。
2结果
2.1 光照强度、温度对巨藻幼孢子体特定生长率的影响
巨藻幼孢子体的特定生长率(Special Growth Rate,SGR)受光照强度、温度以及二者的交互作用影响显著,且影响程度为温度>光照强度>二者交互作用(见图1,表1)。随光照强度和温度的变化特定生长率有着比较规律的变化趋势。光照强度一定时,随着温度的上升,SGR也先上升后下降,其中在温度15℃时,SGR最大(P<0.05),其次为20、10℃,在5℃时SGR最小(P<0.05)。温度一定时,随着光照强度的增加,SGR呈有先上升再下降的趋势且差异显著,其中光照强度为100μmol/(m2·s)时SGR最大(P<0.05),其次为150和200μmol/(m2·s),在50μmol/(m2·s)时SGR最小(P<0.05)。故在光照强度100μmol/(m2·s)温度15℃时,SGR达到实验时的最大值(18.401mg/g),在光照强度50μmol/(m2·s)温度5℃时,SGR最小(2.358%)。
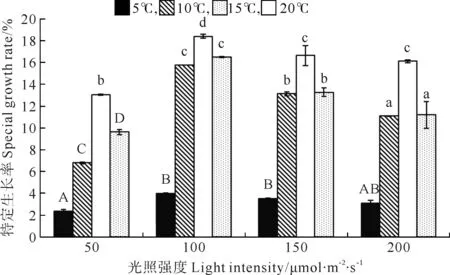
(不同的大小写字母表示在不同条件下P<0.05的差异水平,竖线表示正负标准差(n=3)。Different capital or small letters indicate significance level atP<0.05 among different conditions.Vertical bars indicate ±SD(n=3).)

图1 不同光照强度、温度条件下巨藻幼孢子体的特定生长率
Note:①Degrees of freedom; ②Mean square; ③Special growth rate; ④Light Intensity; ⑤Tempreture; ⑥Light Intensity × Tempture; ⑦Error
2.2 光照强度、温度对巨藻幼孢子体蛋白质含量的影响
巨藻幼孢子体的蛋白质含量受光照、温度以及二者的交互作用影响显著,且影响程度为温度>光照强度>二者交互作用(见图2,表2)。在光照强度一定时,随着温度的升高,蛋白质含量基本上是逐渐升高且差异显著,除了光照组100和150μmol/(m2·s)在10℃时蛋白质含量高于15℃,在温度20℃时,各组蛋白质含量显著高于其他温度组(P<0.05)。在温度一定时,蛋白质含量受光照强度影响显著并且趋势一致,随着光照强度的增加,蛋白质含量先升高后降低,在各温度组,最大蛋白质含量在光照强度为100μmol/(m2·s)时,显著高于其他光照组(P<0.05)。整体来看,在温度20℃光照强度100μmol/(m2·s)时,蛋白质含量最高(17.766mg/g),在温度5℃光照强度为50μmol/(m2·s)时,蛋白质含量最低(2.502mg/g)。
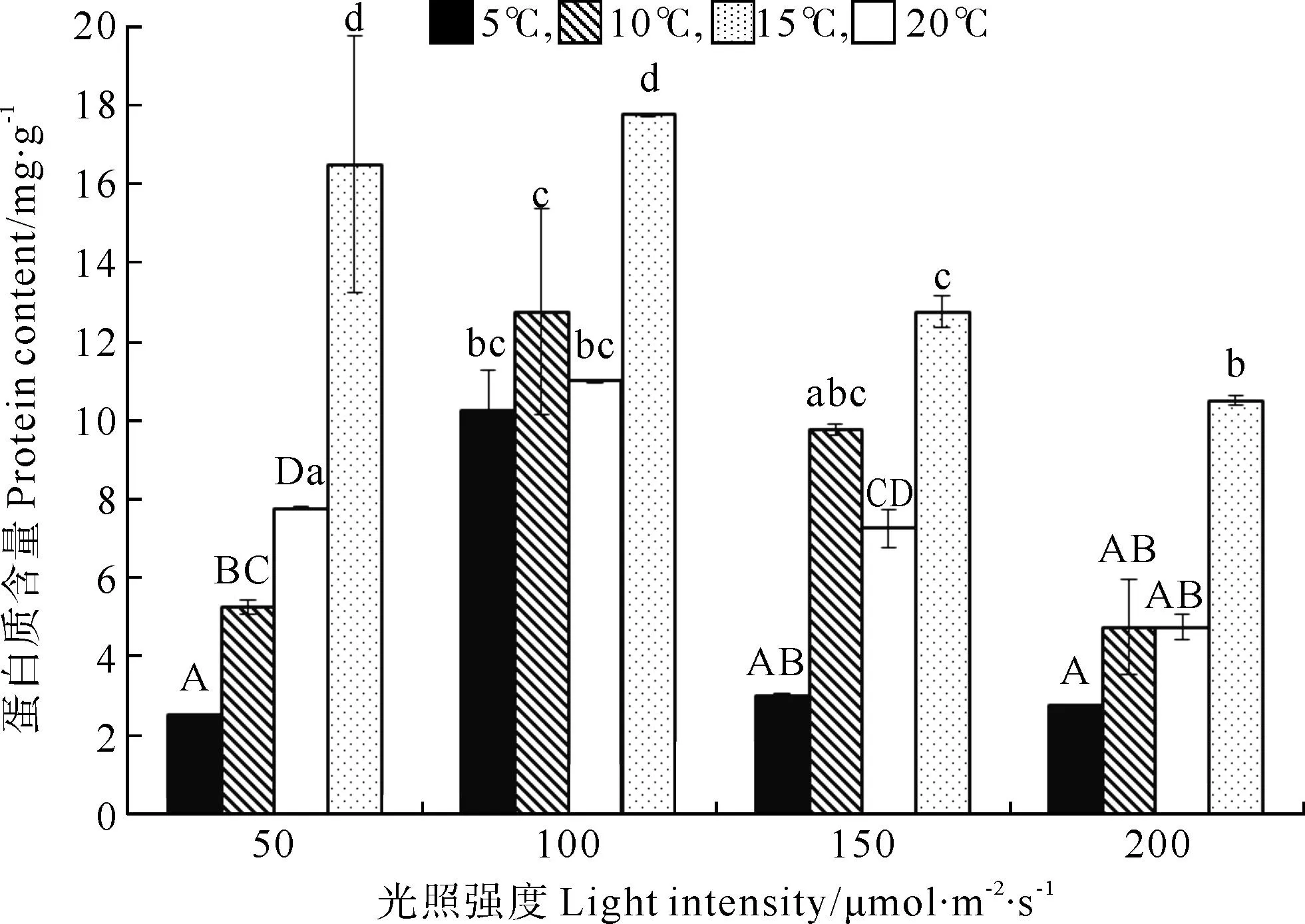
(不同的大小写字母表示在不同条件下P<0.05的差异水平,竖线表示正负标准差(n=3)。Different capital or small letters indicate significance level atP<0.05 among different conditions.Vertical bars indicate ±SD(n=3).)
图2不同光照强度、温度条件下巨藻幼孢子体的蛋白质含量
Fig.2Protein content of youngMacrocystispyrifera
sporophyte under different light intensity and
temperature conditions
2.3 光照强度、温度对巨藻幼孢子体叶绿素含量的影响
巨藻幼孢子体的叶绿素a含量受光照、温度以及二者的交互作用影响显著,且影响程度为温度>光照强度>二者交互作用(见图3a,表3)。当光照强度一定时,随着温度升高,叶绿素a含量基本上先升高后下降,除了光照150μmol/(m2·s)组的叶绿素a最大含量出现在10℃,其他光照组的叶绿素a最大含量都出现在15℃且显著高于其他温度(P<0.05),最低叶绿素a含量除了在光照50μmol/(m2·s)组出现在温度10℃以外,其他光照组均出现在温度5℃时。当温度一定时,随着光照强度的增加,叶绿素a含量基本上逐渐降低且差异明显,但是温度10℃组没有这样的趋势,它的最高叶绿素含量出现在光照强度150μmol/(m2·s),其他温度组的最高叶绿素a含量都出现在光照强度50μmol/(m2·s)。整体来看,光照强度50μmol/(m2·s)温度15℃时,叶绿素a含量最高(1.203mg/g),光照强度150μmol/(m2·s)温度为5℃时,叶绿素a含量最低(0.425mg/g)。
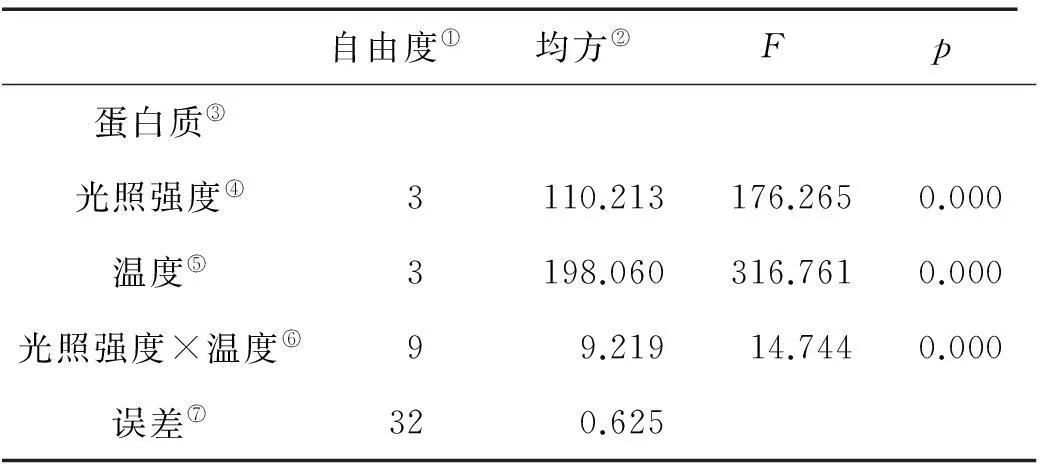
表2 光照强度、温度对巨藻幼孢子体
Note:①Degrees of freedom;②Mean square; ③Protein; ④Light Intensity;⑤Tempreture; ⑥Light Intensity × Tempture; ⑦Error
巨藻幼孢子体的叶绿素c含量受光照和温度影响显著,但受二者的交互作用影响不显著,影响程度为温度>光照强度(见图3b,表3)。当光照强度一定时,随着温度升高,叶绿素c含量基本上先升高后下降,除了光照150μmol/(m2·s)组的叶绿素c最大含量出现在10℃,其他光照组的最大叶绿素c含量都在15℃,并显著高于其他温度,最低叶绿素c含量除了光照50μmol/(m2·s)组出现在温度10℃外,其他光照组均在温度5℃时。当温度一定时,随着光照强度的增加,叶绿素c含量基本逐渐降低且差异明显,但是温度10和20℃一组未见这样的趋势,10℃组的最高叶绿素c含量出现在150μmol/(m2·s),20℃组的最高叶绿素c含量出现在100μmol/(m2·s),其他温度组的最高叶绿素c含量都出现在光照强度为50μmol/(m2·s)时。整体来看,在光照强度为50μmol/(m2·s)温度15℃时,叶绿素c含量最高(6.545mg/g),在光照强度150μmol/(m2·s),温度5℃时,叶绿素c含量最低(2.076mg/g)。
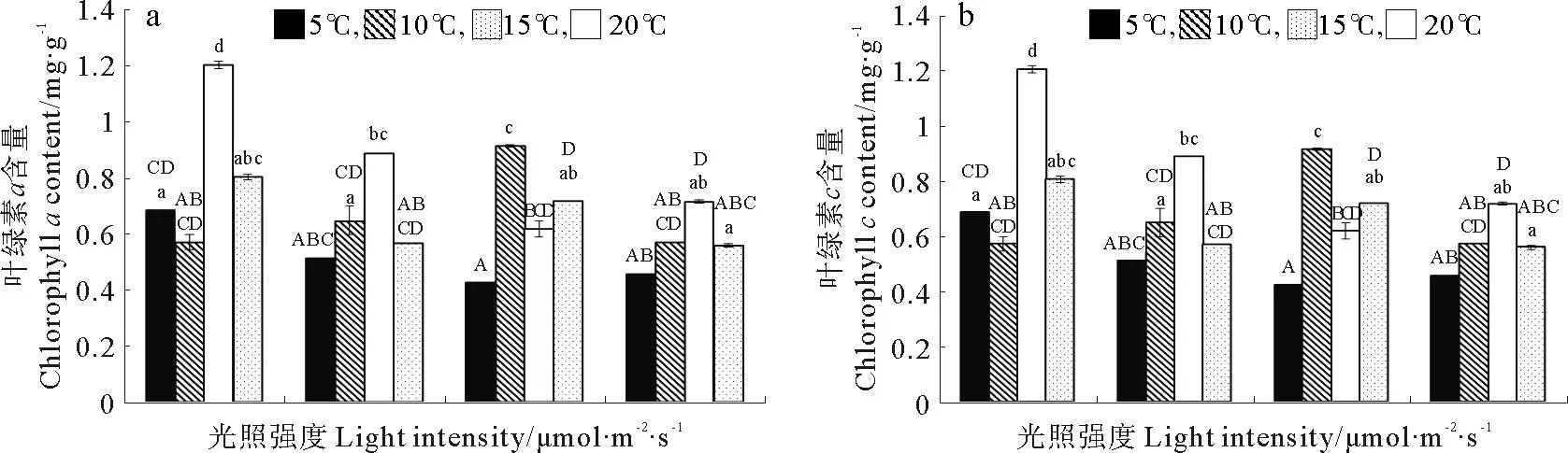
(不同的大小写字母表示在不同条件下P<0.05的差异水平,竖线表示正负标准差(n=3)。Different capital or small letters indicate significance level atP<0.05 among different conditions.Vertical bars indicate ±SD(n=3).)
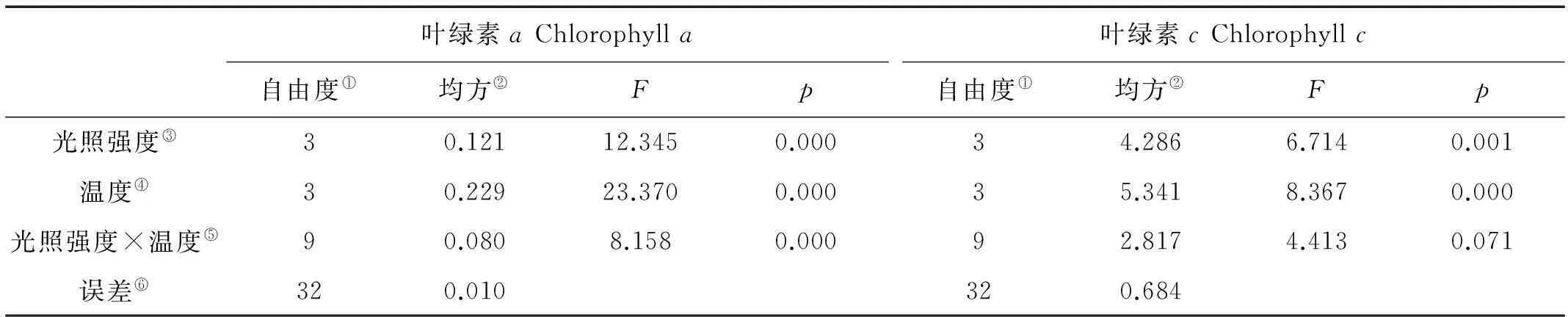
图3 不同光照强度、温度条件下巨藻幼孢子体的叶绿素含量
Note:①Degrees of freedom; ②Mean square; ③Light Intensity; ④Tempreture; ⑤Light Intensity × Tempture; ⑥Error
2.4 光照强度、温度对巨藻幼孢子体物质积累的影响
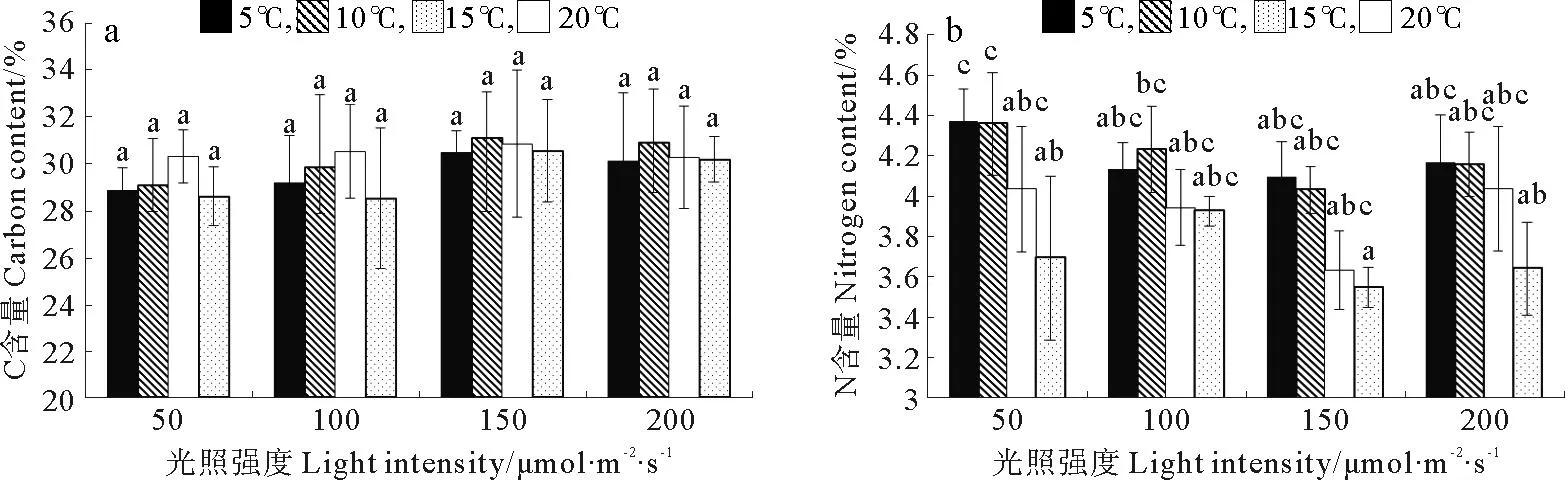
巨藻幼孢子体的碳含量受光照强度、温度以及二者的交互作用影响均不显著(见图4a,表4)。在光照强度一定时,随着温度的升高,碳含量先上升后下降,变化有规律但差异不显著(P>0.05),各光照组在温度为10或15℃时达到最大值。在温度一定时,碳含量受光照强度影响有规律但不显著(P>0.05),随着光照强度的增加,碳含量先升高后降低,在各温度组,最大碳含量均出现在光照强度150μmol/(m2·s)时。整体来看,在温度10℃光照强度150μmol/(m2·s)时,碳含量最高(31.8%),在温度20℃光照强度100μmol/(m2·s)时,碳含量最低(28.50%)。
巨藻幼孢子体的氮含量受光照强度和温度的影响明显,但受二者交互作用的影响不明显,影响程度为温度>光照强度(见图4b,表4)。在光照强度一定时,随着温度的升高,氮含量逐渐减少且差异显著(P<0.05),最大值和最小值分别在温度为5和20℃时。在温度一定时,随着光照强度的增加,氮含量先减少后增加,各组之间差异显著(P<0.05),最大值和最小值分别在光照强度200和150μmol/(m2·s)时。整体来看,在温度5℃光照强度50μmol/(m2·s)时,氮含量最高(4.36%),在温度20℃光照强度150μmol/(m2·s)时,氮含量最低(3.54%)。
(不同的小写字母表示在不同条件下P<0.05的差异水平,竖线表示正负标准差(n=3)。Different capital or small letters indicate significance level atP<0.05 among different conditions.Vertical bars indicate ±SD(n=3).)
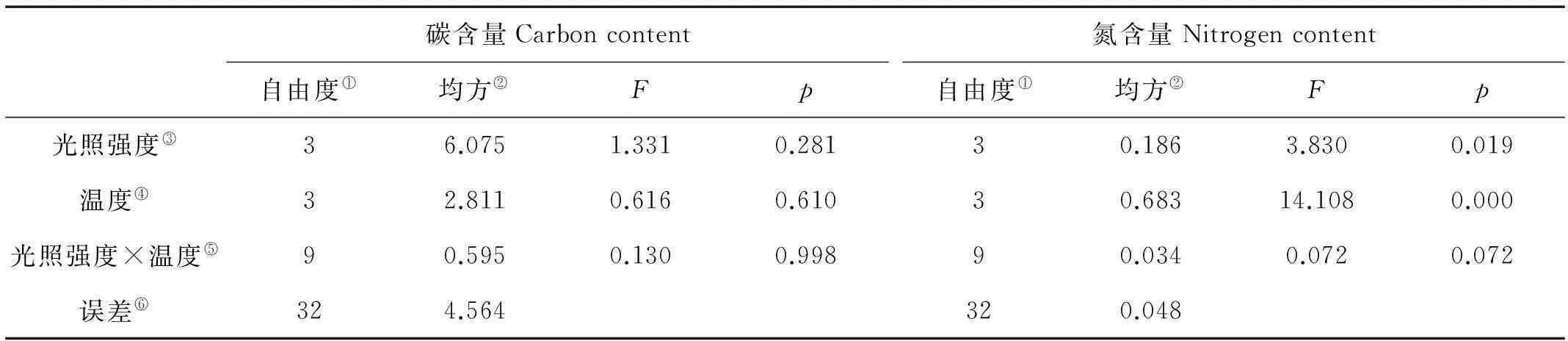
图4 不同光照强度、温度条件下巨藻幼孢子体碳含量、氮含量
Note:①Degrees of freedom; ②Mean square; ③Light Intensity; ④Tempreture; ⑤Light Intensity × Tempture; ⑥Error
2.5 光照强度、温度对巨藻幼孢子体碳水化合物含量的影响
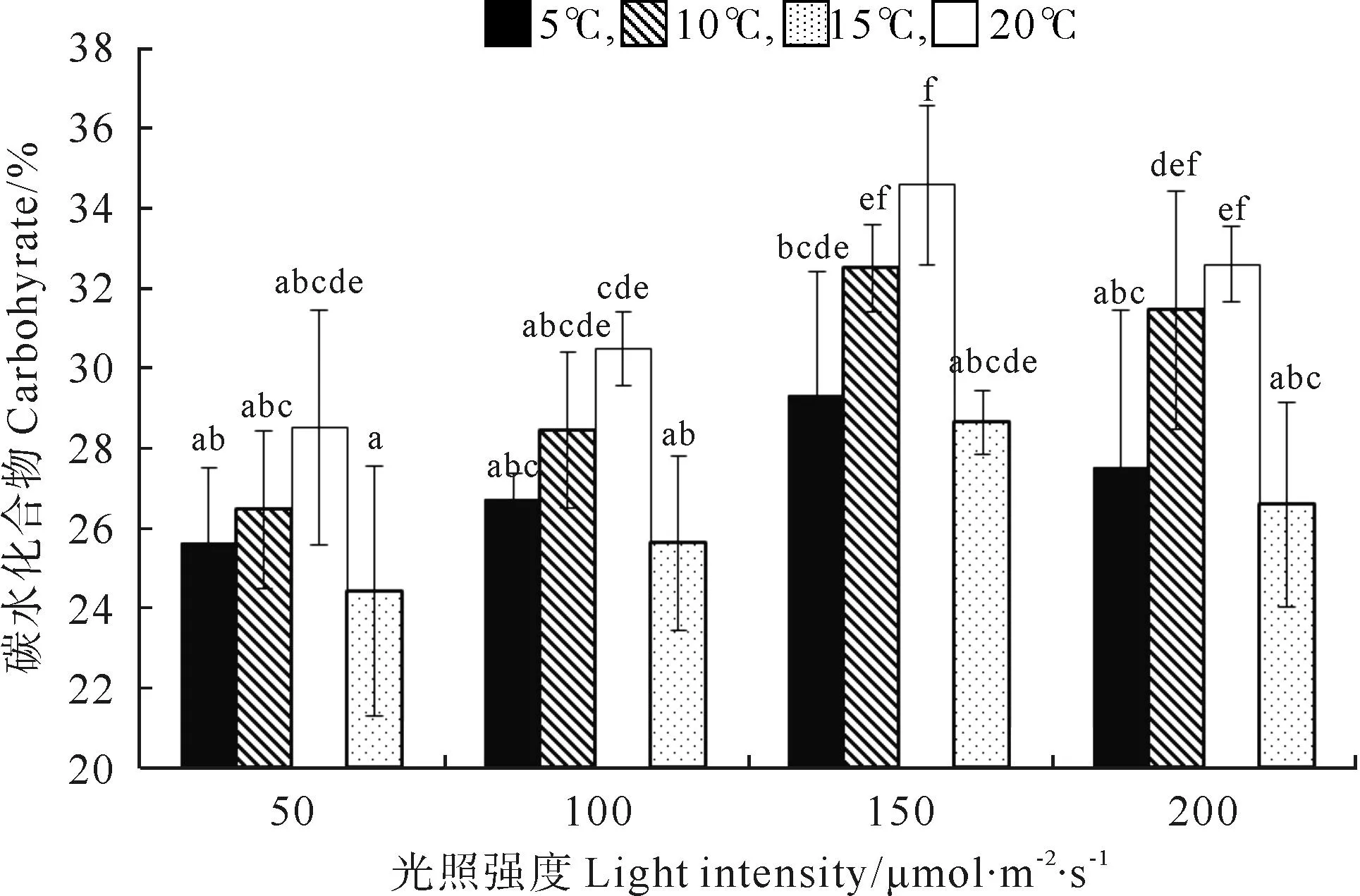
巨藻幼孢子体的碳水化合物含量受光照强度、温度的影响显著(P<0.05),且温度的影响大于光照强度的影响,但受二者的交互作用影响不显著,影响程度为温度>光照强度(见图5,表5)。在光照强度一定时,随着温度的升高,碳水化合物含量先上升后下降,变化有规律且差异显著(P<0.05),各光照组在温度为15℃时达到最大值。在温度一定时,碳水化合物的含量受光照强度影响有规律且差异显著(P<0.05),随着光照强度的增加,碳水化合物含量先上升后下降,在各个温度组,最大碳含量均出现在光照强度150μmol/(m2·s)时。整体来看,在温度15℃光照强度150μmol/(m2·s)时,碳水化合物含量最高(34.56%),在温度20℃光照强度50μmol/(m2·s)时,碳含量最低(24.41%)。
(不同的小写字母表示在不同条件下P<0.05的差异水平,竖线表示正负标准差(n=3)。Different small letters indicate significance level atP<0.05 among different conditions.Vertical bars indicate ±SD(n=3).)
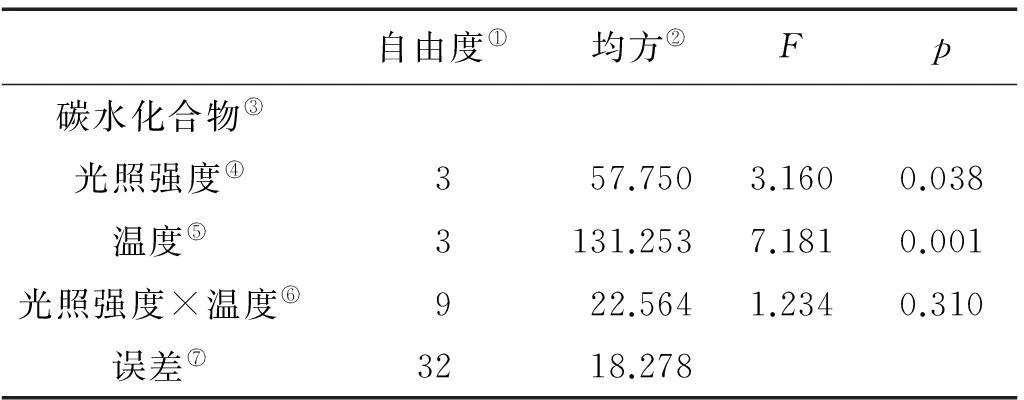
图5 不同光照强度、温度条件下巨藻碳水化合物的含量
Note:①Degrees of freedom; ②Mean square; ③Carbohyrate; ④Light Intensity; ⑤Tempreture; ⑥Light Intensity × Tempture; ⑦Error
3讨论
光照强度和温度都是影响大型海藻生长、生化组成和物质积累等生命活动重要的环境因子。国内外已有研究表明二者的交互作用对水生生物的影响与单因子作用有一定的差异,并且对不同水生生物的影响也不同。温度对大型海藻的影响主要体现在限制体内某些反应酶的活性从而影响藻体呼吸作用、光合作用、营养盐吸收等生命活动。光照强度对大型海藻的主要影响体现在提供能量、影响硝酸还原酶的活性等从而影响藻体的光合作用、能量积累。包杰等[25]研究发现,光照强度和温度对鼠尾藻的营养盐吸收有显著影响且二者的交互作用显著。徐智广等[26]研究发现,光照强度和温度对羊栖菜吸收无机磷的作用有显著影响。刘静雯等[27]研究发现,细基江蓠的生长率、生化组成受光照强度和温度交互作用影响明显,生化组成包括藻红素、叶绿素a及碳水化合物/蛋白质比率。对于光照强度和温度的交互作用对大型海藻幼孢子体生长和物质组成的影响,只有零星报道,特别是巨藻这种外来海藻,它的早期发育研究在国内仅有的报道多集中于1980年代。
在本研究中发现光照强度和温度对巨藻的生长及物质组成均有不同程度的显著影响。具体说来是,巨藻的特定生长率、蛋白质含量、叶绿素a含量、碳水化合物含量受光照、温度及二者的交互作用影响显著;巨藻的叶绿素c含量受光照和温度的影响显著,但二者的交互作用影响不显著;巨藻的碳含量受光照、温度及二者的交互作用影响不显著,氮含量受光照强度、温度的影响显著,且温度作用大于光照强度的作用,但二者的交互作用影响不显著。
光照是影响藻类生长的一个重要生态因子[28]。本实验中光照超过100μmol/(m2·s)之后,藻体的特定生长率、蛋白质含量和叶绿素含量都出现了下降的趋势,这与一般研究结果的结论是一致的,如绿色杜氏藻(Dunaliellaviridis)和盐生杜氏藻(Dunaliellasalina)最高收获量的光强均为6000lx,光强为6000~12000lx时,随着光强的增加,获得的藻体数量就会下降[29],雨生红球藻(Haematococcuspluvialis)从低光强到高光强,随着时间的变化,单位细胞叶绿素a的含量逐渐减少,直至达到一个稳定值[30]。本研究还发现,随着光照强度的增加,巨藻叶绿素的降低趋势要大于特定生长率减小的趋势,也就是说与巨藻的最适光照相比,高的光强下叶绿素减少了很多,而特定生长率减少的相对较小。这是因为藻类对于光能利用具有较强的主动性,即藻类能够通过调节自身的光合色素以控制对于光能的利用能力[31]。本研究中还发现,即使在弱光环境下(50、100μmol/(m2·s)),叶绿素的含量并没有很低,有时甚至高于最适光强下的叶绿素含量,这与Sukenik和Berner的研究结果一致,他们认为,在弱光条件下,藻体为了增加光吸收和光利用率,会增加膜上色素蛋白体的含量以确保进行有效的光合作用[32-33]。过强的光照强度也会影响藻类的特定生长率,因为高光强会破坏藻体内的酶活性,导致细胞生长减缓甚至是死亡[34],在本研究中表现为高光条件下巨藻的叶绿素含量减少,生长率下降,N含量减少。在本研究中,碳水化合物在低光照强度(50μmol/(m2·s))和高光照强度(200μmol/(m2·s))条件下含量较低,此结果与林真贤[35]对龙须菜的实验的结果有相似之处,原因在于过高和过低的光照强度都不利于巨藻幼孢子体进行光合作用。
温度过高或过低,都会导致藻体的生长不良。低温环境下,催化光合作用的酶获得的能量较少,导致光合作用减缓[36],在本研究中表现为低温环境下巨藻幼孢子体生长缓慢。蛋白质含量在一定程度上反映了巨藻幼孢子体内的酶水平和色素水平,一些研究表明,在藻体中蛋白质含量与温度成负相关,如随着温度的降低,细枝江蓠繁枝变型生长和酶反应速率受到明显抑制,但是此时藻体内色素和酶水平出现了补偿性增加。提高藻体对光能的有效利用率,维持藻类的生长,这是海藻适应环境的一种自身调节过程[26,37],在本研究中,并没有出现明显的类似结果,只有叶绿素a和叶绿素c在某些条件下显示出低温环境中的含量高于高温中的含量,但蛋白质含量却随温度的上升而增加,原因可能在于,在低温条件下,巨藻孢子体为了抵御低温环境增大呼吸速率产生热量,消耗糖类物质后消耗蛋白质,还可能是由于本实验中所采用的实验条件都是温度和光照的交互作用,光照对蛋白质的吸收也有很大作用,另外,巨藻属于冷水性藻类,与细枝江蓠繁枝变型这种喜温藻类对高温的应激反应不同。在本实验中,过高(20℃)和过低(5℃)温度条件下,碳水化合物含量较低,原因可能在于,在不适温度条件下,藻体增大呼吸作用以便产生藻体在不适条件下应激反应的能量,消耗了碳水化合物,而高温条件下,值得注意的是,本研究中碳水化合物含量的变化趋势与生长率、叶绿素c含量的变化趋势非常相似,都是随着光照强度或温度的增加先上升后下降,这也反映了光照强度和温度对幼孢子体的影响存在一定规律。
光照强度和温度是维持植物的生长和生化组成至关重要的因子。在本研究中,除了叶绿素c受二者的交互影响不显著外,生长率和其他生化组成都受光照强度、温度及二者的交互作用显著,且光照强度和温度的影响作用一样显著。这是因为这2个环境因子共同影响着生命体酶的活性、能量积累、呼吸作用、光合作用等重要的生命活动,二者之间相互作用、紧密相连。
关于在不同光照强度和温度下藻类物质积累的变化,国内外尚无相应的研究。本研究中发现,碳元素的积累在各光照强度、温度及其交互作用下都没有显著不同。巨藻幼孢子体碳的来源主要是空气中的二氧化碳,这说明本实验中设置的光照强度和温度条件没有改变碳在幼孢子体中的比重,使得幼孢子体在可以进行正常的各项生理活动后,剩余的碳有可能被储存起来。氮元素的积累受光照、温度的影响明显,光照强度增加,氮元素减少,这与蛋白质含量和叶绿素含量的变化是基本对应的;温度升高,氮元素也减少,这与蛋白质含量和叶绿素含量的变化是相反的,巨藻幼孢子体的氮主要来源于营养盐的添加。本研究中发现,温度过高的时(15、20℃),藻体尖部出现白化现象,这也有可能能解释蛋白质含量与氮元素含量相反现象的原因,温度升高造成幼孢子氮的流失,而剩余的氮元素则被用来形成应急高温的酶等。光照强度与温度二者的交互作用对其影响不显著。
综上所述,光照和温度的交互作用对巨藻幼孢子体的生长及生化组成有显著影响,对物质积累没有显著影响。总体来说,在温度为15℃光照强度为100μmol/(m2·s)时能获得较大的生长率和较高的蛋白质含量,但目前研究资料有限,今后还应针对巨藻幼孢子体的生长、物质积累和繁殖生物学等方面进行更细致的研究。
参考文献:
[1]Almanaza Vviana, Buschmann Alejandro H, Hernardez-Gonzalez Maria C, et al. Can giant kelp (Macrocystispyrifera) forests enhance invertebrate recruitment in southern Chile?[J]. Marine Biology Research, 2012, 8: 855-864.
[2]刘恬敬, 索如瑛. 俚岛湾巨藻越夏实验[J]. 海洋水产研究, 1984, 6: 15.
Liu Tianjing, Suo Ruying. Lidao BayMacrocystispyriferasummering experiment[J]. Marine Fisheries Research, 1984, 6: 15.
[3]白木, 周洁. 植物能——巨藻[J]. 研究与信息, 2002, 18: 58.
Bai Mu, Zhou Jie. Plants can——Macrocystispyrifera[J]. Research and Information, 2002, 18: 58.
[4]Graham M H, Va′squez J, Buschmann A H. Global ecology of the giant kelp Macrocystis: From ecotypes to ecosystems [J]. Oceanography and Marine Biology, Annual Reviews , 2007, 45: 39-88.
[5]Va′squez J A, Castilla J C, Santelices B. Distributional patterns and diets of four species of se urchins in giant kelp forest (Macrocystis pyrifera) of Puerto Toro, Navarino Island, Chile [J]. Marine Ecology Progress Series, 1984(19): 55-63.
[6]Dayton P K. Ecology of kelp communities [J]. Annual Review of Ecology and Systematic, 1985, 16: 215-245.
[7]Graham M H. Effects of local deforestation on the diversity and structure of southern California giant kelp forest food webs[J]. Ecosystems, 2004, 7: 341-357.
[8]Va′squez J A. Production, use and fate of Chilean brown seaweeds: Resources for a sustainable fishery [J]. Journal of Applied Phycology, 2008, 18: 505-519.
[9]Jackson J A, Winant C D. Effect of a kelp forest on coastal currents [J]. Continental Shelf Research, 1983, 2: 75-80.
[10]Duggins D O, Eckman J E, Sewell A T. Ecology of understory kelp environments. II. Effects of kelps on recruitment of benthic invertebrates[J]. Journal of Experimental Marine Biology and Ecology, 1990: 143, 27-45.
[11]Jackson G A. Currents in the high drag environment of a coastal kelp stand off California[J]. Continental Shelf Research, 1998, 17(19): 13-28.
[12]Viana T, López L, Salas A . Diet development for juvenile abalone Haliotis fulgens[J]. Aquaculture, 1993, 117: 149-156.
[13]Corazani D, Illanes J . Growth of juvenile abalone, Haliotis discus hannai Ino 1953 and Haliotis rufescens Swaison 1822, fed with different diets[J]. Journal of shellfish Research, 1998, 17: 663-666.
[14]Camus P . Introducción de especies en ambientes marinos Chilenos: no sólo exóticas, no siempre evidentes[J]. Revista Chilena de Historia Natural, 2005, 78: 155-159.
[15]Cruz-Suarez L E, Tapia-Salazar M, Nieto-Lopez M G, et al. Comparison of Ulva clathrata and the kelps Macrocystis pyrifera and Ascophyllum nodosum as ingredients in shrimp feeds[J]. Aquaculture Nutrition, 2009, 15: 421-430.
[16]梁玉波, 王斌. 中国外来海洋生物及其影响[J]. 生物多样性, 2001, 9(4): 458-465.
Liang Yubo, Wang Bin. Alien Marine species and their impacts in China[J]. Biodiversity Science, 2001, 9(4): 458-465.
[17]LI De-mao, WANG Guang-ce. The effects of light intensity and temperature on photosynthetic oxygen evolution of the female and male gametophytes of Macrocystis pyrif era[J]. Marine Sciences, 2005, 12(29): 51-54.
[18]陈熙. 海藻生物液肥应用前景广阔——张树清谈全自动连续酶解法生产海藻生物液肥[N]. 中国农资, 2014, 27: 21.
Chen Xi. Algae biological liquid fertilizer application prospects - Zhang Shuqing talk automatic continuous enzymatic production of algae biological liquid fertilizer[N]. Chinese agricultural, 2014, 27: 21.
[19]曹爱青. 海藻的营养价值及其在动物饲料生产上应用的研究[J]. 饲料广角, 2014, 22(14): 42.
Cao Ai qing. nutritional value of algae in animal feed production applications[J]. FEED MATERIAL RESOURCE, 2014, 22(14): 42.
[20]凌晶宇, 梁洲瑞, 孙修涛, 等. 巨藻幼苗光合作用、呼吸作用的初步研究[J]. 水产学报, 2014, 38(6): 820-828.
Ling Jingyu, Liang Zhourui, Sun Xiutao, et al. Primary investigations on the photosynthesis and respiration ofMacrocystispyrifera[J]Journal of Fisheries of China, 2014, 38(6): 820-828.
[21]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principles of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[22]Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algea, and natural phytoplankton[J]. Biochem Physiol Pflanz BPP, 1975, 167: 191-194.
[23]张媛媛, 贺行良, 孙书文, 等. 元素分析仪-同位素比值质谱仪测定海洋沉积物有机碳稳定同位素方法初探[J]. 盐矿测试, 2012, 31(4): 216-231.
Zhang Yuanyuan, He Xingliang, Sun Shuwen, et al. A Priliminary Study On The Detemination Of Organic Carbon Stable Isotope of Marine Sediment By Element Analyzer-Isotope Ratio Mass Spectrometer[J]. Rock and mineral analysis. 2012, 31(4): 216-231.
[24]王黎明, 夏文水. 蒽酮- 硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7): 185-188.
Wang Liming, Xia Wenshui. Determination of TPS by iprovement of anthrone-sulfuric Acid method[J]Food Science, 2005, 26(7): 185-188.
[25]包杰, 田相利, 董双林, 等. 温度、盐度和光照强度对鼠尾藻氮、磷吸收的影响[J]. 中国水产科学, 2008, 15(2): 293-300.
Bao Jie, Tian Xiangli etc. Effect of temperature, salinity and light intensity on Sargassum nitrogen, phosphorus uptake[J]. Journal of Fishery Sciences of China, 2008, 15(2): 293-300.
[26]徐智广, 李美真, 孙福新, 等. 温度、光强和营养史对羊栖菜无机磷吸收的影响[J]. 南方水产科学, 2013, 9(3): 8-13.
Xu Guangzhi, Li Meizhen, Sun Fuxin, et al. Effects of temperature, irradiance level and nutritional history on the uptake of inorganic phosphorus inHizikiafosiforme[J]South China Fisheries Sciebce, 2013, 9(3): 8-13.
[27]刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响[J]. 青岛海洋大学学报, 2001, 31(3): 332-338.
Liu Jingwen, Dong Shuanglin. Interactions Between Light and Temperature n the Growth and Levels of Chemical Constituents ofGracilariatenuistipitatavar.Liui[J]. Journal of Ocean University of Qingdao, 2001, 31(3): 332-338.
[28]曾艳艺, 黄翔鹄. 温度、光照对小环藻生长和叶绿素a含量的影响[J]. 广东海洋大学学报, 2007, 6(27): 36-40.
Zeng Yanyi, Huang Xianghu. Effect of temperature and illumination on growth and chlorophyaa-a ofcyclotellasp. [J]Journal of Guangdong Ocean University, 2007, 6(27): 36-40.
[29]刘青, 张晓芳, 李太武, 等. 光照对4种单胞藻生长速率、叶绿素含量及细胞周期的影响[J]. 大连水产学院学报, 2006, 21(1): 24-30.
Liu Qing, Zhang Xiaofang, Li Taiwu, et al. Effects of light on growth rate, chlorophyll level and cell cycle in four alga species[J]. Journal of Dalian fisheries university, 2006, 21(1): 24-30.
[30]陆开形, 蒋霞敏, 翟兴文. 光照对雨生红球藻生长的影响[J]. 河北渔业, 2002, 6: 6-10.
Lu Kaixing, Jiang Xiamin, Zhai xingwen. Effect of Light on pluvialis algae growth[J]Hebei Fisheries, 2002, 6: 6-10.
[31]刘春光, 金相灿, 邱金泉, 等. 光照与磷的交互作用对两种淡水藻类生长的影响[J]. 中国环境科学, 2005, 25(1): 32-36.
Liu Chunguang, Jin Xiangcan, Qiu Jinquan, et al. Influence of interactin of light and phosphorus on growth of two species of algae in fresh waters[J]. China Enviromental Science, 2005, 25(1): 32-36.
[32]Sukenik A. Light saturated photosynthesis limitation by electron transport or carbon fixation [J]. Biochim Biophys Acta, 1987, 891: 205-215.
[33]Berner T. Photo adaptation and the “package” effect inDunaliellatertiolecta(Chlorophyceae) [J]. Phycology, 1989, 25: 70-78.
[34]王巧晗, 董双林, 田相利, 等. 光照强度对孔石莼生长和藻体化学组成的影响[J]. 海洋科学, 2010, 8(34): 76-80.
Wang Qiaohan, Dong Shuanglin, Tian Xiangli, et al. The effects of light intensity on the growth and chemical constituents ofUlvapertusa[J]. Marine Science, 2010, 8(34): 76-80.
[35]林贞贤, 宫相忠, 李大鹏, 等. 光照和营养盐胁迫对龙须菜生长及生化组成的影响[J]. 海洋科学, 2007, 31(11): 22-26.
Lin Zhenxian, Gong Xiangzhong, Li Dapeng, et al. Effects of light and the stress of nutrients deficiency on the rowth and levels of chemical constituents ofGracilariaemaneiformis[J]. . Marine Science, 2007, 31(11): 22-26.
[36]Zhourui Liang, Xiutao Sun, Feijiu Wang, et al. Impact of Environmental Factors on the Photosynthesis and Respiration of Young Seedlings ofSargassumthunbergii(Sargassaceae, Phaeophyta) [J]. American Journal of Plant Sciences, 2013, 4: 27-33.
[37]DukeC S, Litaker W, Ramus J.Effect of temperature, N supply and tissue N on ammonium uptake rates of Ulva curuata and Codium decorticatum[J]. Journal of Applied Phycology, 1989, 25: 1l3-120.
责任编辑朱宝象
Effects of Light and Temperature on Growth and Biochemical Composition of A Marine Macroalga (Macrocystispyrifera) Young Sporophyte
LU Wei-Wei, WANG Qiao-Han , GONG Qing-Li
(College of Fisheries, Ocean University of China, Qingdao 26603, China)
Abstract:In China, Macrocystis pyrifera was an introduced macroalgae, It has great significance to set the appropriate light intensity and temperature in cultivation. This paper studied the effects of different light intensity and temperature conditions on specific growth rate, protein content, chlorophyll content dry-material accumulation and Carbohydrates of marine macroalgae (Macrocystis pyrifera). Experiments were set four light intensity treatments (50, 100, 150, 200 μmol/(m2 ·s)) and four temperature treatments (5, 10, 15, 20℃), different light intensities and temperatures combined with each other. The measuring methods of growth, protein, Chlorophyll , dry-material accumulation and Carbohydrates were Growth rate formula , coomassie brilliant blue method, Acetone extraction method , Elemental analyzer and Anthrone - Concentrated sulfuric acid method . Experimental results showed that when the light intensity was constant, as the temperature increased, the specific growth rate rose first and then decreased, reaching the maximum at 15℃; Protein content increased gradually, reaching the maximum at 20℃; Chlorophyll a, c content rose first and then decreased, in addition to 150 μmol/(m2·s) group, all light control groups reached the maximum at 15℃; Carbon content increased first and then decreased , reaching the maximum at 10 or 15℃; Nitrogen content had a gradually decreasing trend. In a certain temperature, when light intensity increased, the specific growth rate rose first and then decreased, reaching the maximum at 100 μmol/(m2·s); Protein content rose first and then decreased, all tempreture groups reached the maximum value at 100 μmol/(m2·s); Chlorophyll a, c content showed different trends in different temperature groups , there was no change of the law ;Nitrogen content in the light 50-150 μmol/(m2·s) showed a decreasing trend, increased in 200 μmol/(m2·s) and reached the maximum value. Light intensity, temperature and composition of their interaction have a significant impact on the growth and biochemical of Macrocystis pyrifera, but no significant effect on dry-matter accumulation. This study provides a scientific basis for setting up a new farming conditions in scale industry to farm introduced macroalgae algae species .
Key words:light intensity; temperature; macroalgae young sporophyte; special growth rate; biochemical composition; matter accumulation
中图法分类号:S917.3
文献标志码:A
文章编号:1672-5174(2016)01-040-09
作者简介:芦薇薇(1989-),女,硕士生,研究方向:养殖生态学。E-mail:355318352@qq.com
收稿日期:2014-12-25;
修订日期:2015-04-01
*基金项目:2014青岛世界园艺博览会植物馆海洋展陈资助
DOI:10.16441/j.cnki.hdxb.20140436
引用格式:芦薇薇, 王巧晗, 宫庆礼.光照强度和温度对巨藻幼孢子体的生长和生化组成的影响[J]. 中国海洋大学学报(自然科学版), 2016,46(1): 40-48.
LU Wei-Wei, WANG Qiao-Han , GONG Qing-Li. An integrative evaluation of ecological effect of artificial reefs with entropy-weighted fuzzy matter-element method[J]. Periodical of Ocean University of China, 2016, 46(1): 40-48.
Supported by 2014 Qingdao International Horticultural Exposition showcasing
**通讯作者: E-mail: wangqiaohan@ouc.edu.cn
