淫羊藿女贞子影响激素干预哮喘大鼠淋巴细胞凋亡的作用
2016-04-06年宏蕾刘仁慧肖般若罗良涛许利平王秀娟首都医科大学首都医科大学中医药学院中医络病研究北京市重点实验室北京100069
年宏蕾 刘仁慧 肖般若 惠 娅 杨 燕 罗良涛 许利平 王秀娟(首都医科大学首都医科大学中医药学院中医络病研究北京市重点实验室,北京,100069)
淫羊藿女贞子影响激素干预哮喘大鼠淋巴细胞凋亡的作用
年宏蕾 刘仁慧 肖般若 惠 娅 杨 燕 罗良涛 许利平 王秀娟
(首都医科大学首都医科大学中医药学院中医络病研究北京市重点实验室,北京,100069)
摘要目的:研究大鼠哮喘模型激素局部及全身给药治疗的同时合用淫羊藿女贞子对淋巴细胞凋亡的影响。方法:建立大鼠哮喘模型,分别以布地奈德雾化4周(局部给药)及地塞米松腹腔注射治疗2周(全身给药)治疗,同时配合灌胃淫羊藿女贞子煎液,流式细胞术检测支气管肺泡灌洗液(BALF)与血淋巴细胞凋亡的表达。结果:与正常组相比,哮喘大鼠BALF中淋巴细胞凋亡显著降低(P<0. 05);激素局部干预及合用中药淫羊藿女贞子均可上调BALF中淋巴细胞凋亡水平(P<0. 01),且合用组上调作用较单用组显著升高(P<0. 01);而激素全身干预大鼠血及BALF中淋巴细胞凋亡表达均显著上调(P<0. 05),但合用淫羊藿女贞子后则下调血淋巴细胞凋亡水平接近于正常(P<0. 05)。结论:激素局部给药的同时合用平补阴阳药对淫羊藿女贞子,产生协同上调血及BALF淋巴细胞凋亡的作用;而激素全身给药的同时合用平补阴阳药对淫羊藿女贞子,则抑制激素全身应用后过度促进血淋巴细胞凋亡的影响。
关键词哮喘;淫羊藿/女贞子;糖皮质激素;淋巴细胞凋亡;大鼠
Effects of the Combination of Herba Epimedii and Fructus Ligustri Lucidi on Lymphocyte Apoptosis in the Asthmatic Rats with Glucocorticoid Intervention
Nian Honglei,Liu Renhui,Xiao Banruo,Hui Ya,Yang Yan,Luo Liangtao,Xu Liping,Wang Xiujuan
(School of Traditional Chinese Medicine,Capital Medical University and Beijing Key Laboratory of Traditional Chinese Medicine Collateral Disease Theory Research,Beijing 100069,China)
Abstract Objective:To investigate the effects of the combination of Herba Epimedii and Fructus Ligustri Lucidi on lymphocyte apoptosis in the asthmatic rats with glucocorticoid intervention. Methods:Asthmatic model was duplicated and the lymphocyte apoptosis in the blood and BALF was observed by flow cytometry with the oral administration of the combination of Herba Epimedii and Fructus Ligustri Lucidi accompanied by the injection of dexamethasone for two weeks(systemic administration)and the atomization inhalation of Budesonide for four weeks(local administration). Results:Compared with the normal group,apoptosis of lymphocytes in BALF of the asthmatic rats decreased significantly(P<0. 05). Both the Budesonide group and the combination group of Budesonide,Herba Epimedii and Fructus Ligustri Lucidi could increase the lymphocyte apoptosis of BALF(P<0. 01). The lymphocyte apoptosis of the blood and BALF in the dexamethasone group was significantly increased(P<0. 05),while reduced in the combination group of dexamethasone,Herba Epimedii and Fructus Ligustri Lucidi(P<0. 05). Conclusion:The local administration of glucocorticoid combined with Herba Epimedii and Fructus Ligustri Lucidi could produce a synergistic upregulation effect on lymphocyte apoptosis,while the systemic administration of glucocorticoid combined Herba Epimedii and Fructus Ligustri Lucidi could inhibit the over-expression of lymphocyte apoptosis.
Key Words Asthma;Herba Epimedii/Fructus Ligustri Lucidi;Glucocorticoid;Lymphocyte apoptosis;Rat
支气管哮喘是由多种细胞(如嗜酸粒细胞、肥大细胞、淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎性疾病,糖皮质激素(Glucocorticoids,GC)以其强大的抗炎作用而被认为是目前防治哮喘的首选药物,但临床上使用GC也存在着许多问题:如免疫抑制、激素抵抗、激素依赖以及局部和全身性副作用[1-2]。结合传统中医药理论用中医药预防及治疗哮喘是我国的独特优势,尤其是通过中医药有别于西医的对全身整体的调节作用,即神经-内分泌-免疫功能的调节,能够协同GC治疗哮喘并可有效改善GC治疗过程中所产生的不良反应。课题组前期研究发现[3-4],大鼠激素全身干预哮喘模型在地塞米松应用的不同阶段(激素撤停前、中、后)的同时,分别合用淫羊藿女贞子,可产生协同激素抗炎并有效减轻激素的不良反应的作用。淋巴细胞是GC发挥抗炎作用及导致免疫抑制反应的主要效应细胞之一,文献报道大剂量GC可通过糖皮质激素受体(Glucocorticoid Receptor,GR)诱导淋巴细胞的大量凋亡[5]。本研究采用激素全身给药与局部两种给药模式,观察药物对血与BALF不同水平的淋巴细胞凋亡的影响,探讨中药淫羊藿女贞子协同激素治疗哮喘及改善激素不良反应的可能作用机制。
1 材料与方法
1. 1 实验动物 健康SPF级SD大鼠,体重(120± 10)g,雄性,提供公司:北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京)2012-0001。
1. 2 实验仪器 雾化箱(自制,材料:有机玻璃,规格:40 cm×30 cm×20 cm),402A超声雾化器(江苏鱼跃医疗设备有限公司),流式细胞仪FACS Calibur(美国BD公司)。
1. 3 试剂与药品 卵清白蛋白(OVA,美国Sigma公司,A5253-250 g)、氢氧化铝(北京化工厂,批号:20120028);淫羊藿水提物(批号:20130115)、女贞子水提物(批号:20130104)均由西安康威生物有限公司提供;地塞米松磷酸钠注射液(5 mg/支,国药集团容生制药有限公司,批号:H41020036);吸入用布地奈德混悬液(AstraZeneca Pty Ltd,批号:317311);大鼠外周血淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司,批号:LTS1083-200);一步法TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:C1088);Mebstain Apoptosis Tunel Kit(MBL,Code No:8445)。
1. 4 分组 1)激素局部给药实验:按照随机数字表法将SD大鼠分为5组,每组7只,即正常对照1组(N1组)、哮喘模型1组(A1组)、激素干预1组(GC1组),淫羊藿女贞子1组(YN1组),淫羊藿女贞子合激素干预1组(YN+GC1组)。2)激素全身给药实验:按照随机数字表法将SD大鼠分为5组,每组6只,即正常对照2组(N2组)、哮喘模型2组(A2组)、激素干预2组(GC2组),淫羊藿女贞子2组(YN2组),淫羊藿女贞子合激素干预2组(YN+GC2组)。
1. 5 造模及给药方法 参考文献方法[6]于实验1 ~35 d,除正常对照1、2组外,剩余组动物全部造模。1)激素局部给药实验:36 d开始给药共计4周,各造模组均每周2次给予1%OVA雾化吸入,GC1组、YN+GC1组雾化吸入0. 01%布地奈德20 min,YN1组、YN+GC1组灌胃淫羊藿女贞子水提物(4∶3配比,3. 5 g/kg体质量)。2)激素全身给药实验:22 d开始给药共计2周,GC2组及YN+GC2组腹腔注射地塞米松注射液(0. 5 g/kg体质量),YN2组及YN+GC2组灌胃给予淫羊藿女贞子水提物(4∶3配比,3. 5 g/kg体质量)。
1. 6 取材及指标检测 分别于实验64 d、36 d后处死动物,腹主动脉取血抗凝,参考试剂盒说明书分离血淋巴细胞;迅速开胸,取出肺组织连同气管,结扎左主支气管,右肺行支气管肺泡灌洗术[7],收集支气管肺泡灌洗液(Branchoalveolar Lavage Fluids,BALF)混合均匀,离心,分离BALF中单个核细胞。按照试剂盒说明书操作,以流式细胞术检测血淋巴细胞及BALF中淋巴细胞凋亡的表达(TUNEL法)。
1. 7 统计学方法 所有统计均采用SPSS 16. 0 for Windows软件包完成。数据采用(±s)表示,组间比较采用方差齐性检验以及单因素方差分析,根据方差齐性检验结果选择LSD(方差齐)或Tamhane's T2(方差不齐),相关分析采用Pearson相关法。
2 实验结果
2. 1 激素局部干预大鼠血及BALF淋巴细胞凋亡的比较 与正常对照组相比,哮喘模型组大鼠BALF中淋巴细胞凋亡显著降低(P<0. 05),血淋巴细胞凋亡水平无明显改变;与模型组相比,各给药组均可上调BALF细胞凋亡(P<0. 01);与激素组相比,淫羊藿女贞子合用激素组血及BALF中淋巴细胞凋亡水平均明显上调(P<0. 05或0. 01),提示激素局部给药的同时合用淫羊藿女贞子,产生协同上调血及BALF淋巴细胞凋亡的影响作用。见表1。
表1 激素局部干预大鼠血及BALF淋巴细胞凋亡的比较(平均荧光强度,±s)
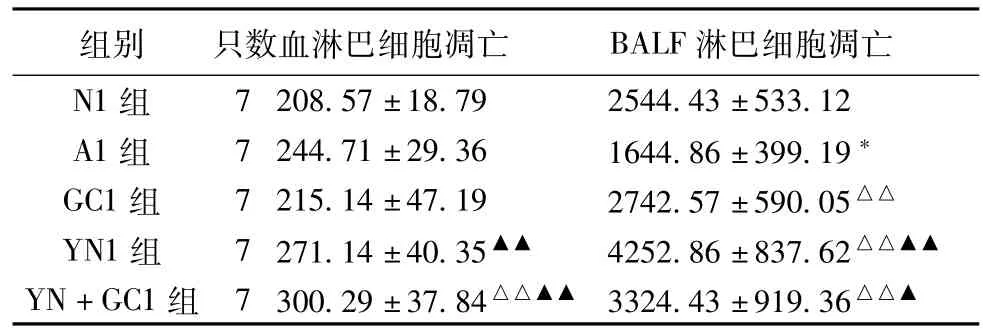
表1 激素局部干预大鼠血及BALF淋巴细胞凋亡的比较(平均荧光强度,±s)
注:与N1组比较,*P<0. 05;与A1组比较,△△P<0. 01;与GC1组比较,▲P<0. 05,▲▲P<0. 01。
组别 只数血淋巴细胞凋亡 BALF 淋巴细胞凋亡N1组7 208. 57±18. 79 2544. 43±533. 12 A1组 7 244. 71±29. 36 1644. 86±399. 19*GC1组 7 215. 14±47. 19 2742. 57±590. 05△△YN1组 7 271. 14±40. 35▲▲ 4252. 86±837. 62△△▲▲YN+GC1组 7 300. 29±37. 84△△▲▲ 3324. 43±919. 36△△▲
2. 2 激素全身干预大鼠血及BALF中淋巴细胞凋亡的比较 与正常对照组相比,哮喘模型组大鼠BALF中淋巴细胞凋亡显著降低(P<0. 05);与模型组比较,激素干预组大鼠血及BALF中淋巴细胞凋亡表达均显著上调(P<0. 05或0. 01);与激素组比较,淫羊藿女贞子合激素干预组血淋巴细胞凋亡显著降低(P<0. 05),并接近正常水平。见表2。
表2 激素全身干预大鼠血及BALF中淋巴细胞凋亡的比较(平均荧光强度,±s)

表2 激素全身干预大鼠血及BALF中淋巴细胞凋亡的比较(平均荧光强度,±s)
注:与N2组比较,*P<0. 05;与A2组比较,△P<0. 05,△△P<0. 01;与GC2组比较,▲P<0. 05,▲▲P<0. 01。
组别 只数 血淋巴细胞凋亡 BALF 6 991. 00±414. 40 2951. 17±427. 99 A2组 6 934. 67±359. 78 2315. 50±338. 86*GC2组 6 1441. 00±490. 12△ 3569. 67±461. 086*△△YN2组 6 814. 67±209. 15▲ 2374. 00±491. 84▲▲YN+GC2组 6 1005. 67±427. 81▲ 3158. 17±612. 14淋巴细胞凋亡N2组△△
2. 3 血与BALF中淋巴细胞凋亡的相关分析 激素局部给药实验中,血及BALF淋巴细胞凋亡无相关;激素全身给药实验中,血及BALF中淋巴细胞凋亡水平呈显著正相关(r=0. 587,P<0. 01)。见表3。

表3 血与BALF中淋巴细胞凋亡的相关分析(r值,n=30)
3 讨论
哮喘是由多种细胞特别是肥大细胞、嗜酸性粒细胞、中性粒细胞和T淋巴细胞等炎性反应细胞参与的慢性气道炎性反应。慢性气道炎性反应、气道高反应性及气道重塑是该病的三大重要特征[8-9]。其发病率、致残率高并呈逐年上升的趋势,已成为危害人类健康的全球性公共卫生问题[10]。细胞凋亡失衡与自身免疫性疾病等发病密切相关,尤其是在哮喘发病过程中,炎性反应细胞的凋亡机制日益受到重视[11]。在支气管哮喘慢性炎性反应的发生发展过程中,多种的炎性细胞以及炎性细胞因子在气道局部形成复杂的调控网络,而淋巴细胞在哮喘炎性反应过程中发挥着极为重要的免疫调节作用,直接影响着气道炎性反应及气道高反应性的发生[12-15]。
大量研究表明,淋巴细胞凋亡减少是哮喘发病发展过程中的一个重要环节,是机体免疫系统紊乱、哮喘发生和加重的一个极其重要的原因[16-17]。GC治疗哮喘的药理作用与其促进淋巴细胞凋亡相关[18-19],但若过度促进淋巴细胞凋亡则导致抑制免疫的不良反应[20]。本研究结果表明:与正常对照组比较,哮喘模型大鼠BALF中淋巴细胞凋亡显著降低(P<0. 05),提示气道局部的淋巴细胞凋亡抑制在哮喘气道炎性反应的发生以及发展过程中具有着重要意义。激素全身及局部2种给药途径均能显著上调BALF中淋巴细胞凋亡细胞水平(P<0. 01),而激素全身用药同时上调血淋巴细胞凋亡水平(P<0. 05),这与糖皮质激素抑制淋巴细胞免疫功能的药理作用一致,说明GC能够促进哮喘大鼠气道局部淋巴细胞的凋亡,由此减轻哮喘的气道炎性反应的发生发展,提示促进淋巴细胞凋亡是GC治疗哮喘的一个重要作用机制。但全身用药对血淋巴细胞凋亡的过度促进也可能与GC免疫功能抑制的不良反应有关。激素局部用药的同时合用平补阴阳药对中药淫羊藿女贞子,可上调血及BALF中淋巴细胞凋亡水平(P<0. 05或0. 01),对淋巴细胞凋亡产生协同增效作用;但激素全身用药的同时合用中药淫羊藿女贞子,则显著抑制血淋巴细胞凋亡(P<0. 05),使其接近于正常水平,提示平补阴阳药对淫羊藿女贞子可能抑制激素全身应用后过度促进血淋巴细胞凋亡的影响,从而减轻激素的不良反应。
参考文献
[1]刘琳,刘志红.糖皮质激素作用机制的研究进展[J].肾脏病与透析肾移植杂志,2014,23(5):472-476.
[2]叶涛,詹珊珊.吸入糖皮质激素治疗支气管哮喘的不良反应[J].医学综述,2012,18(10):1511-1514.
[3]刘仁慧,王秀娟,袁颖,等.淫羊藿、女贞子对激素干预哮喘大鼠骨代谢的影响[J].吉林中医药杂志,2012,32(5):490-492.
[4]刘仁慧,许利平,王秀娟,等.淫羊藿女贞子合用地塞米松抗哮喘大鼠的研究[J].中国中药杂志,2012,37(10):1497-1499.
[5]Fukuzuka K,Edwards C,Clare-Salzler M,et al. Glucocorticoid-induced,caspase-dependent organ apoptosis early after burn injury[J]. Am J Physiol Regul Integr Comp Physiol,2000,278(4):1005-1018.
[6]刘仁慧,郑君芳,袁颖,等.淫羊藿女贞子配伍调节哮喘大鼠NO/ET及HPA轴作用的研究[J].中国中药杂志,2010,35(12):1590-1593.
[7]刘仁慧,王秀娟,许利平,等.培本方对哮喘模型大鼠的药效学研究[J].中成药,2010,32(5):741-744.
[8]Behndig AF,Larsson N,Brown JL,et al. Proinflammatory doses of diesel exhaust in healthy subjects fail to elicit equivalent or augmented airway inflammation in subjects with asthma[J]. Thorax,2011,66 (1):12-19.
[9]殷凯生,金淑贤,卞涛,等.咪喹莫特治疗支气管哮喘作用机制的实验研究[J].中华结核和呼吸杂志,2007,30(7):509-517.
[10]吴寒,史锁芳.激素依赖性哮喘中医药防治研究进展[J].江西中医药,2006,37(10):59-60.
[11]彭文科,史菲,邓春艳,等.布地奈德对哮喘小鼠淋巴细胞凋亡和stat5b/BclL信号通路的影响[J].广东医学,2011,32(12):1530-1532.
[12]王静.铝致大鼠淋巴细胞凋亡的cAMP/PKA信号传导机制[D].哈尔滨:东北农业大学,2014.
[13]Haczk u A. T cells and eosinophils in asthma[J]. Acta Microbiol Immunol Hung,1998,45(1):19.
[14]蔡靓.组蛋白在脓毒症过程中对淋巴细胞的凋亡作用及机制[D].广州:南方医科大学,2014.
[15]Potapinska O,Demkow U. T lymphocyte apoptosis in asthma[J]. Eur J Med Res,2009,14(4):192-195.
[16]胡艳妮.靶向抑制GSK-3β介导的Wnt与NF-κB信号通路在急性淋巴细胞白血病细胞凋亡中的机制研究[D].重庆:重庆医科大学,2011.
[17]吴力专.金属硫蛋白对热应激奶牛淋巴细胞凋亡的影响及信号转导机理[D].长沙:湖南农业大学,2013.
[18]卓宋明,徐文莉,梁珊瑚,等.慢性阻塞性肺疾病患者T淋巴细胞亚群凋亡与Fas、FasL、Bcl-2表达的关系[J].中华临床医师杂志:电子版,2011(6):1554-1560.
[19]Spinozzi,De Benedictis D,De Benedictis F M. Apoptosis,airway inflammation and anti-asthma therapy:from immunobiology to clinical application[J]. Pediatr Allergy Immunol,2008,19(4):287-295.
[20]Herold M J,Mcpherson K G,Reichardt H M. Glucocorticoids in T cell apoptosis and function[J]. Cell Mol Life Sci,2006,63(1):60-72.
(2015 -07 -20收稿 责任编辑:张文婷)
中图分类号:R285. 5
文献标识码:A
doi:10. 3969/j. issn. 1673 -7202. 2016. 03. 030
通信作者:刘仁慧(1974. 07—),女,医学博士,副教授,硕士研究生导师,研究方向:中药及复方的药效及作用机制,E-mail:liurenhui995@163. com
基金项目:国家自然科学基金资助项目(编号:81373814);北京市属高等学校高层次人才引进与培养计划项目(编号:CIT&TCD201504097);北京中医药薪火传承“3+3”工程二室一站建设项目(编号:2012-SZ-C-42)
