益气除痰方降低肺癌Caspase 6、Lam in B1表达诱导细胞凋亡的机制
2016-04-06王淑美杨洋博君刘启欧重庆医科大学中医药学院重庆400016重庆医科大学中医药研究室重庆400016
李 舒, 王淑美*, 杨洋博君, 刘启欧(1.重庆医科大学中医药学院,重庆400016;2.重庆医科大学中医药研究室,重庆400016)
益气除痰方降低肺癌Caspase 6、Lam in B1表达诱导细胞凋亡的机制
李 舒1,2, 王淑美1,2*, 杨洋博君1,2, 刘启欧1,2
(1.重庆医科大学中医药学院,重庆400016;2.重庆医科大学中医药研究室,重庆400016)
摘要:目的 研究益气除痰方对肺癌A549裸鼠移植瘤天冬氨酸特异性半胱氨酸蛋白酶6(Caspase 6)及核纤层蛋白B1(Lamin B1)表达的影响。方法 选用BALB/c裸小鼠40只,将肺癌A549细胞悬液接种于小鼠背侧皮下建立肺癌模型,接种第7天将小鼠随机分为5组,即模型组(生理盐水组),顺铂注射液组(0.002 g/kg),益气除痰方低、高剂量组(3.0、6.0 g/kg),联合用药组(3.0 g/kg益气除痰方+0.002 g/kg顺铂),每组8只。中药灌胃,每天1次,连用21 d;顺铂注射液腹腔注射,每天1次,连用7 d。干预第22天,处死所有小鼠,测量瘤体质量、体积,并采用免疫组化及IT-PCI法检测肿瘤组织中Caspase 6、Lamin B1的表达。结果 益气除痰方高剂量组和联合用药组肿瘤体积、肿瘤质量明显下降,免疫组织化学法及IT-PCI法检测结果显示,肿瘤组织中Caspase 6、Lamin B1的表达均降低,与模型组比较,差异有显著性(P<0.01);联合用药组与顺铂注射液组比较,差异有显著性(P<0.05)。结论 益气除痰方可抑制小鼠A549肺癌,与化疗药物联用有一定的增效作用,其机制可能与通过降低Caspase 6、Lamin B1的表达诱导细胞凋亡有关。
关键词:益气除痰方;肺癌;Caspase 6;Lamin B1;细胞凋亡
肺癌的肿瘤细胞源于支气管黏膜或腺体,常有区域性淋巴结转移和血液播散,患者诊断时多已至晚期,采用包括扶正抗癌的中药在内的综合治疗具有较好疗效。中药“益气除痰方”是国家级重点专科广州中医药大学附一院肿瘤科临床常用的治疗肺癌的基本方,以益气除痰、解毒散结为治疗原则,本方长期针对中晚期脾虚痰湿证肺癌患者运用于临床,具有显著的疗效。本实验研究益气除痰方对肺癌移植瘤组织中Caspase 6、Lamin B1表达的影响,从半胱氨酸蛋白酶家族引发的级联反应介导细胞凋亡途径探讨其抗癌机制[1]。
1 材料与方法
1.1 材料 BALB/c裸小鼠40只,雌雄各半,鼠龄4~5周,体质量16~18 g,独立通风笼系统(IVC),购于重庆医科大学实验动物中心,合格证号SCXK(渝)2012-0002。人肺癌细胞株A549由第三军医科大学大坪医院肿瘤实验室赠予。1640培养基、胎牛血清、胰酶购于美国HyC1one公司。顺铂注射液购于齐鲁制药(海南)有限公司,批号H20073652。Caspase 6、Lamin B1抗体购于北京博奥森生物技术有限公司,编号分别为bs-0084I、bs-1840I。SP免疫组化试剂盒为北京康为世纪生物科技有限公司产品,编号为CW2053。PCI所用试剂焦碳酸二乙酯(DEPC)为瑞士罗氏公司产品;TINzo1、PCI Mix Taq、溴乙锭为天根生化科技(北京)有限公司产品;冰醋酸为重庆北碚精细化工厂产品;Tris碱为北京鼎国公司产品;水乙醇为重庆川东化工(集团)有限公司产品;氯仿、异丙醇为成都市科龙化工试剂厂产品;Iever Tre Ace-a-逆转录试剂盒为日本Toyobo公司产品;琼脂糖为日本Takara公司产品。实验选用的中药,均根据《中国药典》2000年版(一部)收录品种,购自广州中医药大学第一临床学院。按临床“益气除痰方”组成比例(人参15 g、白术15 g、茯苓15 g、枳壳15 g、生半夏15 g、葶苈子15 g)称量并粉碎,水煎2次,浓缩分装,终质量浓度为2.0 g/mL生药,4℃保存,1个月内使用。
1.2 造模、分组、给药 全部小鼠背侧皮下各接种1×107个肺癌A549细胞,当皮下肿瘤生长至可明显扪及时(接种第7天),将小鼠随机分为模型组(生理盐水0.2 mL),顺铂注射液组(0.002 g/kg),益气除痰方低、高剂量组(3.0、6.0 g/kg),联合用药组(3.0 g/kg益气除痰方+0.002 g/kg顺铂),每组8只。接种第7天,益气除痰方低、高剂量组和联合用药组予中药灌胃,每天1次,连用21 d。接种第21天,顺铂注射液组及联合用药组予顺铂注射液腹腔注射,每只0.2 mL,每天1次,连用7 d。接种第28天,1%戊巴比妥钠腹腔麻醉,取出小鼠背侧皮下的肺癌包块,部分置于冻存管中放于超低温冰箱保存,部分用10%多聚甲醛溶液固定。采用免疫组织化学法和IT-PCI法检测肿瘤中Caspase 6、Lamin B1的表达。
1.3 检测指标与方法
1.3.1 肿瘤生长抑制率 所有小鼠在干预完成后,经1%戊巴比妥钠腹腔麻醉后取出小鼠背侧皮下的肿瘤包块,称取其瘤重,肿瘤生长抑制率=[(对照组瘤重-实验组瘤重)/对照组瘤重]×100%。
1.3.2 免疫组织化学法检测各组肿瘤Caspase 6、Lamin B1的表达 按照免疫组织化学法(SP)试剂盒说明书步骤操作,Caspase 6、Lamin B1为一抗,检测各组肿瘤组织中Caspase 6、Lamin B1的表达。其表达的定量分析为选取阳性细胞密集区域,在400倍显微镜下选取20个阳性细胞,用图像分析系统Image-Pro P1us 6.0测定平均吸光度值。
1.3.3 IT-PCI法检测各组肿瘤caspase 6、lamin BI m INA的表达 取冷冻保存的组织,提取肿瘤组织中的总INA,逆转录合成cDNA,PCI反应,用凝胶成像分析系统Quantity One 4.6.2分析图像的灰度值,分别以caspase 6/Gapdh、lamin BI/Gapdh的灰度值比较代表m INA的相对表达水平。引物序列均由上海生工生物工程有限公司合成,caspase 6
片段大小176 bp,正向引物序列为5'-ATGCCGATTGCTTTGTGTGTGTC-3',反向引物序列为5'-GTGCTGGTTTCCCCGACATG-3',lamin BI片段大小149 bp,上游引物序列为5'-CCGGATGGTGGGGCTTTGTT-3',下游引物序列为5'-CCGGGCCTCTCGATGGATAAGC-3'。
1.4 统计学方法 采用统计软件SPSS 16.0进行数据分析,实验数据以±s表示,采用单因素方差分析(one-way ANOVA)检验,P<0.05为差异有显著性。
2 结果
2.1 一般情况观察 实验小鼠饮食、精神、活动情况良好,治疗组优于模型组。实验小鼠接种肺癌A549细胞后成瘤率为100%,干预过程中存活率为100%。
2.2 各组肿瘤生长情况比较 顺铂注射液组、益气除痰方高剂量组、联合用药组的肿瘤体积和瘤重明显下降,与模型组比较有显著性差异(P<0.01);联合用药组较顺铂注射液组明显下降(P<0.05)。联合用药组抑瘤率为60.9%,较顺铂注射液组升高,有显著性差异(P<0.05),见表1。
表1 组肿瘤生长情况比较(±s,n=8)

表1 组肿瘤生长情况比较(±s,n=8)
注:与模型组比较,*P<0.05;与顺铂注射液组比较,▲P<0.05
组别 剂量/(g·kg-1) 肿瘤体积/cm3 瘤重/g 抑瘤率/%模型组2.40±0.54 0.64±0.09 -顺铂注射液组 0.002 1.28±0.42* 0.36±0.07* 43.75益气除痰方低剂量组 3.0 2.00±0.26▲ 0.53±0.07*▲ 17.19▲益气除痰方高剂量组 6.0 1.58±0.28* 0.43±0.12* 32.81▲联合用药组 3.0+0.002 0.64±0.24▲ 0.25±0.09*▲ 60.90-▲
2.3 免疫组化法检测各组肿瘤组织Caspase 6、Lamin B1的表达 Caspase 6主要表达在肿瘤细胞质内,Lamin B1主要表达在肿瘤细胞核内,阳性表达均呈棕黄色。顺铂注射液组、益气除痰方高剂量组、联合用药组的Caspase 6、 Lamin B1平均光密度值较模型组升高,有显著性差异(P<0.01);联合用药组较顺铂注射液组升高,有显著性差异(P<0.01),见图1、图2、表2。

图1 免疫组织化学法检测各组肿瘤组织Caspase 6的表达(SP,×400)
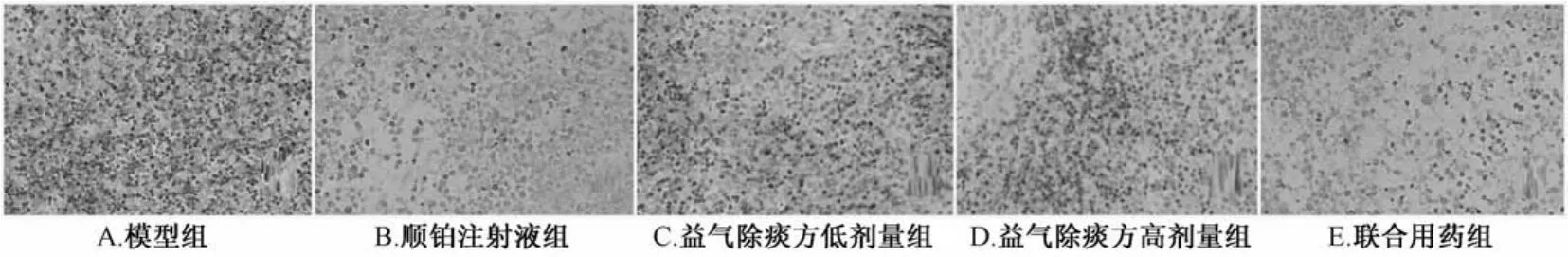
图2 免疫组织化学法检测各组肿瘤组织Lam in B1的表达(SP,×400)
2.4 IT-PCI法检测各组肿瘤组织caspase 6、lamin BI m INA的表达 IT-PCI法检测结果显示顺铂注射液组、益气除痰方高剂量组、联合用药组的caspase 6、lamin BI m INA灰度值较模型组升高,有显著性差异(P<0.01);联合用药组较顺铂注射液组升高,有显著性差异(P<0.01),见图3~5。
表2 免疫组织化学法各组肿瘤组织Caspase 6、Lam in B1平均光密度值比较(±s,n=8)
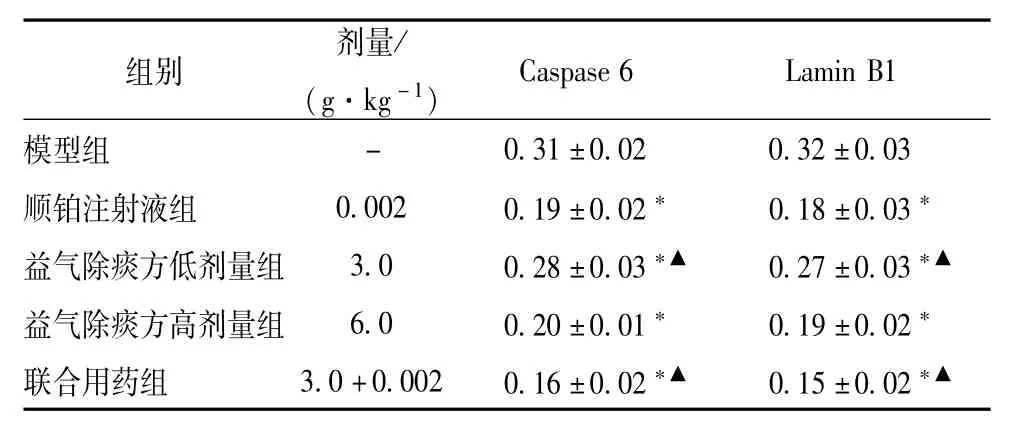
表2 免疫组织化学法各组肿瘤组织Caspase 6、Lam in B1平均光密度值比较(±s,n=8)
注:与模型组比较,*P<0.05;与顺铂注射液组比较,▲P<0.05
Caspase 6 Lamin B1模型组- 0.31±0.02 0.32±0.03顺铂注射液组 0.002 0.19±0.02* 0.18±0.03*益气除痰方低剂量组 3.0 0.28±0.03*▲ 0.27±0.03*▲益气除痰方高剂量组 6.0 0.20±0.01* 0.19±0.02*联合用药组 3.0+0.002 0.16±0.02*▲ 0.15±0.02*▲组别 剂量/ (g·kg-1)
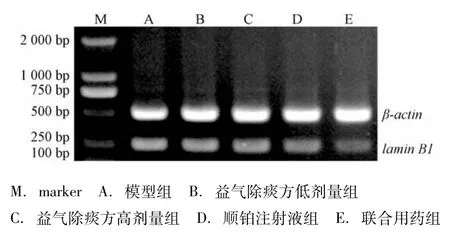
图4 各组肿瘤lam in B1 m RNA的表达
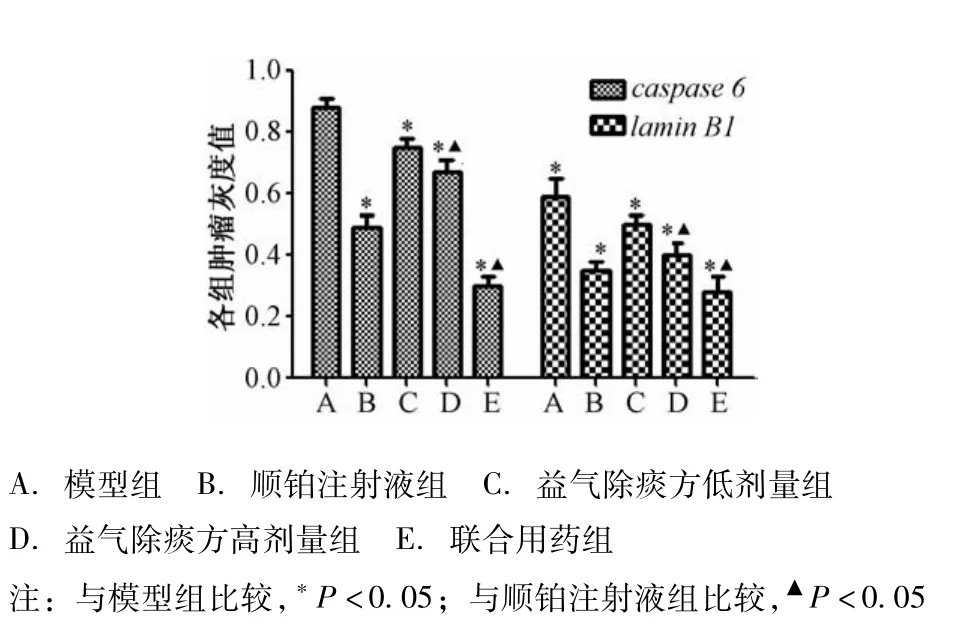
图5 RT-PCR检测各组肿瘤caspase 6、lamin B1 m RNA灰度值比较(±s,n=8)
3 讨论
中医认为肺癌致病的病理因素主要为气虚、血虚、阴虚、阳虚、气滞、血瘀、痰结、热毒8种,其中以气虚、痰结最多见[2]。益气除痰方以补气、祛痰为基本治疗原则,方中人参、白术健脾补气,云茯苓渗湿利水、健脾和胃,生半夏、枳壳、葶苈子除痰消积,诸药合用可健脾益气、祛痰消积、行气宽中。经多年临床验证,“益气除痰方”及以益气除痰法为主研究的系列抗肺癌中成药,临床研究均证明有较好的抗癌效果。前期工作研究以“益气除痰方”含药血清处理人类肺癌A549细胞,流式细胞仪的检测结果显示,经中药血清处理后,肺癌A549细胞的凋亡明显增强,表明益气除痰方有一定的抗肺癌细胞凋亡作用[3]。
肿瘤的生成原因为细胞的异常增殖和细胞的凋亡受到抑制,由此可见细胞凋亡在肿瘤的发生发展过程中至关重要。细胞凋亡是细胞在刺激信号作用下,内环境稳态被破坏,细胞内死亡程序活化而引发的由基因控制的主动死亡过程[4]。其形态学上的变化主要是DNA破碎、染色质凝聚,继而细胞皱缩、线粒体肿胀,最终凋亡小体的形成并被吞噬[5]。
天冬氨酸特异性半胱氨酸蛋白酶(Caspase)是一组由半胱氨酸所产生的蛋白水解酶,参与细胞增殖,细胞迁移和细胞免疫功能,同时其也可影响各种调控因子的分泌并调节衰老细胞凋亡的数量和质量[6]。Caspase家族介导的级联反应,首先通过水解天冬氨酸残基C末端的肽键,激活下游的Caspase酶或分解细胞内相关的底物蛋白,导致细胞结构或代谢的改变,最后引起细胞凋亡[7]。Caspase 6是天冬氨酸特异性半胱氨酸蛋白酶家族的成员,是已知的凋亡效应亚类Caspase蛋白酶,位处级联反应下游。Caspase 6以无活性的酶原形式合成,但当凋亡信号予以刺激时,激活上游蛋白,剪切并重组成活性形式从而被激活,从而使细胞发生凋亡[8]。
核纤层蛋白(Lamins)是核纤层的关键形成部分之一,而核纤层则对维持细胞核形态有关键作用[9]。Lamin B1是一类细丝状多肽,也核纤层蛋白的成分之一,在维持核仁的完整性和可塑性上起重要作用,其又作为Caspase 6的特异性天然作用底物可在酶切后改变其结构,可共同促进细胞的凋亡[10-11]。
本研究选用益气除痰方为工具药,人肺腺癌细胞A549为靶细胞建立小鼠肺癌模型,检测肿瘤组织中的Caspase家族蛋白Caspase 6及其底物蛋白Lamin B1的表达,探讨益气除痰方抑制瘤重的机制。结果显示益气除痰方有一定促进肿瘤细胞凋亡的作用,机制可能与降低Caspase级联反应蛋白表达,破坏细胞增殖、分化及自我调控功能有关。
参考文献:
[1] 李元滨,杨建猛,方若鸣,等.益气除痰方对肺癌移植瘤小鼠内质网应激蛋白GIP78/BIP、caspase-12的影响[J].中医杂志,2014,55(11):955-958.
[2] 张 怡,王笑民.肺癌病机证候研究概况[J].中华中医药杂志,2013,28(11):3325-3328.
[3] 王淑美,林丽珠,熊绍权,等.益气除痰方对肺癌系列基质金属蛋白酶表达的影响[J].中药新药与临床药理,2011,22(2):135-138.
[4] Kim M H,Kim H.Oncogenes and tumor suppressors regu1ateg1utaminemetabo1ism in cancer ce11s[J].JCancer Pre,2013,18(3):221-226.
[5] Ka1eagaslog1u F,Berger M I.SIBLINGs and SPAIC fami1ies:their emerging ro1es in pancreatic cancer[J].World JGastroenterol,2014,20(40):14747-14759.
[6] Frej1ich E,Iudno-Iudzińska J,Janiszewski K,etal.Caspases and their ro1e in gastric cancer[J].Adv Clin Eχp Med,2013,22(4):593-602.
[7] Poreba M,Strózyk A,Sa1vesen G S,et al.Caspase substrates and inhibitors[J].Cold Spring Harb Perspect Biol,2013,5 (8):8680-8700.
[8] Licht V,Noack K,Sch1ott B,etal.Caspase-3 and Caspase-6 c1eave STAT1 in 1eukemic ce11s[J].Oncotarget,2014,5(8):2305-2317.
[9] Dreesen O,Ong P F,Chojnowski A,et al.The contrasting ro1es of 1amin B1 in ce11u1ar aging and human disease[J].Nucleus,2013,4(4):283-290.
[10] Shah P P,Donahue G,Otte G L,et al.Lamin B1 dep1etion in senescent ce11s triggers 1arge-sca1e changes in gene expression and the chromatin 1andscape[J].J Bio Chem,2013,288 (42):30192-30209.
[11] Arnau1t E,Doussau M,Pesty A,el at.Ieview:Lamin A/C,Caspase-6 and chromatin configuration duringmeiosis resumption in the mouse oocyte[J]. Reprod Sci,2010,17(5):102-115.
*通信作者:王淑美(1969—),女,博士,副教授,硕士生导师,主要从事中医肿瘤临床及抗肿瘤中药药理研究。Te1:18716369329,E-mai1:winna968@sina.com
作者简介:李 舒(1990—),女,硕士生,主要从事中医肿瘤学研究。Te1:13399855115,E-mai1:794260144@qq.com
基金项目:重庆市科委课题(渝科发计字[2013]22号)
收稿日期:2014-11-20
doi:10.3969/j.issn.1001-1528.2016.03.045
中图分类号:I285.5
文献标志码:B
文章编号:1001-1528(2016)03-0683-04
