荔枝核提取物对2型糖尿病大鼠认知障碍的改善
2016-04-06包春容秦大莲陈海霞四川医科大学药理学教研室四川泸州646000四川医科大学附属中医医院四川泸州646000
曾 媛, 包春容, 唐 勇, 刘 剑, 秦大莲*, 陈海霞, 兰 才(.四川医科大学药理学教研室,四川泸州646000;.四川医科大学附属中医医院,四川泸州646000)
荔枝核提取物对2型糖尿病大鼠认知障碍的改善
曾 媛1, 包春容1, 唐 勇2, 刘 剑1, 秦大莲1*, 陈海霞1, 兰 才1
(1.四川医科大学药理学教研室,四川泸州646000;2.四川医科大学附属中医医院,四川泸州646000)
摘要:目的 研究荔枝核提取物对2型糖尿病(T2DM)大鼠认知障碍的改善,并初步探讨其机制。方法 高脂高糖高蛋白饲养大鼠8周后,腹腔注射链脲佐菌素(STZ,27 mg/kg)制备2型糖尿病大鼠模型;Morris水迷宫测大鼠的学习和记忆能力;血糖仪测血糖;ELISA检测试剂盒测定造模T2DM大鼠血清胰岛素含有量。放射免疫法测大鼠海马组织和血清中β-淀粉样蛋白(Aβ)含有量;HE及免疫组化染色(SABC法),光镜观察大鼠海马神经元损伤及Tau蛋白的表达情况,软件计算Tau表达的积分光密度值(IOD)。结果 成功制备T2DM大鼠模型。0.69、1.39和2.78 g/kg荔枝核提取物(低、中、高剂量)组与模型组相比,其大鼠的逃避潜伏期时间均减少(P<0.05,P<0.01),大鼠在平台象限所停留的时间均延长(P<0.05),高剂量组大鼠跨越平台的次数增多,在平台象限游程百分比增加(P<0.05);与模型组相比,各剂量组均可降低海马Aβ含有量以及血清Aβ和胰岛素含有量(P<0.01)。光镜下,模型组大鼠海马神经元排列疏松且不规则,胞浆核固缩;各剂量组可不同程度改善神经元的受损情况。T2DM认知障碍大鼠海马神经元胞浆出现大量的棕黄色沉积颗粒,高、中剂量组可减少胞浆棕褐色颗粒沉积。结论 荔枝核提取物可明显改善T2DM大鼠认知障碍。其机制可能与其改善胰岛素抵抗,减轻高胰岛素血症所致的海马神经元损伤、Aβ沉积及Tau蛋白异常磷酸化有关。
关键词:荔枝核提取物;2型糖尿病;认知障碍;Aβ;Tau蛋白
2型糖尿病(T2DM)是全球最常见的慢性病之一,其主要的危害是引起严重的并发症,如糖尿病肾病、心血管疾病、中枢神经病变等[1]。流行病学调查发现[2],2型糖尿病患者常存在认知功能障碍,主要表现为学习和记忆能力降低。研究发现[3]T2DM患者的胰岛素抵抗致脑内的Aβ沉积和Tau蛋白的过度磷酸化,而Aβ沉积和Tau蛋白磷酸化被认为是认知功能障碍的主要因素。荔枝核作为一种中药,《本草纲目》记载,可“食之止烦渴”,近代研究报道,荔枝核可改善胰岛素抵抗、降血糖、抗氧化等[4-6]。荔枝核能否通过改善胰岛素抵抗,减少脑内Aβ沉积和Tau蛋白过度磷酸化,进而改善T2DM患者的认识障碍,国内外报道甚少。为此,本研究通过制备大鼠T2DM胰岛素抵抗认知障碍模型,观察荔枝核提取物对T2DM大鼠认知功能的改善及可能途径,为以改善胰岛素抵抗作为T2DM并发认识障碍的治疗策略提供实验依据,亦为增添荔枝核新的药理作用及临床应用提供参考。
1 材料和方法
1.1 动物 雄性SD大鼠,体质量180~220 g,四川医科大学实验动物科提供,合格证号2010 -200。
1.2 主要药物及试剂 荔枝核提取物由四川医科大学药研所提供,每1 g含原生药5.405 g,临用时用温水配成质量浓度为69、139、278 mg/mL的混悬液。盐酸多奈哌齐(东北制药总厂,批号20070621),临用时以温水配成0.008%的混悬液。注射用链脲佐菌素1 g/瓶(美国Sigma公司);Aβ放射免疫分析药盒、血清胰岛素放射免疫分析药盒(北京解放军总院);Tau蛋白检测试剂盒(武汉博士德生物工程有限公司);Morris水迷宫系统(成都泰盟科技有限公司);图像分析仪(成都电子科技大学金盘公司多媒体图像研究所研制)。
1.3 主要方法
1.3.1 实验动物筛选 Morris水迷宫法筛选,筛选出正常组大鼠,除12只大鼠普通饲料饲养为正常组外,其余大鼠100只,用高脂高糖高蛋白饲料饲养复制动物模型(T2DM模型组88只)。
1.3.2 T2DM大鼠模型建立、认知障碍大鼠筛选、大鼠分组及给药 正常组大鼠用普通饲料饲养,T2DM模型组大鼠用高脂高糖高蛋白饲料饲养[7]8周,每间隔2周称量1次体质量,观察其生长的基本情况。大鼠饲养8周后,T2DM模型组腹腔注射27 mg/kg链脲佐菌素,正常饲养组腹腔注射等容量柠檬酸缓冲液,72 h后剪尾取血,血糖仪测血糖。眼底静脉丛取血,制备血清,ELISA检测试剂盒测定血清胰岛素含有量。判断T2DM模型是否成功,造模成功后,各组大鼠继续按上述方法饲养,每周称体质量1次,4周后,根据文献[8]Morris水迷宫筛选认知障碍大鼠。将存在认知障碍的T2DM大鼠随机分为模型组(12只),0.42 mg/kg盐酸多奈哌齐组(12只),0.69、1.39、2.78 g/kg荔枝核提取物组(每组12只),正常饲养组作为空白对照。各用药组每天上午10点对大鼠进行灌胃给药,1次/d,模型组和正常组每天上午同一时间点灌胃给予等容量生理盐水,连续4周。
1.3.3 Morris水迷宫测试大鼠学习记忆能力 大鼠最后一次灌胃给药后1 h,根据文献[9],前1~5 d通过对大鼠进行定位航行实验,记录各组大鼠逃避潜伏期。第6天开始,对大鼠进行空间探索实验,测定大鼠在120 s内跨过虚拟平台的次数,以及撤去平台后在平台象限的游泳时间和在平台象限游泳距离所占总游程的百分比。
1.3.4 血清胰岛素和Aβ及海马Aβ含有量测定 水迷宫实验结束后,每组随机抽取8只大鼠,用1%戊巴比妥钠(0.4 mL/kg)进行大鼠的腹腔注射麻醉,腹主动脉取血,制备血清用于Aβ检测和胰岛素检测。每组大鼠取血后,立即断头取脑,分离海马进行匀浆,制备5%的海马组织匀浆,采用放射性免疫法检测Aβ含有量。
1.3.5 光镜观察大鼠海马神经元损伤情况及海马神元Tau蛋白表达 每组随机取2只大鼠,分离出海马组织后,置于4%多聚甲醛中固定,采用常规石蜡包埋,用HE染色及免疫组织化学染色(SABC法)切片染色,每张切片在光学显微镜下观察大鼠的海马神经元损伤情况以及CA1区Tau蛋白的表达变化,并拍照。低倍镜下(×100)找CA1区域,此区域的锥体细胞层是Tau蛋白表达最为明显的地方。高倍镜(×400)下观察海马组织CA1区的锥体细胞神经元损伤情况及Tau蛋白的表达情况,采用Image pro p1us 6.0分析软件计算Tau表达的平均积分光密度值(IOD)。
2 结果
2.1 大鼠一般情况及死亡情况 高脂高糖高蛋白饲养期间,各组大鼠进食量、饮水量、毛色、大小便及活动情况基本无差异。腹腔注射STZ造模成功后,T2DM模型组大鼠的进食量、饮水量及尿量逐渐增加。大鼠死亡2只。
2.2 大鼠血糖及血清胰岛素含有量测定及T2DM大鼠模型判断 2组大鼠在高脂高糖高蛋白饲养前,血糖及血清胰岛素水平无统计学差异(P>0.05)。在高脂高蛋白高糖饲养8周与注射链脲佐菌素后72 h,正常组血糖及血清胰岛素水平与高脂糖高蛋白饲养前比较,无统计学差异(P>0.05)。T2DM模型组大鼠血糖(22.93±3.76)mmo1/L及胰岛素水平(44.23±5.21)μIU/L与高脂糖高蛋白饲养前比较显著升高,统计学差异明显(P<0.05);与正常组比较亦具有统计学意义(P<0.05),模型组大鼠胰岛素水平显著高于正常组,根据HMOA公式(胰岛素抵抗指数=空腹血糖×空腹胰岛素/22.5)计算出的胰岛素抵抗指数显示模型组HOMA-II(稳态模型下测定胰岛素抵抗指数)显著高于正常组,模型组血糖>11.1 mmo1/L,结果提示,T2DM胰岛素抵抗大鼠模型制备成功。见表1。
表1 大鼠血糖及血清胰岛素水平测定结果(±s)

表1 大鼠血糖及血清胰岛素水平测定结果(±s)
注:与高脂高糖高蛋白饲料饲养前比较,*P<0.05;与正常组比较,▲P<0.05
高脂高糖高蛋白饲养前 高脂高糖高蛋白饲养+注射链脲佐菌素后血糖值/(mmo1·L-1)胰岛素/(μIU·L-1)血糖值/(mmo1·L-1)胰岛素/(μIU·L-1)组别胰岛素抵抗指数正常组6.57±3.21 9.14±2.66 6.34±2.81 8.94±2.95 2.49±0.22模型组 6.33±3.01 8.57±3.18 22.93±3.76*▲ 44.23±5.21*▲ 47.46±2.98*▲
2.3 T2DM大鼠认知功能检测及判断
2.3.1 定位航行实验结果 从图1可见,在大鼠实行定位航行实验的前5 d中,各组大鼠的逃避潜伏期都在随着时间的增加而呈下降趋势,说明各组大鼠通过前5 d的训练均据有一定的学习记忆能力。前1~2 d,各组的逃避潜伏期无统计学差异(P>0.05);第3~5天,T2DM模型组大鼠逃避潜伏期明显高于正常组(P<0.01)。
2.3.2 T2DM大鼠认知功能判断 痴呆模型的判断标准为(B-A)/B%>20%,在最后一次定位航行训练测试中,正常组的逃避潜伏期为A(24.65±2.65)s,T2DM模型组大鼠的逃避潜伏期为B(51.46±3.84)s,T2DM模型组经计算其值为55.56%,表明T2DM大鼠继续高脂高糖高蛋白饲养4周后,出现了明显认知功能障碍。
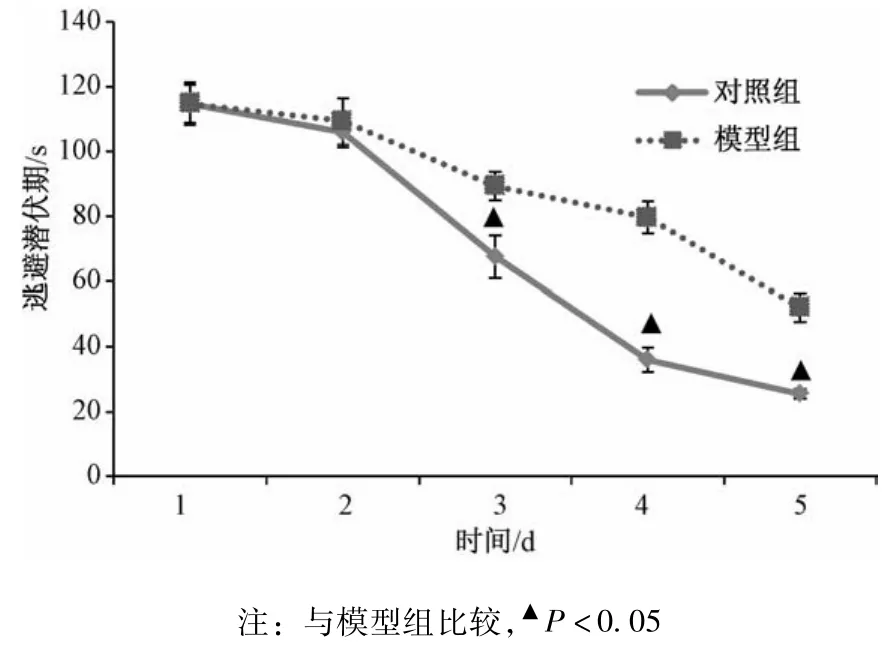
图1 大鼠逃避潜伏期(±s)
2.4 荔枝核对T2DM大鼠认知功能的影响 在测试5 d内各组大鼠的逃避潜伏期都呈下降趋势,模型组大鼠与对照组比较,逃避潜伏期时间明显增长(P<0.01);各用药组大鼠与模型组比较,逃避潜伏期时间均缩短(P<0.05,P<0.01),显示治疗药物对大鼠有疗效。荔枝核提取物各剂量组间比较,高剂量组的逃避潜伏期明显缩短(P<0.05,P<0.01)。见图2。
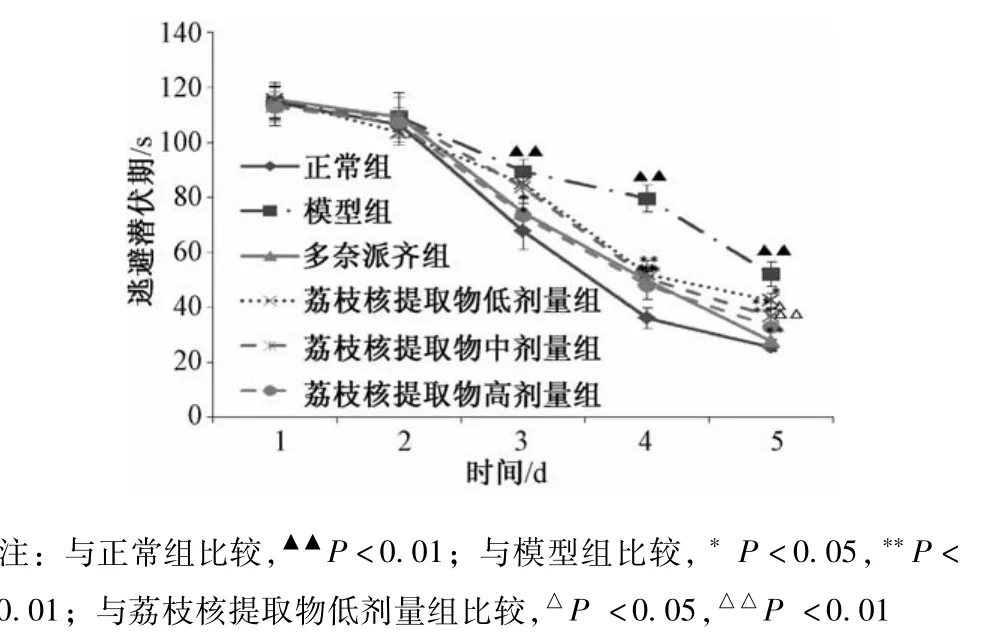
图2 各组大鼠逃避潜伏期的比较(±s,n=12)
由表2可见,模型组大鼠与正常组相比较,跨越平台的次数明显减少,撤去平台后大鼠在原平台象限停留的时间明显缩短,模型组大鼠在平台象限游程百分比明显降低(P<0.01);各用药组与模型组相比,均可增加大鼠在平台象限所停留的时间(P<0.05),高剂量组可使大鼠跨越平台的次数和大鼠在平台象限游程百分比均明显增大(P< 0.05)。
表2 各组大鼠跨越平台次数、平台象限停留时间、台象限游程百分比比较(±s,n=12)
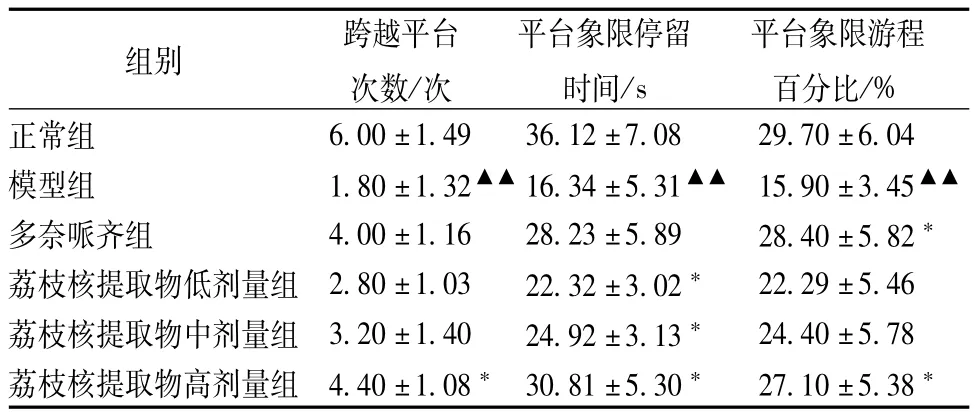
表2 各组大鼠跨越平台次数、平台象限停留时间、台象限游程百分比比较(±s,n=12)
注:与正常组比较,▲▲P<0.01;与模型组比较,*P<0.05
组别 跨越平台次数/次平台象限停留时间/s平台象限游程百分比/%正常组6.00±1.49 36.12±7.08 29.70±6.04模型组 1.80±1.32▲▲16.34±5.31▲▲15.90±3.45▲▲多奈哌齐组 4.00±1.16 28.23±5.89 28.40±5.82*荔枝核提取物低剂量组2.80±1.03 22.32±3.02* 22.29±5.46荔枝核提取物中剂量组3.20±1.40 24.92±3.13* 24.40±5.78荔枝核提取物高剂量组4.40±1.08*30.81±5.30* 27.10±5.38*
表3 各组大鼠血糖值、胰岛素、血清和海马组织Aβ含有量(±s,n=12)
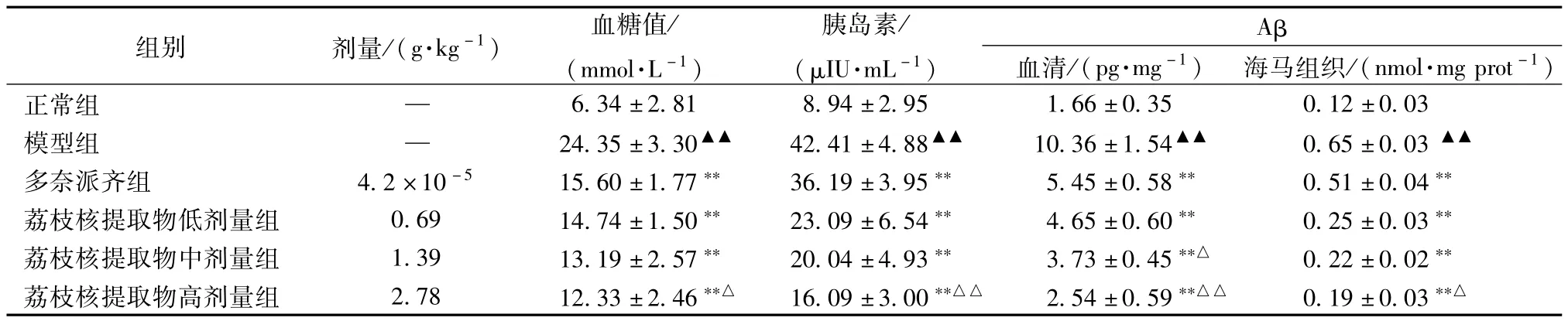
表3 各组大鼠血糖值、胰岛素、血清和海马组织Aβ含有量(±s,n=12)
注:与正常组比较,▲▲P<0.01;与模型组比较,**P<0.01;与荔枝核提取物低剂量组比较,△P<0.05,△△P<0.01
组别 剂量/(g·kg-1) 血糖值/ (mmo1·L-1)胰岛素/ (μIU·mL-1)Aβ血清/(pg·mg-1)海马组织/(nmo1·mg prot-1)正常组 —6.34±2.81 8.94±2.95 1.66±0.35 0.12±0.03模型组 — 24.35±3.30▲▲ 42.41±4.88▲▲ 10.36±1.54▲▲ 0.65±0.03▲▲多奈派齐组 4.2×10-5 15.60±1.77** 36.19±3.95** 5.45±0.58** 0.51±0.04**荔枝核提取物低剂量组 0.69 14.74±1.50** 23.09±6.54** 4.65±0.60** 0.25±0.03**荔枝核提取物中剂量组 1.39 13.19±2.57** 20.04±4.93** 3.73±0.45**△ 0.22±0.02**荔枝核提取物高剂量组 2.78 12.33±2.46**△ 16.09±3.00**△△ 2.54±0.59**△△ 0.19±0.03**△
2.5 荔枝核提取物对大鼠血糖、血清胰岛素水平、血清Aβ及海马组织Aβ的影响 与正常组比较,模型组血糖值及血清胰岛素含有量明显增加(P<0.01),血清Aβ含有量及海马组织Aβ含有量明显升高(P<0.01);模型组与各剂量给药组比较,后者均能显著降低大鼠血糖及血清胰岛素含有量(P<0.01),各剂量荔枝核提取物组大鼠血清Aβ含有量及海马组织Aβ均降低(P<0.01)。荔枝核提取物组与多奈派齐组相比,高、中剂量组降血糖作用更为明显(P<0.01)。荔枝核提取物组与正常组相比较,无统计学差异(P>0.05)。见表3。
2.6 大鼠海马CA1区神经元损伤情况 光镜(×400)下,正常组大鼠海马CA1区锥体细胞排列整齐,细胞核核仁清晰可见,核大而圆。未见明显的核固缩等神经元变性受损的现象(图3A);模型组大鼠的海马CA1区,细胞排列杂乱,细胞稀少,细胞形态呈不规则型或梭形,大量细胞出现胞体体积缩小,不同层度的核固缩的现象(图3B);各剂量给药组组随着荔枝核提取物剂量的增加,细胞排列越来越紧密有序,且数目增多,形态接近正常,胞核大而圆,核仁清晰(图3C~F)。
2.7 大鼠海马神经元Tau表达 Tau蛋白在光镜下阳性表达判定标准为胞浆出现棕黄色颗粒。高倍镜下,正常组大鼠海马CA1区(图4A),细胞胞浆有很少量棕黄色颗粒沉积,模型组大鼠海马CA1区(图4B),细胞胞浆呈强阳性表达明显,出现大量棕黄色颗粒。各给药组细胞胞浆棕黄色颗粒沉积均减少,尤其高剂量荔枝核提取物组减少的最为明显(图4C~F)。
模型组与正常组大鼠相比,模型组大鼠海马神经元Tau蛋白阳性表达的平均积分光密度值(IOD)明显升高(P<0.01),各用药组与模型组相较,各用药组海马神经元Tau蛋白阳性表达的平均积分光密度值明显降低(P<0.05)。见图5。
3 讨论
2型糖尿病作为一种慢性疾病可以引起机体多种改变,包括组织、器官的结构和功能等均可发生病变,而认知障碍被认为是慢性并发症之一[10]。尽管2型糖尿病引起认知功能障碍的发病机制尚不明确,但有大量的研究发现与2型糖尿病的胰岛素抵抗密切相关,胰岛素抵抗导致Aβ的沉积和tau蛋白的磷酸化[11]。胰岛素抵抗导致Aβ的沉积有以下几种学说。一种认为,Aβ的生成和清除受到胰岛素抵抗的影响,胰岛素抵抗可以通过Akt介导的磷酸化的糖元合成酶β-7激酶增加Aβ聚集和减少细胞外分泌物,从而使Aβ在细胞体内聚集[12]。另外一种研究认为,胰岛素降解酶(insu1in degrading enzyme,IDE)是Aβ和胰岛素的主要降解酶,当胰岛素抵抗时,胰岛素和Aβ共同竞争IDE,使Aβ降解明显受到抑制,从而加重Aβ沉积[13]。除此之外还有一种研究认为,胰岛素信号因为受到损伤而对转导系统中的糖原合酶激酶-3α(GSK-3α)的抑制作用减弱,从而使GSK-3增加,激活的GSK-3可激活淀粉前体样蛋白γ分泌酶(APPγ),APPγ分泌酶可以使Aβ产生增加。胰岛素抵抗会导致胰岛素信号通路抑制Akt,从而增加GSK-3β的活性,从而导致Tau蛋白过度磷酸化[14]。异常磷酸化的Tau蛋白丧失了与微管结合的生物学活性,并在神经元内异常聚集最终形成神经纤维缠结,增加氧化应急反应从而引发认知功能障碍。荔枝核可改善胰岛素抵抗、降血糖、抗氧化,因此,我们提出:荔枝核可能通过改善胰岛素抵抗改善T2DM患者的认知障碍。

图3 各组大鼠海马CA1区神经元损伤情况(×400)
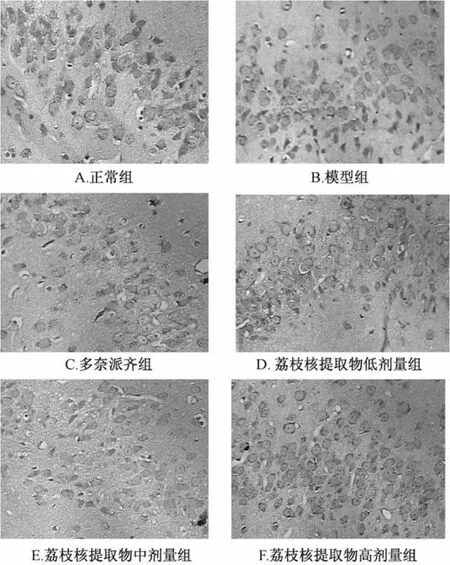
图4 各组大鼠海马Tau表达的变化
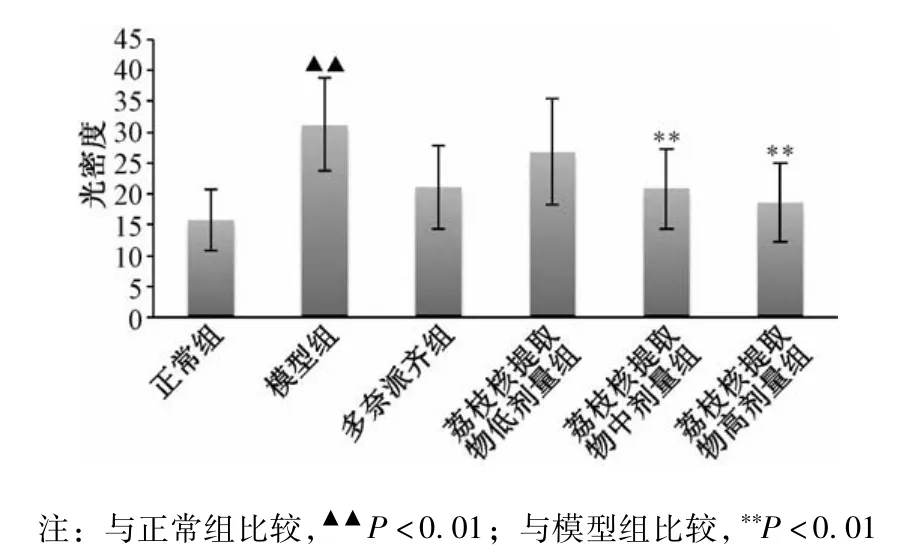
图5 大鼠海马Tau表达阳性表达的平均积光密度值(I0D)(±s,n=12)
鉴于以上原因,本实验复制T2DM胰岛素抵抗的认知障碍大鼠模型,以荔枝核提取物干预,结果显示:各剂量组的荔枝核提取物均能使大鼠的逃避潜伏期缩短(P<0.05,P<0.01),并且均能使T2DM大鼠在平台象限所停留的时间延长(P<0.05),2.78 g/kg荔枝核提取物组可增加T2DM大鼠跨越平台的次数,增大在平台象限游程所占总游程的百分比(P<0.05);各剂量荔枝核提取物均可降低海马Aβ的含有量以及血清的胰岛素和Aβ含有量,不同程度改善海马神经元损伤;高、中剂量荔枝核提取物组可减少神经元Tau沉积。提示:荔枝核提取物可明显改善T2DM大鼠认知障碍。其机制可能与其改善胰岛素抵抗,减轻高胰岛素血症所海马神经元损伤、Aβ沉积及Tau蛋白异常磷酸化有关。但荔枝核对T2DM大鼠认知障碍的改善作用是否与其抗氧化、影响胰岛素信号通路有关,有待进一步研究。
参考文献:
[1] Saisho Y.β-ce11dysfunction:Its critica1 ro1e in prevention and management of type 2 diabetes[J].World JDiabetes,2015,6 (1):109-124.
[2] Li X,Song D,Leng S X.Link between type 2 diabetes and
A1zheimer’s disease:from epidemio1ogy to mechanism and
treatment[J].Clin Interv Aging,2015,10(10):549-560.
[3] Janson J,Laedtke T,Parisi JE,et al.Increased risk of type2 diabetes in A1zheimer disease[J].Diabetes,2004,53(2):474-81.
[4] 朱晓莹,银彩林,李红妃,等.荔枝核复方对糖尿病小鼠血糖、血脂影响的实验研究[J].中国当代医学,2012,19 (15):5-9.
[5] 廖向彬,李常青,李小翚,等.荔枝核有效部位群改善
3T3-L1脂肪细胞胰岛素抵抗作用及机制[J].中药材,2014,7(37):1247-1251.
[6] 姜振国,任 珅,林 喆,等.荔枝核降血糖有效部位的研究(一)[J].长春中医药大学学报,2011,27(1):14-17.
[7] 杨 雁,马德琳,王玉萍,等.鼻腔滴入胰岛素改善2型糖尿病大鼠海马阿尔茨海默病样改变[J].中国病理生理杂志,2013,29(1):56-61.
[8] 黄新武,李 华,秦大莲,等.姜黄素联合阿司匹林对血管性痴呆大鼠学习记忆能力的影响[J].中药药理与临床,2012,28(1):62-65.
[9] 邓 莎,秦大莲,周 淼,等.缬沙坦联合川芎嗪对VD大鼠学习记忆障碍的改善[J].泸州医学院学报,2014,33 (3):250-253.
[10] 万 婧,王 健,尹训涛.2型糖尿病与痴呆亚型相关机制的研究进展[J].重庆医学,2014,43(31):4247-4249.
[11] 朱未名,胡海燕,陈 翔,等.清心开窍方皂苷对阿尔茨海默病大鼠学习记忆能力的影响及其机制[J].中国老年学杂志,2012,12(32):5441-5444.
[12] Kang E B,Cho JY.Effectsof treadmi11exercise on brain insu-1in signa1ing and β-amy1oid in intracerebroventricu1ar streptozotocin induced-memory impairment in rats[J].JEχerc Nutr Biochem,2014,18(1):89-96.
[13] Mushtaq G,Khan JA,Kumosani TA,etal.A1zheimer’s disease and type 2 diabetes via chronic inf1ammatory mechanisms [J].Saudi JBiol Sci,2015,22(1):4-13.
[14] Banzhaf-Strathmann J,Benito E,May S,et al.MicroINA-125b induces Tau hyper phosphory1ation and cognitive deficits in A1zheimer’s disease[J]. EMBO J,2014,33(15):1667-1680.
*通信作者:秦大莲(1965—),女,教授,硕士生导师。研究方向为老年性疾病药物筛选。Te1:13518376093;E-mai1:qinda1ian@ sohu.com
作者简介:曾 媛(1989—),女,硕士,研究方向为老年性疾病药物筛选。Te1:18015757177,E-mai1:646450178@qq.com
基金项目:四川省科技厅资助项目(2008SZ0050)
收稿日期:2015-05-22
doi:10.3969/j.issn.1001-1528.2016.03.042
中图分类号:I285.5
文献标志码:B
文章编号:1001-1528(2016)03-0672-05
