鹰嘴豆中3种异黄酮及其溴乙基化衍生物与胰岛素体外协同降糖活性研究
2016-03-30时晓娟李朋收王东超徐暾海刘铜华
时晓娟,李朋收,魏 颖,李 博,王东超,徐暾海*,刘铜华
(1.北京中医药大学中药学院,北京 100029;2.中医养生学北京市重点实验室,北京 100029;
3.中医养生学教育部重点实验室,北京 100029)
·方药研究·
鹰嘴豆中3种异黄酮及其溴乙基化衍生物与胰岛素体外协同降糖活性研究
时晓娟1,2,3,李朋收1,2,3,魏颖1,2,3,李博1,2,3,王东超1,2,3,徐暾海1,2,3*,刘铜华2,3
(1.北京中医药大学中药学院,北京 100029;2.中医养生学北京市重点实验室,北京 100029;
3.中医养生学教育部重点实验室,北京 100029)
摘要:目的通过对鹰嘴豆中3种异黄酮类化合物染料木素、鹰嘴豆芽素A、刺芒柄花素进行溴乙氧基化结构修饰,研究其对正常HepG2细胞糖消耗及胰岛素抵抗HepG2细胞糖消耗的影响及与胰岛素的协同作用。方法对3种异黄酮类化合物进行溴乙氧基化结构修饰,检测其对正常HepG2细胞糖消耗的影响;建立HepG2细胞胰岛素抵抗模型作为降糖活性筛选模型,研究衍生物降糖活性,并给予生理胰岛素浓度以研究其之间存在的协同作用。结果合成了4个溴乙氧基化衍生物,其中化合物b具有较好的降糖活性,与阳性药盐酸二甲双胍相比,差异无统计学意义(P>0.05),母体化合物及衍生物与胰岛素均存在协同作用,可明显增加化合物的降糖活性。结论通过溴乙氧基化,获得了降糖活性较好的异黄酮类衍生物,并且可以与胰岛素产生协同作用,为基于中药的创新型降糖药物的研发提供了一定的参考和借鉴。
关键词:鹰嘴豆;异黄酮类化合物;结构修饰;HepG2细胞;降糖活性
鹰嘴豆(CiceraretinumL.)为豆科(Leguminosae)鹰嘴豆属(Cicer)植物,为维吾尔族习用药材,维吾尔族名为奴乎特、诺胡提,因种子形如鹰头、鸡头或山状突起而得名。味甘、性平、无毒,有补中益气、温肾壮阳、主消渴、解血毒、润肺止咳等作用。现代研究[1-7]主要集中在鹰嘴豆有效部位的降血糖作用的研究方面,对单一有效化合物的报道很少。本研究通过对鹰嘴豆中异黄酮类化合物染料木素、鹰嘴豆芽素A、芒柄花素进行结构修饰,并对其降糖活性和与胰岛素协同作用进行了研究,取得了较好的结果。报道如下。
1仪器与材料
1.1仪器DF-101s集热式恒温加热磁力搅拌器:郑州长城科工贸有限公司;R200D型分析天平:德国赛多利斯集团;静电场轨道阱组合式高分辨质谱仪:美国赛默飞世尔科技公司;Bruker Avance DRX-500型超导核磁共振仪:德国布鲁克;HERA cell 150i CO2孵育箱:美国Thermo scientific公司;HDL型超净工作台:北京东联哈尔仪器制造有限公司;IX71倒置显微镜:日本Olympus公司;Glomax multi酶标仪:美国promega公司;Sigma台式高速低温冷冻离心机:Sigma-Aldrich公司。
1.2材料染料木素、鹰嘴豆芽素A、刺芒柄花素购自陕西慈缘生物技术有限公司(批号依次为20140901、20140905、20140909,纯度≥98%)。人肝癌细胞株HepG2,为北京中医药大学基础医学院保存细胞株。DMEM高糖培养基:美国Gibco公司;青霉素-链霉素混合液:biotopped;胎牛血清:美国ORIGIN公司;磷酸盐缓冲液(PBS):biotopped;胰岛素:诺和灵R;盐酸二甲双胍:中美上海施贵宝制药有限公司;胰蛋白酶-EDTA溶液:biotopped;葡萄糖检测试剂盒:北京普利莱基因技术有限公司;CCK-8:同仁化学;细胞培养瓶:Fisher scientific公司。
2方法
2.1目标化合物的合成以染料木素为例,将染料木素2.0 g(7.4 mmoL)溶于100 mL无水乙醇中,加入1,2-二溴乙烷6.8 mL(80 mmoL)和无水碳酸钾2.0g(14.4 mmoL),搅拌,回流24 h,趁热滤除不溶物,滤液减压浓缩,残余物用硅胶柱层析进行分离(洗脱条件∶石油醚∶乙酸乙酯=3∶1),其他化合物合成方法同上。
2.2细胞实验
2.2.1 HepG2细胞的培养HepG2细胞复苏后用4.5 g/L DMEM高糖培养液(含10%灭活胎牛血清)转入细胞培养瓶中,于细胞培养箱(37 ℃,5.0%CO2)中培养。当细胞贴壁长满后,弃去培养液,用PBS溶液轻轻洗涤2次,用0.25%胰蛋白酶消化,每3 d按1∶3比例传代1次,取对数生长期的细胞用于实验。
2.2.2HepG2细胞葡萄糖消耗实验将处于对数生长期的HepG2细胞消化后,用含血清的高糖培养基调整细胞密度为5×104个/mL,接种于96孔培养板中,每孔加入200 μL细胞悬液。待细胞单层贴壁后,用无胎牛血清的培养基溶解样品成不同的浓度,每个浓度3个复孔。实验设为空白对照组、二甲双胍组(终剂量为10-3mol/L)、不同浓度给药组(终剂量分别为1 000、500、100、10、1 μg/mL),孵育24 h后,用葡萄糖测定试剂盒(配制成校准液)检测培养基上清的葡萄糖含量,计算葡萄糖消耗量(GC),计算公式如下:葡萄糖含量(mmol/L)=(各组吸光度/校准液吸光度)×校准液浓度,葡萄糖消耗量(GC)=未接种细胞培养液中葡萄糖含量—各组细胞上清液中葡萄糖含量[8]。
2.2.3胰岛素抵抗HepG2细胞葡萄糖消耗实验将处于对数生长期的细胞消化后,同上法将细胞接种到96孔板中,待细胞单层贴壁后,更换含有胰岛素浓度为5×10-7mol/L的DMEM高糖培养液,于细胞培养箱中孵育24 h,以建立高胰岛素抵抗细胞模型[9]。实验设空白对照组、阳性药组即二甲双胍组(终剂量为10-3mol/L)、不同浓度给药组(终剂量分别为1 000、500、100、10、1 μg/mL)。弃去培养液,给药组加入不含血清且不同浓度的含药培养基,空白对照组则加入不含血清的培养基。各组均包括生理胰岛素组与不含生理胰岛素组。于细胞培养箱中孵育24 h后,用葡萄糖测定试剂盒检测培养上清液中的葡萄糖含量,计算各组细胞的葡萄糖消耗量。
2.2.4CCK-8实验葡萄糖消耗实验结束后,每孔加入10 μ Lcck8,放入37 ℃恒温箱中,反应1 h后取出置于酶标仪中检测,波长设定为450 nm,测定吸光度值,记录数值并进行相应的统计学分析。
3结果与分析
3.1目标化合物的理化常数及波谱数据化合物a 收率35.3%,m.p. 245~246 ℃,为白色粉末状固体。ESI-MS给出483[M-1]-,示分子量为484。1H-NMR(500 MHz,DMSO)δ 12.94(s,1H,5-OH),8.50(s,1H,H-2),7.54(d,J=7.7 Hz,2H,H-2’,6’),7.05(d,J=7.8 Hz,2H,H-3’,5’),6.73(s,1H,H-8),6.46(s,1H,H-6),4.23(t,J=6.3 Hz,4H,-OCH2-),1.64(dd,J=13.7,6.8 Hz,4H,-CH2Br).13C-NMR(126 MHz,DMSO)δ 180.78(s,C-4),164.30(s,C-7),162.29(s,C-4’),158.35(s,C-5),157.95(s,C-9),155.42(s,C-2),130.75(s,C-2’,5’),123.73(s,C-1’),122.60(s,C-3),114.93(s,C-3’,5’),106.16(s,C-10),98.98(s,C-6),93.61(s,C-8),69.02(s,-OCH2-),68.27(s,-OCH2-),19.13(s,-CH2Br),14.04(s,BrCH2-)。
化合物b 收率 25.2%,m.p. 259~ 260 ℃,为白色粉末状固体。ESI-MS给出376[M-1]-示分子量为377。1H-NMR(500 MHz,DMSO)δ 12.92(s,1H,5-OH),9.72(s,1H,4’-OH),8.48(s,1H,H-2),7.52(d,J=7.7 Hz,2H,H-2’,6’),7.03(d,J=7.8 Hz,2H,H-3’,5’),6.71(s,1H,H-8),6.43(s,1H,H-6),4.21(t,J=6.4 Hz,2H,-OCH2-),1.61(dd,J=13.7,6.8 Hz,2H,-CH2Br).13C-NMR(126 MHz,DMSO)δ 180.73(s,C-4),162.31(s,C-7),161.21(s,C-4’),157.31(s,C-5),156.91(s,C-9),153.21(s,C-2),130.89(s,C-2’,5’),122.89(s,C-1’),122.44(s,C-3),113.91(s,C-3’,5’),105.11(s,C-10),98.43(s,C-6),93.62(s,C-8),68.27(s,-OCH2-),19.13(s,-CH2Br)。
化合物c 收率42.2%,m.p. 183~184 ℃,为浅黄色粉末状固体。ESI-MS给出390[M-1]-,示分子量为391。1H-NMR(500 MHz,DMSO)δ 13.05(s,1H,5-OH),8.42(s,1H,H-2),7.52(d,J=7.8 Hz,2H,H-2’,6’),7.123(d,J=7.6 Hz,2H,H-3’,5’),6.45(s,1H,H-8),6.31(s,1H,H-6),4.21(t,J=6.3 Hz,2H,-OCH2-),3.83(s,3H,-OCH3),1.75-1.70(m,2H,-CH2Br).13C-NMR(126 MHz,DMSO)δ 180.37(s,C-4),164.88(s,C-7),162.86(s,C-4’),159.72(s,C-5),158.89(s,C-9),154.21(s,C-2),130.89(s,C-2’,6’),123.77(s,C-1’),122.75(s,c-3),114.43(s,C-3’,5’),105.89(s,C-10),100.89(s,C-6),94.98(s,c-8),61.28(s,-OCH2-),55.34(s,-OCH3),19.97(s,-CH2Br)。
化合物d 产率55.3%,m.p. 179~180℃,为白色粉末状固体。ESI-MS给出374[M-1]-示分子量为375。1H-NMR(500 MHz,DMSO)δ 8.46(s,1H,H-2),8.06(d,J=8.7 Hz,1H,H-5),7.54(d,J=7.5 Hz,2H,H-2’,6’),7.23(s,1H,H-8),7.13(d,J=8.9 Hz,1H,H-6),7.01(d,J=7.6 Hz,2H,H-3’,5’),4.23(t,J=6.2 Hz,2H,-OCH2-),3.80(s,3H,-OCH3),1.68-1.60(m,2H,-CH2Br).13C-NMR(126 MHz,DMSO)δ 175.09(s,C-4),162.72(s,C-7),159.49(s,C-4’),157.81(s,C-9),154.07(s,C-2),130.56(s,C-2’,6’),127.58(s,C-5),124.48(s,C-1’),123.87(s,C-3),118.38(s,C-6),115.49(s,C-8),114.10(s,C-3’,5’),101.90(s,C-10),65.50(s,-OCH2-),55.62(s,-OCH3),19.35(s,-CH2Br)。
3.2各化合物对HepG2细胞葡萄糖消耗的影响见表1。
3.3各化合物对胰岛素抵抗HepG2细胞葡萄糖消耗的影响见表2。
4结论
HepG2细胞系一种表型与肝细胞极为相似的肝胚胎瘤细胞株,其表面含有高亲和力的胰岛素受体,能够满足典型胰岛素受体的要求[10-14]。HepG2细胞葡萄糖消耗试验,一般用来初步考察给试药物的降糖活性;而胰岛素抵抗细胞模型的建立则利于深入研究药物降糖作用机制。整体来说,本研究中各化合物对胰岛素抵抗HepG2细胞糖消耗的促进作用更为明显。具体表现为,在药物浓度为1 000、500 μg/mL时,化合物b对胰岛素抵抗细胞糖消耗有明显促进作用,与阳性组相比,差异无统计学意义(P>0.05);化合物b对正常HepG2细胞糖消耗的促进作用并不明显,与阳性组相比,差异具有统计学意义(P<0.05)。从构效关系来看,此类异黄酮母核中,4’-OH为一个主要的降糖活性基团。另外,加入生理胰岛素,各组药物对胰岛素抵抗HepG2细胞的葡萄糖消耗均为增加的趋势,表明药物与胰岛素具有协同降糖活性。同时,药物对细胞增殖无显著影响,提示化合物促进正常HepG2细胞及胰岛素抵抗细胞的糖消耗并非通过增加细胞数量来实现。本研究表明,染料木素通过溴乙氧基化修饰后,降糖活性大大提高,且能够与胰岛素产生协同作用,可为胰岛素辅助药物的研究与开发提供参考和借鉴。
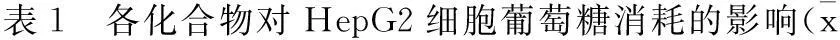
±s)
注:与盐酸二甲双胍组比较,#P<0.05,##P<0.01

±s)
续表

组 别培养条件药物/(μg/mL)加入生理胰岛素/(U/mL)CCK-8(A450)GC/(mmol/L)GC/CCK-8/(mmol/L) 100—1.180±0.0062.341±0.2481.985±0.213# 1000.0011.179±0.0044.881±0.1944.141±0.190 10—1.173±0.0021.746±0.2751.488±0.236## 100.0011.179±0.0044.921±0.1124.172±0.103 1—1.176±0.0041.548±0.1191.316±0.097## 10.0011.176±0.0054.643±0.0973.949±0.099 化合物c组 1000—1.177±0.0041.587±0.3001.349±0.258## 10000.0011.176±0.0043.056±0.0692.598±0.067 500—1.179±0.0071.548±0.2061.313±0.183 5000.0011.180±0.0072.937±0.0692.488±0.069 100—1.176±0.0051.508±0.3831.283±0.330 1000.0011.183±0.0022.976±0.1192.516±0.100 10—1.184±0.0021.429±0.2381.206±0.203 100.0011.178±0.0072.937±0.1372.492±0.118 1—1.183±0.0011.389±0.1821.174±0.154 10.0011.184±0.0052.778±0.1822.346±0.145 化合物d组 1000—1.174±0.0011.825±0.1371.555±0.119## 10000.0011.182±0.0013.056±0.0692.585±0.056 500—1.180±0.0061.587±0.0691.345±0.056 5000.0011.179±0.0062.857±0.1192.423±0.110 100—1.181±0.0021.508±0.1821.277±0.152 1000.0011.184±0.0012.817±0.0692.380±0.056 10—1.179±0.0051.429±0.1191.212±0.101 100.0011.180±0.0032.897±0.3442.455±0.295 1—1.179±0.0051.389±0.2481.178±0.215 10.0011.185±0.0032.817±0.1822.378±0.153
注:与盐酸二甲双胍比较,#P<0.05,##P<0.01;与染料木素最大给药剂量组比较,△P<0.05
参考文献:
[1]王玉芹,陈娜,阿吉艾克拜尔·艾萨,等.维药鹰嘴豆及活性部位降血糖作用研究[J].中成药,2007,29(12):1832.
[2]傅剑云,夏勇,孟佳,等.鹰嘴豆水提物降血糖作用的实验研究[J].浙江预防医学,2011,23(8):17-21.
[3]刘金宝,何桂香.鹰嘴豆异黄酮提取物对高脂血症小鼠血脂的影响[J].新疆医科大学学报,2005,28(6):524-525.
[4]李燕,巫冠中,张巨松,等.鹰嘴豆异黄酮提取物对糖尿病小鼠血糖和氧化-抗氧化态的效应[J].中国组织工程研究与临床康复,2007(38):7625-7629.
[5]凯赛尔·阿不都克热木,魏媛媛,李潇,等.鹰嘴豆总皂苷对2型糖尿病大鼠胰岛素抵抗及糖代谢的影响[J].中成药,2011,33(8):1405-1407.
[6]张金波,李利民,苗昊翠,等.鹰嘴豆异黄酮的药理作用研究进展[J].中外医疗,2013(12):6-7.
[7]凯赛尔·阿不都克热木.鹰嘴豆总皂苷对2型糖尿病大鼠的抗氧化作用[J].中药药理与临床,2012,28(3):154-156.
[8]邱海龙,汤彬,王玉,等.番荔枝子去蛋白多糖制备及其体外降糖作用研究[J].世界科学技术:中医药现代化,2013,15(6):1309-1313.
[9]姜斐,姚楠,钱士辉,等.女贞子中8个化合物对胰岛素抵抗HepG2细胞葡萄糖消耗的影响[J].海峡药学,2010,22(1):164-167.
[10]俞发荣,连秀珍,谢明仁,等.胰岛素抵抗细胞与大鼠模型的建立及其应用[J].中国实验动物学报,2013,21(6):74-78.
[11]曹莉,茅彩萍,顾振纶.葛根素对高胰岛素环境下大鼠肝细胞葡萄糖消耗的影响[J].中国血液流变学杂志,2007,17(2):215-216.
[12]张汝学,贾正平,李茂星,等.体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用[J].中国药理学通报,2008,24(7):971-976.
[13]穆颖,季爱玲,刘寒强,等.原代培养骨骼肌细胞胰岛素抵抗模型的建立[J].现代生物医学进展,2008,8(3):433.
[14]杨亮,迟戈,张俊,等.L6细胞胰岛素抵抗的骨骼肌细胞模型[J].中国组织工程研究与临床康复,2009,13(2):248-251.
Synergistic hypoglycemic activity in vitro of three kinds of isoflavone in chickpea and its bromine ethoxylated structure modification and insulin
SHI Xiaojuan1,2,3,LI Pengshou1,2,3,WEI Ying1,2,3,LI Bo1,2,3,WANG Dongchao1,2,3,XU Tunhai1,2,3*,LIU Tonghua2,3
(1.School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100029,China;2.Beijing Key Laboratory of Health-cultivation,Beijing 100029,China;3.Health-cultivation Laboratory,Ministry of Education,Beijing 100029,China)
Abstract:ObjectiveThrough the bromine ethoxylated structure modification of three isoflavones which was genistein,biochanin A,formononetin in chickpea,we studied the influence of glucose consumption of HepG2 cell and insulin-resistance of HepG2 cell and the synergistic effect with insulin.MethodsThe three kinds of isoflavones were modified by the bromine ethoxylated structure modification,and the effect of the glucose consumption of normal HepG2 cell was detected.We established the insulin-resistance of HepG2 cell as a screening model for hypoglycemic activity,and studied the hypoglycemic activity of these derivatives,and given the physiological insulin concentration to study the synergistic effect between them.ResultsFour derivatives of bromine ethoxylated derivatives were synthesized,and the compound B had good hypoglycemic activity,and the difference was not statistically significant (P>0.05) compared with the positive drug metformin hydrochloride.The parent compounds and its derivatives had synergistic effect with the insulin,and could increase the activity of the hypoglycemic activity of the compounds obviously.ConclusionThe isoflavone derivatives with good hypoglycemic activity were obtained by the bromine ethoxylated structure modification,and it can be synergistic with insulin.It would provide reference for the research and development of innovative hypoglycemic agents based on traditional Chinese medicine.
Keywords:chickpea;isoflavone;structure modification;HepG2 cell;hypoglycemic activity
(收稿日期:2015-06-26)
文章编号:2095-6258(2016)01-0028-06
中图分类号:R284.3
文献标志码:A
*通信作者:徐暾海,教授,博士研究生导师,电话-(010)64286935,电子信箱-hxu@yahoo.com
作者简介:时晓娟(1990-),女,硕士研究生,主要从事中药降糖活性成分研究。
基金项目:科学技术部国家国际科技合作项目“中医药干预治疗胰岛素抵抗创新中药研究”(2010DFB33260);北京市教育委员会共建项目“中药干预胰岛素抵抗技术平台建设与方药筛选研究”(2011);北京中医药大学创新团队项目(2011-CXTD-19)。
DOI:10.13463/j.cnki.cczyy.2016.01.009
