miR-21调节缺血缺氧诱导的大鼠肝卵圆细胞自噬的研究
2016-03-30高胜强陈冬冬黄立栋戴瑞杰胡伟建余华军张启瑜单云峰温州医科大学附属第一医院肝胆外科浙江温州325000
高胜强,陈冬冬,黄立栋,戴瑞杰,胡伟建,余华军,张启瑜,单云峰(温州医科大学附属第一医院肝胆外科,浙江温州325000)
miR-21调节缺血缺氧诱导的大鼠肝卵圆细胞自噬的研究
高胜强,陈冬冬,黄立栋,戴瑞杰,胡伟建,余华军,张启瑜,单云峰
(温州医科大学附属第一医院肝胆外科,浙江温州325000)
[摘 要]目的 探讨miR-21在缺血缺氧诱导的大鼠肝卵圆细胞自噬中的作用。方法 体外培养肝卵圆细胞,慢病毒转染肝卵圆细胞构建稳定的细胞株,分别提取各组细胞RNA逆转录后行SYBR Green实时荧光定量PCR,检测各组miR-21的表达,以转染好的稳定的细胞建立缺血缺氧模型,共分为3组:miR-21空载体慢病毒转染HOC自噬组,miR-21增强慢病毒载体转染HOC自噬组,miR-21-inhibition慢病毒载体转染HOC自噬组。Hoechst 33258染色观察细胞凋亡;应用丹(磺)酰戊二胺(Monodansylcadaverine,MDC)染色荧光定位法、观察各组细胞的自噬;免疫印迹法(Western blotting)检测各组细胞LC3-II/I蛋白表达情况。结果与空载体组比,增强组miR-21基因水平表达增强,而MDC染色减弱(自噬减少),蛋白LC3-II/LC3-I的比值减少;而抑制组miR-21基因水平表达减少,MDC染色增强(自噬增强),蛋白LC3-II/LC3-I的比值增多。结论 抑制miR-21过表达可以增强缺血缺氧引起的肝卵圆细胞的自噬,有利于肝卵圆细胞在缺血缺氧微环境中稳定细胞内环境,维持细胞的存活。
[关键词]microRNA-21;自噬;肝卵圆细胞
Research of miR-21 on ischemia and hypoxia-induced autophagy modulation in rat hepatic oval cell GAO Sheng-qiang, CHEN Dong-dong, HUANG Li-dong, DAI Rui-jie, HU Wei-jian, YU Hua-jun, ZHANG Qi-yu, SHAN Yun-feng.Department of Hepatobiliary Surgery, the First Af■liated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang 325000, China
Abstract ObjectiveTo investigate the role of miR-21 in ischemia-thypoxiainduced autophagic model of rat hepatic oval cells.MethodsHepatic oval cells were cultured in vitro and a stable hepatic oval cells line was constructed by lentivirus (miR-21 enhanced lentivirus; miR-21 inhibited lentivirus; vector lentivirus).The RNA was extracted from each group and reverstranscripted, then SYBR real-time PCR was conducted to detect the miR-21 expression.Simulated ischemia and hypoxia of transfected HOCs (hepatic oval cells) as an in vitro model of ischemic-hypoxic microenvironment were employed in this study.Hoechst 33258 staining was used to determine cell apoptosis.MDC (Monodansylcadaverine)-labeled autophagic vacuoles were observed under ■uorescent inverted phase contrast microscopy in HOC.The expression of LC3 and the result of LC3-I converted to LC3-II was detected with Western blotting.ResultsCompared with the empty vector group, the expression of miR-21 was increased in enhanced group and decreased in inhibited group; Compared with the empty vector group, enhanced group MDC staining was decreased, and protein LC3-II/LC3-I was reduced.Compared with the empty vector, inhibited group MDC staining was enhanced, and the ratio of protein LC3-II/LC3-I was increased.Conclusion Inhibition of miR-21 expression can enhance autophagy in ischemia-hypoxiainduced model.Autophagy of HOC can be induced by the ischemic and hypoxic microenvironment and maintain survival and the stability of cells.
Key words microRNA-21; autophagy; hepatic oval cell
肝卵圆细胞被认为是原始的兼性多能干细胞,目前普遍认为卵圆细胞位于小叶间胆管或Hering管,即终末胆管,也是门静脉周围肝细胞和胆管细胞的过渡区域。自噬(autophagy)是将细胞内受损、变性或者衰老的蛋白质以及受损细胞运输到溶酶体进行消化降解的过程,是细胞应对营养缺乏、细胞密度负荷、低氧、氧化应激、感染等恶劣环境的生存方式之一。microRNAs(miRNAs)是一类新发现的在进化上高度保守的非编码小RNAs,长约19-22nt,在转录后水平调控基因的表达,广泛参与发育、器官形成、凋亡、增殖,甚至是肿瘤发生等重要生命过程。miR-21目前研究最多的miRNAs之一,它定位于人类第17q染色体区域,通过诱导S期细胞周期调节,在肝再生的增殖期上调,显著促进细胞增殖。miRNAs通过调控自噬相关基因的表达,从而发挥对自噬的调节作用,miRNAs在调控自噬的发生过程中,大多为抑制自噬发生,也有少部分miRNAs能激活自噬。LC3是检测自噬现象的特异性标记分子,LC3-II/LC3-I反映自噬程度。
1 材料和方法
1.1材料
大鼠肝卵圆细胞(HOC)购自中科院上海细胞库;丹(磺)酰戊二胺(Monodansylcadaverine,MDC)、微管相关蛋白1轻链3β(LC3B)蛋白多克隆抗体、兔抗鼠GAPDH单克隆抗体购自美国Sigma公司;DMSO(北京索莱宝公司);CCK-8(日本同仁化学公司);胎牛血清、1640培养液、PBS(GIBCO公司);Hoechst33258染色液、BCA法蛋白定量试剂盒(上海碧云天生物技术研究所);密封培养罐、AnaeroPack(安宁包)产气袋和氧气指示剂(日本三菱瓦斯化学株式会社);RNA提取试剂Trizol购自美国invitrogen公司;逆转录试剂盒、SYBR Green Realtime PCR Master Mix-Plus-购自日本Toyobo公司;GAPDH购自中国杭州贤至生物科技有限公司;miR-21增强慢病毒载体、miR-21-inhibition慢病毒载体、miR-21慢病毒空载体由上海吉凯基因化学技术有限公司构建;Marker、ECL发光液购自美国Thermo公司;7500型实时荧光定量PCR仪购自美国ABI公司;ChemiDoc XRS仪器购自BIO-RAD公司。
1.2方法
1.2.1 细胞培养:大鼠肝卵圆细胞接种于含1%青链霉素、10%胎牛血清的1640培养液中,置于CO2培养箱中培养,细胞贴壁生长至对数生长期后,细胞计数后置入缺血缺氧微环境中进行试验。
1.2.2 慢病毒转染:以4×104个/mL HOC接种到96孔板中,等到细胞融合度达到30%进行慢病毒载体转染,选用复感染指数(MOI值)为100,每个孔100 μL:慢病毒载体10 μL,慢病毒感染增强液80 μL,Polybrene液(50 μg/mL)10 μL。混匀后继续培养,12 h后观察细胞状态,更换新鲜培养基,继续培养。
1.2.3 慢病毒转染HOC后稳定细胞株的筛选:将待筛选细胞接种于48孔板中至70%~80%融合度,待细胞贴壁后,加入嘌呤霉素(0,1,2.5,5,10 μg/mL)进行筛选。得出药物处理48 h后细胞全部死亡的最低药物浓度是5 μg/mL,将细胞种植在24孔板中,贴壁后进行慢病毒感染,感染第2天,加入嘌呤霉素药物筛选,筛选后的细胞即时观察荧光以确定获得感染效率100%的细胞。
1.2.4 缺血缺氧模型:将慢病毒转染好的肝卵圆细胞接种于培养皿,当细胞密度达到80%~90%时,换成无血清1640培养基,放入密封培养罐后迅速放入安宁包产气袋一袋和氧气指示剂一枚,密封,45 min后开始计时。
1.2.5 RNA的提取和逆转录:取三组长满细胞的六厘米培养皿,同时每组加入1 mL Trizol,在冰上中静置5 min后,用枪头吹打细胞后移至离心管中,静置5 min,按照invetrogen公司Trizol试剂说明书提取RNA。以所提总RNA为模版,分别进行RT反应,反应体系如下:总RNA 1 μL加入Enzyme Mix 0.5 μL、Buffer 2 μL、逆转录U6引物1 μL、miR-21茎环引物1 μL,补充Nuclease-free Water至10 μL。反应条件:37 ℃ 15 min,98 ℃ 5 min。
1.2.6 实时荧光定量PCR检测miR-21表达:根据miRBase数据库(http://www.mirbase.org/)获得成熟miRNA序列,并用Primer5软件设计相应的逆转录和PCR扩增引物,由上海生工生物股份有限公司合成。miR-21逆转录茎环引物5'-GTCGTATCCAGTGCA GGGTCCGAGGTATTCGCACTGGATACGACTCAACA-3',实时荧光定量PCR前向引物为5'-GCGGCGGTAGCTTATCAGAC TG-3',反向引物为茎环引物上的一段片段,为5'-ATC CAGTGCAGGGTCCGAGG-3'。内参U6逆转录引物为:5'-CG CTTCACGAATTTGCGTGTCA-3',实时荧光定量U6引物为Fp-5'-GCTTCGGCAGCACATATACTAAAAT-3',Rp-5'-CG CTTCACGAATTTGCGTGTCAT-3'。所得逆转录产物稀释10倍后行荧光定量PCR,反应体系为:模版1 μL,SYBRqPCR Mix液5 μL,miR-21引物和负链引物各1 μL(浓度均为1 μmol/L),Plus solution 1 μL,补充水至10 μL,以U6为内参。反应条件为:95 ℃ 1 min预变性,95 ℃ 15 s、60 ℃ 15 s和72 ℃ 45 s,40个循环,采用2-△△CT法计算不同组织中miR-21的相对表达量。
1.2.7 MDC荧光染色:取细胞爬片,移去培养液,PBS洗2次,重新加入含有50 μmol/LMDC的培养基在37 ℃孵育1 h后,弃培养基,PBS洗三遍,抗荧光淬灭剂于载玻片上封片,置于DM4000 B LED荧光正置显微镜上,用380 nm波长的激发光525 nm波长的发射光滤光片进行观察。
1.2.8 Hoechst 33258染色:取细胞爬片,弃培养液,4%多聚甲醛固定15 min,PBS洗两次,Hoechst 33258染色5 min,PBS洗两次,滴加抗荧光淬灭剂于载玻片上封片,荧光显微镜观察,并随机选取视野拍照。1.2.9 Western blotting:分别提取各组细胞蛋白,BCA法测定蛋白浓度,选择10% SDS-PAGE凝胶,30 μg上样量进行电泳,80 V恒压至样品进入分离胶后改120 V恒压至电泳结束,350 mA恒流60 min转膜后,用含5%脱脂奶粉TBST常温封闭90 min,4 ℃摇床孵育一抗过夜(抗体稀释浓度为LC3B为1:1 000,GAPDH 为1:500)。TBST洗膜三次后,以1:5 000浓度加入二抗至牛奶,室温孵育1 h后,TBST洗三次,加入ECL,ChemiDoc XRS仪器曝光,并采用Image Lab对其进行分析。
1.3统计学分析

图1 细胞转染图片(×100)
2 结果
2.1慢病毒转染情况
由图1可见慢病毒转染效率达95%以上。
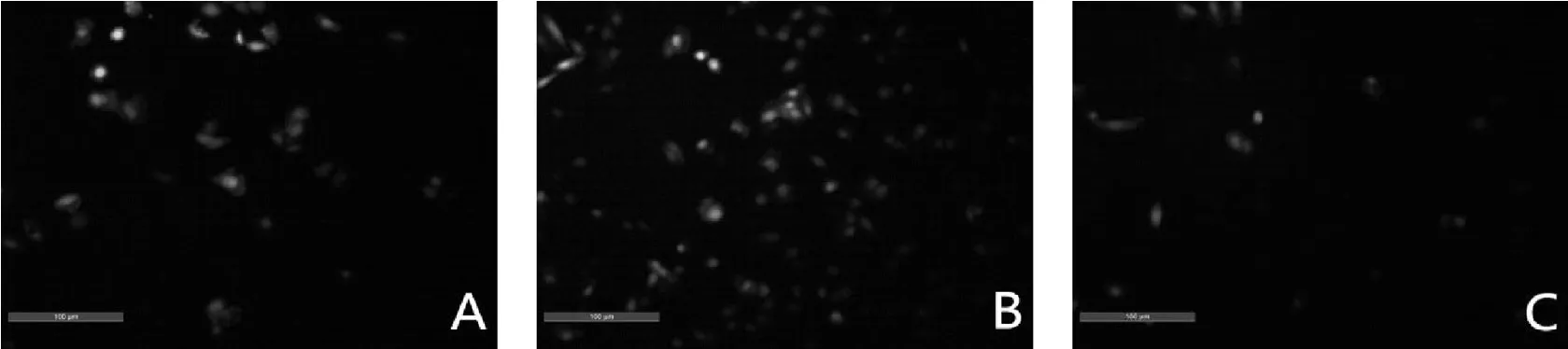
图2 Hoechst 33258染色图片(×100)

图3 MDC染色图片(×100)
2.2Hoechst 33258染色检测细胞凋亡情况
相对于空载体对照细胞,miR-21增强慢病毒转染的细胞染色增多(凋亡增多),miR-21-inhibition慢病毒转染的细胞染色减少(凋亡减少),见图2。
2.3MDC染色检测细胞自噬
相对于空载体对照细胞,miR-21增强慢病毒转染的细胞染色减少(自噬减少),miR-21-inhibition慢病毒转染的细胞染色增多(自噬增多),见图3。
2.4实时荧光定量PCR检测miR-21
采用2-△△CT法计算出不同标本中miR-21的相对表达量,如图4所示。
2.5Western blotting检测LC3-II和LC3-I蛋白
Western blotting观察到,相对于空载体对照细胞,miR-21增强慢病毒转染的细胞LC3-II与LC3-I的比值降低,miR-21-inhibition慢病毒转染的细胞LC3-II与LC3-I的比值增加(图5)。
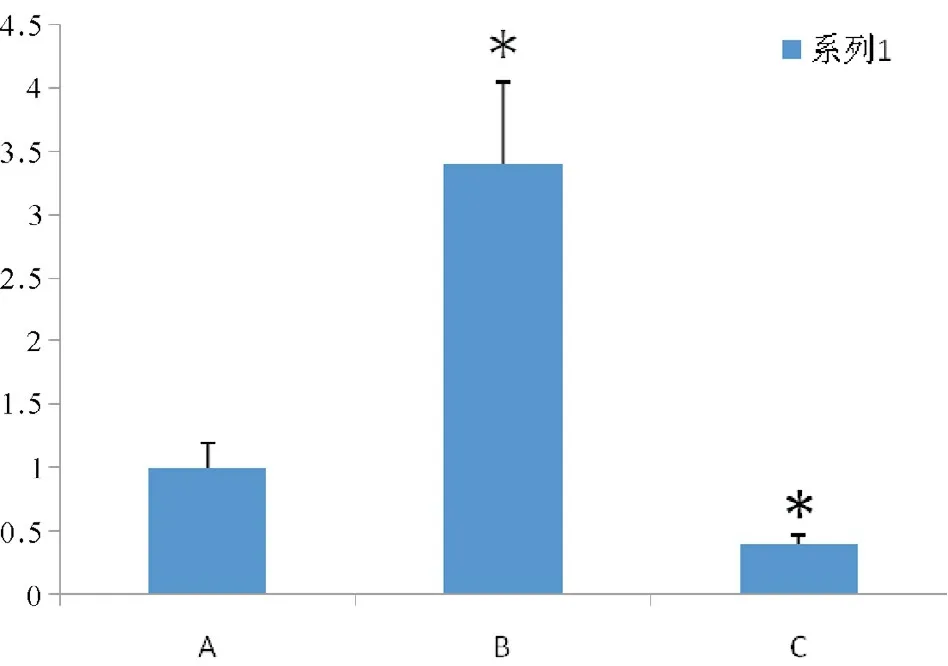
图4 miR-21基因表达情况图片
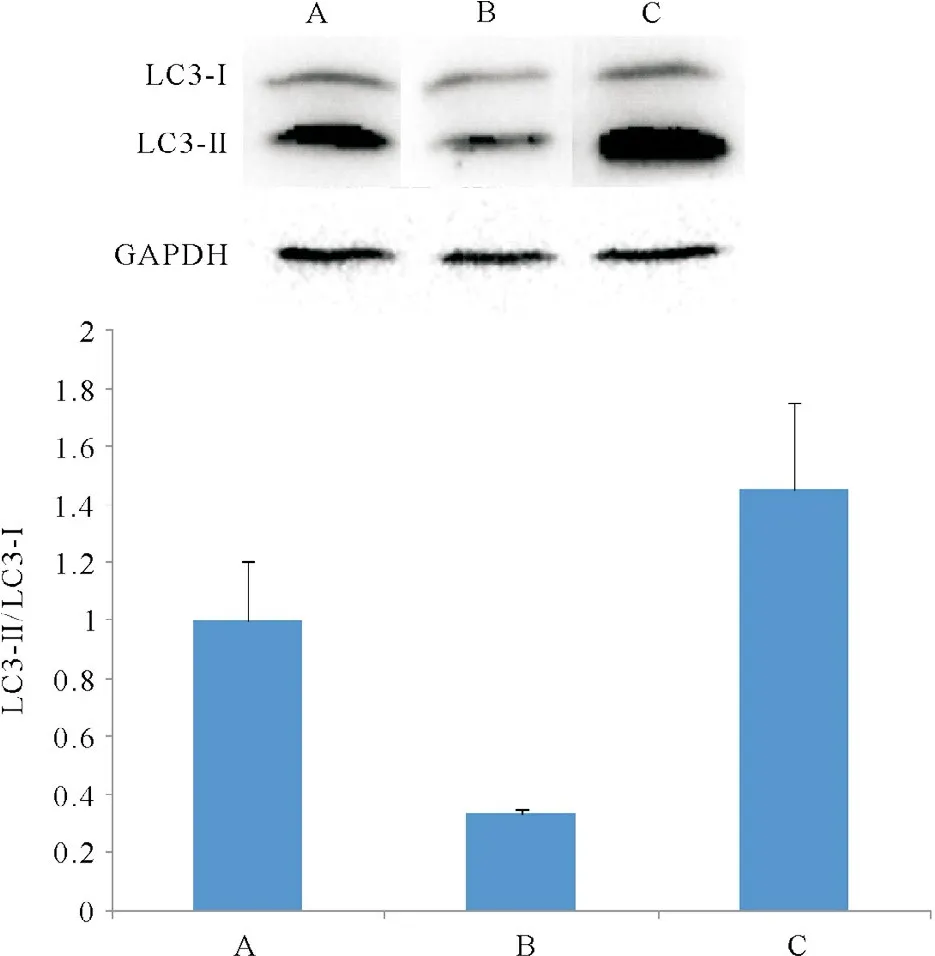
图5 Western blotting检测LC3蛋白图片
3 讨论
当肝脏受到严重损伤,肝细胞大量缺失或者肝细胞增殖受到毒素或者致癌因子的抑制时,就会激活肝卵圆细胞。肝卵圆细胞同时具有胆管细胞与肝细胞的表型,且可进一步分化为肝细胞及胆管上皮细胞,因而认为其是一种原始的兼性多功能干细胞[1]。目前普遍认为卵圆细胞位于小叶间胆管或Hering管,即终末胆管,也是门静脉周围肝细胞和胆管细胞的过渡区域。
自噬(autophagy)是一种进化保守的溶酶体依赖的自身降解途径,是细胞在遇到应激反应等刺激时,将细胞质内多余的蛋白质或损伤的细胞器等物质包绕至自噬体中并与溶酶体结合将其降解的过程。自噬几乎存在于所有真核细胞,不仅参与维持细胞内环境稳定及生长、分化的重要过程,而且是细胞面临饥饿、生长因子匮乏等应激环境的应对策略[2]。根据其生理功能和自噬体与溶酶体的结合方式,将自噬分为3种类型:巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperonmediated autophage),其中以巨自噬的研究最为成熟[3-4]。段文彪等[5]研究得出缺血缺氧可以抑制肝卵圆细胞增殖,并且可诱导肝卵圆细胞自噬。自噬有利于肝卵圆细胞在缺血缺氧微环境中稳定细胞内环境,维持细胞的存活。微管相关蛋白1轻链3(LC3)蛋白有两种形式:LC3-I和LC3-II,细胞自噬体形成过程中,LC3-I可以转化为LC3-II。LC3-II含量的多少与自噬体的含量有关,自噬体膜的含量由LC3-II标记[6],在自噬形成中,LC3-I与LC3-II/LC3-I比例与自噬体数量有关[7]。LC3-II/LC3-I的比值与自噬呈正相关。
microRNAs(miRNAs)是一类新发现的在进化上高度保守的非编码小RNAs,长约19~22 nt在转录后水平调控基因的表达[8]。miR-21参与发育、再生及其干细胞生物学中有发挥重要作用,Marquez等[9]切除小鼠的部分肝脏,发现和肝切除术前相比,切除术后小鼠肝脏miR-21的表达在12、24 h达到高峰(超过正常2倍),提示miR-21在肝再生早期可能参与基因表达调控。陈桢坤等[10]证实了miR-21在肝卵圆细胞活化与增殖中起重要作用,Smad7作为miR-21的靶基因可能参与这一过程。
miRNA也被发现在自噬调节中扮演了关键的角色,在自噬的启动(induction)、囊泡成核(vesicle nucleation)、囊泡延伸(vesicle elongation)、自噬回收(retrieval)与囊泡融合(fusion)等几个阶段中均有miRNA参与调控[11]。研究表明miRNAs能调节一些Atgs基因,而且调控子存在于自噬过程的不同阶段[12]。Zhu等[13]首次揭示了miRNA与细胞自噬之间的联系:miR-30a负调节自噬关键蛋白Beclin 1表达,引起自噬水平下降。miRNAs在调控自噬的发生过程中,大多为抑制自噬发生,也有少部分miRNAs能激活自噬。抑制自噬发生的相关miRNAs如miR-375在人类肝癌细胞中表达下调,转染miR-375后能下调自噬相关基因Atg7信使RNA及蛋白表达水平,Atg7参与LC3I向LC3II的转变所必需的Atg10和Atg12、Atg3和LC3复合物形成过程,当Atg7下调时自噬溶酶体的形成受阻,阻断了自噬的发生,从而避免肿瘤治疗中自噬引起的耐药[14]。miR-100[15]、miR-18a[16]、miR-7[17]等都促进自噬的发生。
本实验成功构建了肝卵圆细胞miR-21慢病毒转染模型,Hoechst 33258染色miR-21增强慢病毒转染的细胞染色增多(凋亡增多),miR-21-inhibition慢病毒转染的细胞染色减少(凋亡减少),MDC染色miR-21增强慢病毒转染的细胞染色减少(自噬减少),miR-21-inhibition慢病毒转染的细胞染色增多(自噬增多)。miR-21过表达在本文中证实抑制HOC的自噬,抑制miR-21过表达可以增强缺血缺氧引起的肝卵圆细胞的自噬,有利于肝卵圆细胞在缺血缺氧微环境中稳定细胞内环境,维持细胞的存活,具体可能机制有待进一步研究。Lu等[18]研究miR-21的过表达能上调PTEN表达,抑制P13K-Akt-mTOR信号通路异常活化,抑制自噬。我们以miRNA为突破点研究肝卵圆细胞的自噬,为研究自噬提供一种新的思路。
参考文献:
[1]FELDMANN G.Liver transplantation of hepatic stem cells:potential use for treating liver diseases[J].Cell Biol Toxicol, 2001, 17(2):77-85.
[2]TSUCHIHARA K, FUJII S, ESUMI H.Autophagy and cancer:dynamism of the metabolism of tumor cells and tissues[J].Cancer Lett, 2009, 278(2):130-138.
[3]MEHRPOUR M, ESCLATINE A, BEAU I, et al.Autophagy in health and disease.1.Regulation and significance of autophagy:an overview[J].AM J physid Cell Physiol, 2010, 298(4):C776-785.
[4]TANIDA I.Autophagosome formation and molecular mechanism of autophagy[J].Antioxid Redox Signal, 2011, 14(11):2201-2214.
[5]段文彪, 高胜强, 周春光, 等.自噬对肝卵圆细胞在缺血缺氧微环境中增殖的影响[J].肝胆胰外科杂志, 2015, 27(1):37-41.
[6]KABEYA Y, MIZUSHIMA N, UENO T, et al.LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J].EMBO J, 2000, 19(21):5720-5728.
[7]REN J H, HE W S, NONG L, et al.Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy[J].Cancer Biothe Radiopharm, 2010, 25(1):75-80.
[8]BARTEL D P.MicroRNAs:genomics, biogenesis, mechanism, and function[J].Cell, 2004, 116(2):281-297.
[9]MARQUEZ R T, WENDLANDT E, GALLE C S, et al.MicroRNA-21 is upregulated during the proliferative phase of liver regeneration, targets Pellino-1, and inhibits NF-kappaB signaling[J].Am J Physiol Gastrointest Liver physiol, 2010, 298(4):G535-541.
[10]陈桢坤, 单云峰, 何彬, 等.miR-21在大鼠肝卵圆细胞活化和增殖过程中作用研究[J].中华肝脏病杂志, 2014, 22(11):854-859.
[11]HE C, KLIONSKY D J.Regulation mechanisms and signaling pathways of autophagy[J].Annu Rev genet, 2009, 43:67-93.
[12]XIAO J, ZHU X, HE B, et al.MiR-204 regulates cardiomyocyte autophagy induced by ischemia-reperfusion through LC3-II[J].J Biomed Sci, 2011, 18:35.
[13]ZHU H, WU H, LIU X, et al.Regulation of autophagy by a beclin 1-targeted microRNA, miR-30a, in cancer cells[J].Autophagy, 2009, 5(6):816-823.
[14]CHANG Y, YAN W, HE X, et al.miR-375 inhibits autophagy and reduces viability of hepatocellular carcinoma cells under hypoxic conditions[J].Gastroenterol, 2012, 143(1):177-187 e8.
[15]GE Y Y, SHI Q, ZHENG Z Y, et al.MicroRNA-100 promotes the autophagy of hepatocellular carcinoma cells by inhibiting the expression of mTOR and IGF-1R[J].Oncotarget, 2014, 5 (15):6218-6228.
[16]QASED A B, YI H, LIANG N, et al.MicroRNA-18a upregulates autophagy and ataxia telangiectasia mutated gene expression in HCT116 colon cancer cells[J].Mol Med Rep, 2013, 7 (2):559-564.
[17]TAZAWA H, YANO S, YOSHIDA R, et al.Genetically engineered oncolytic adenovirus induces autophagic cell death through an E2F1-microRNA-7-epidermal growth factor receptor axis[J].Int J Cancer, 2012, 131(12):2939-2950.
[18]LU X, FAN Q, XU L, et al.Ursolic acid attenuates diabetic mesangial cell injury through the up-regulation of autophagy via miRNA-21/PTEN/Akt/mTOR suppression[J].PloS one, 2015, 10(2):e0117400.
(本文编辑:张和,鲁翠涛)
·论著 基础研究·
[通讯作者简介]单云峰,主任医师,副教授,博士,硕士生导师,E-mail:shanyfeng@126.com。
作者简介][第一高胜强(1990-),男,安徽马鞍山人,在读硕士。
[基金项目]浙江省自然科学基金项目(LY12H03006);温州市科委课题(Y20110078)。
[收稿日期]2015-08-17
[中图分类号]R329.2+6
[文献标识码]A
DOI:10.11952/j.issn.1007-1954.2016.01.011
