气相色谱法测定齐拉西酮冻干粉针剂中叔丁醇残留量
2016-03-27张李巧李子君
张李巧,李子君
(1.四川省成都市妇女儿童中心医院,四川 成都 610091; 2.湖南省岳阳市食品药品检验所,湖南 岳阳 414000)
气相色谱法测定齐拉西酮冻干粉针剂中叔丁醇残留量
张李巧1,李子君2
(1.四川省成都市妇女儿童中心医院,四川 成都 610091; 2.湖南省岳阳市食品药品检验所,湖南 岳阳 414000)
目的 建立测定齐拉西酮冻干粉针剂中叔丁醇残留量的气相色谱法。方法 采用PEG-20M毛细管柱(30 m×0.32 mm,0.50 μm),采用外标法定量,考察叔丁醇对照品的检测限、标准曲线、加样回收率及稳定性,并对不同批次的齐拉西酮冻干针剂中叔丁醇残留量进行考察。结果 叔丁醇质量浓度在20~400 μg/mL范围内与峰面积线性关系良好(r=0.999 3),最低检出限为0.010 μg/mL;高、中、低3种质量浓度的加样回收率为97.15%,101.54%,101.86%,精密度及回收率的 RSD均小于1.5%。结论 该方法灵敏,重现性良好,系统适用性良好,可用于测定齐拉西酮冻干粉针剂中叔丁醇残留量。
叔丁醇;齐拉西酮;气相色谱法;残留量
齐拉西酮是新型抗精神病药物,对5-羟色胺2(5-HT2)受体和多巴胺 D2受体有拮抗作用[1]。制备注射用齐拉西酮冻干粉针剂的过程中,加入了质量分数约为0.1%的叔丁醇作为冻干溶剂,形成了叔丁醇-水共溶剂体系,经冻干工艺处理后,产品中有微量的叔丁醇残留。按照《化学药物残留溶剂研究的技术指导原则》[2]和2010年版《中国药典(二部)》制剂项下规定,应对注射给药制剂进行有机溶剂残留量的测定,保证用药安全。已有测定齐拉西酮原料药中有机溶剂残留量的气相色谱法[3]。因此,笔者建立了测定齐拉西酮冻干粉针剂中叔丁醇残留量的毛细管气相色谱法,对样品中叔丁醇的残留量进行质量控制,现报道如下。
1 仪器与试药
Agilent 7820N型气相色谱仪(G4350型,配FID检测器);BS110S型电子天平(德国Sartorius公司)。叔丁醇对照品(分析纯,批号为20130410,天津市科密欧化学试剂有限公司,含量≥99.0%,不挥发物≤0.01%,游离酸≤0.01%);氩气(99.999%);甘露醇(批号为20140530,罗盖特上海有限公司);水为娃哈哈纯净水;齐拉西酮冻干粉针剂(自制,批号为 20150104,20150114,20150122,20150205,20150210)。
2 方法与结果
2.1 色谱条件
PEG-20M型毛细管色谱柱(Welch,30 m×0.32 mm,0.50 μm);采用程序升温,初始温度60℃,保持2.5 min,以20℃ /min的速率升温至180℃,保持5 min;流速:1.00 mL/min;分流比:1∶1;进样量:1.0 μL;检测器温度:250℃;进样口温度:200℃。
2.2 溶液制备
取叔丁醇约80 mg,精密称定,置10 mL容量瓶中,加纯净水溶解并稀释至刻度,摇匀;再精密量取1 mL该溶液,至100 mL容量瓶中,用纯净水稀释至刻度,摇匀,即得对照品溶液。称取样品约15 mg,置100 mL容量瓶中,加纯净水溶解,制成每1 mL中相当于含齐拉西酮约1.5 mg的溶液,摇匀,经0.22 μm滤膜过滤,滤液作为供试品溶液。称取甘露醇约80 mg,精密称定,置10 mL容量瓶中,加纯净水溶解并稀释至刻度,摇匀。再精密量取1 mL,移至100 mL容量瓶中,加水稀释至刻度,摇匀,即得甘露醇水溶液。
2.3 方法学考察
专属性考察:分别吸取空白溶剂、甘露醇水溶液、叔丁醇对照品溶液及供试品溶液各1 μL,注入气相色谱仪,按拟订的色谱条件测定。结果见图1。可见叔丁醇保留时间约为3.5 min,样品中其他杂质及溶剂不干扰叔丁醇的测定。

图1 气相色谱图
线性关系考察:取叔丁醇约20 mg,精密称定,置10 mL容量瓶中,加水溶解并稀释至刻度,摇匀,制得质量浓度为2 g/L的叔丁醇标准贮备液。精密量取叔丁醇标准贮备液1,1,2,1,2 mL,分别置100,25,25,10,10 mL容量瓶中,用水溶解并稀释至刻度,摇匀,配制成质量浓度分别为20.0,80.0,160.0,200.0,400.0 μg/mL系列叔丁醇标准溶液。依法测定峰面积,以峰面积(X)为横坐标、质量浓度(Y)为纵坐标进行线性回归,得回归方程 Y=0.000 3 X+5.979 1,r=0.999 3。结果表明,叔丁醇质量浓度在 20~400 μg/mL范围内与峰面积线性关系良好,最低检出限为0.010 μg/mL。
加样回收试验:取质量浓度为0.4,0.8,2.0 g/L的叔丁醇对照品溶液1 mL,各3份,加入10 mL容量瓶中,依次加入9份已知叔丁醇含量的样品,加入适量纯化水,充分振摇使完全溶解,用水稀释至刻度,摇匀,滤过,精密量取续滤液1 μL注入气相色谱仪,依法测定。结果见表1。
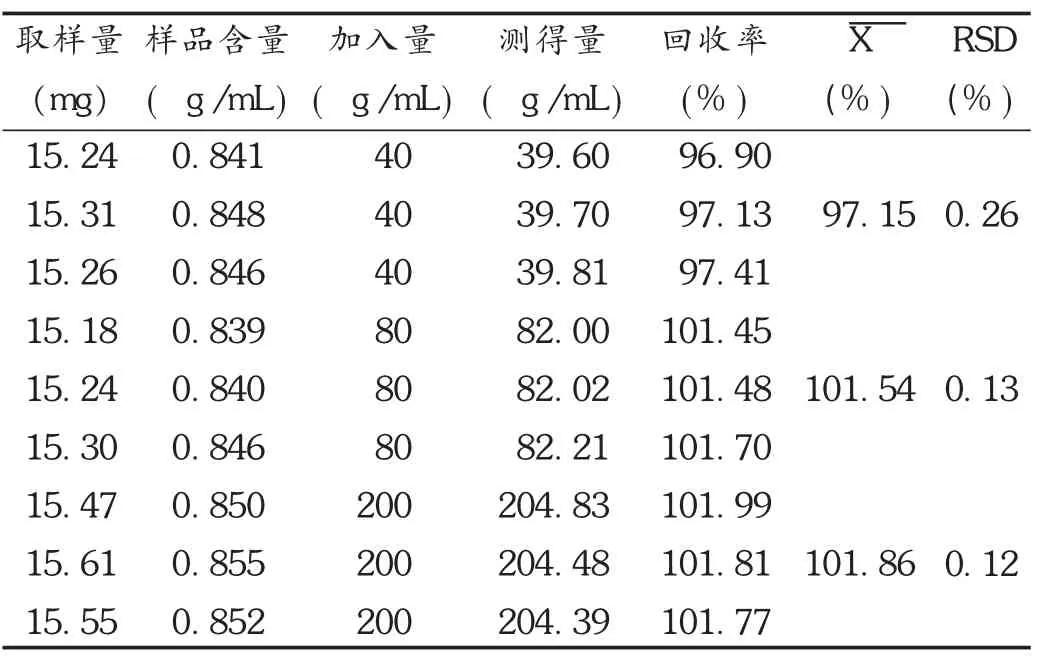
表1 叔丁醇加样回收试验结果(n=9)
稳定性试验:取同一供试品溶液,于0,2,4,8,12,14 h时取1 μL注入气相色谱仪,记录叔丁醇的色谱峰面积。结果的 RSD为0.12%(n=6),表明室温条件下供试品溶液在24 h内稳定。
精密度试验:精密量取质量浓度为80 μg/mL的对照品溶液1 μL,注入气相色谱仪,按拟订色谱条件测定,记录色谱图,重复进样6次,计算叔丁醇的峰面积。结果的 RSD为0.11%(n=6),表明仪器精密度良好。
2.4 样品含量测定
取样品依法测定,平行操作6次。结果批号为20150104,20150114,20150122,20150205,20150210的样品中叔丁醇残留量分别为0.85%,0.81%,0.88%,0.86%,0.81%。本试验制订叔丁醇的残留限度标准为应不超过1.5%。
3 讨论
色谱柱的选择:由于分离强极性溶剂,采用强极性柱分离效果理想,其色谱峰峰形良好,系统方法重复性良好,而中等极性柱和弱极性柱则峰形差。故本试验中选用强极性柱PEG-20M毛细管柱用于样品分析。
提取溶剂的选择:叔丁醇易溶于水、甲醇、乙醇,极性极强,且在水溶液中稳定性较好,而乙醇挥发性较强,故将本品溶解、分散于水中进行测定。
叔丁醇安全性与浓度限度的研究[4]:在制备注射用甲磺酸齐拉西酮冻干粉针制剂过程中使用了叔丁醇水溶液为溶剂,在成品中有微量残留。叔丁醇残留测定在《欧洲药典》和2010年版《中国药典(二部)》中均未收载,无法查阅叔丁醇限度的相关数据。在制订本品叔丁醇限度标准时,通过查阅文献资料,讨论其浓度限度及其临床安全性,并根据后期毒性研究试验结果对现暂订叔丁醇质量浓度限度标准作进一步修订。
[1]潘令仪,仇剑蓥.一种新的抗精神病药物齐拉西酮[J].药物流行病学杂志,2009,9(1):12-14.
[2]《化学药物残留溶剂研究技术指导》课题研究组.化学药物残留溶剂研究的技术指导原则[Z].2005-03-18.
[3]陈 钧,江文明,蒋新国.甲磺酸齐拉西酮中有机溶剂残留量的GC测定[J].中国医药工业杂志,2004,35(11):67-69.
[4]European Medicines Agency.ICH Topic Q3C(R4)Impurities Guideline for Residual Solvents[Z].2009-02.
Invenstigation of Tert-butyl Alcohol Residue in Ziprasidone Freeze-Dried Powder Injection by Gas Chromatography
Zhang Liqiao1,Li Zijun2
(1.Women& Children Central Hospital,Chengdu,Sichuan,China 610091; 2.Yueyang Food and Drug Inspection Institute,Yueyang,HuNan,China 414000)
Objective To establish the gas chromatography method to determine the tert-butyl alcohol residue in Ziprasidone Freeze-Dried Powder Injection.Methods PEG-20M capillary column(30 m×0.32 mm,0.50 μm)was used with external standard measurement.The detection limits,standard curve,recovery rate and stability of the reference substance of Tert-butyl alcohol was detected by gas chromatography,and the residue of Tert-butyl in different batches of Ziprasidone freeze-dried powder injection was investigated.Results The mass concentration of tert-butyl alcohol in the range of 20-400 μg/mL had good linear relationship with the peak area(r=0.999 3),the detection limit was 0.010 μg/mL,the recovery was 97.15%,101.54%,101.86%,and the precision and recovery RSD<1.5%.Conclusion This method is sensitive with good reproducibility and good system suitability,and is suitable for the determination of the tert-butyl alcohol residue in Ziprasidone Freeze-Dried Powder Injection.
tert-butyl alcohol;ziprasidone;gas chromatography;residue
R927.11;R971+.41
A
1006-4931(2016)03-0047-03
张李巧(1989-),女,硕士研究生,药师,主要研究方向为临床合理用药,(电子信箱)zhangliqiao1989@126.com;李子君(1985-),女,大学本科,主管中药师,主要从事药品质量标准研究,本文通讯作者,(电子信箱)kylinlee666@163.com。
2015-07-31)
