HPLC-ESI-MSn分析不同品种山葡萄中花色苷成分
2016-03-26刘炎黄鑫杨义明艾军
刘炎,黄鑫,杨义明,艾军※
(1.中国农业科学院特产研究所,长春?130112;?2.长春中医药大学吉林省人参科学研究院,长春?130117)
山葡萄(VitisamurensisRupr.)又名野葡萄、山浮桃、蛇葡萄等,起源于中国东北、俄罗斯远东地区,目前,主要分布于我国吉林、辽宁、黑龙江等东北地区,其资源丰富且品种众多。山葡萄中含有十分丰富的多酚类成分,具有很强的抗氧化、保护心血管及神经系统、降血脂、抗癌、抑菌、延缓衰老等药理作用[1~3]。花色苷类成分是山葡萄中多酚类成分的主要组成部分,是其中含量较高的成分,也是功能性成分之一。山葡萄中的花色苷分布于果皮、果肉、葡萄籽中,果皮中含量最高[4,5]。花色苷是由花色素和糖形成的糖苷,在花色素A环3位上结合1个葡萄糖后形成单糖苷,在3位和5位上分别结合1个葡萄糖形成双糖苷[6]。目前,分离、分析山葡萄中花色苷的方法主要是高效液相色谱法和高效液相色谱-质谱联用法[7~11]。本实验建立了高效液相色谱-质谱联用法,对中国农业科学院特产研究所山葡萄资源圃中5个山葡萄品种样本中5种花色苷单糖苷的含量进行测定和对比,为山葡萄中花色苷的研究提供方法和依据,同时也为山葡萄品质评价方法研究提供一定的参考。
1 材料与仪器
1.1 实验材料
供试山葡萄样本均采集于中国农业科学院特产研究所山葡萄资源圃,品种分别为野生山葡萄选育品种左山一、左山二、通化十号、长白山九号以及种内杂交品种双丰。采集时间为2015年9月20日,为山葡萄成熟采收期。
1.2 对照品与试剂
花色苷对照品飞燕草素-3-O-葡萄糖苷(DEL-3-O-glucoside)、矢车菊素-3-O-葡萄糖苷(CYA-3-O-glucoside)、矮牵牛素-3-O-葡萄糖苷(PET-3-O-glucoside)、芍药素-3-O-葡萄糖苷(PEO-3-O-glucoside)、二甲花翠素-3-O-葡萄糖苷(MAL-3-O-glucoside)(长春市宏宇化工有限公司);甲醇、乙腈(色谱纯,美国Fisher公司)。
1.3 实验仪器
Ultimate 3000液相色谱仪(美国DIONEX公司);QTrap 4000质谱仪(美国AB SCIEX公司);Milli-Q Advantage A10超纯水器(美国Millipore公司);XS205DU电子天平(1/100 000,瑞士Mettler Toledo公司)。
2 方法与结果
2.1 HPLC-ESI-MSn检测条件
色谱柱:PFP Kinetix (2.1mm×50mm,2.6μm);流动相:2%甲酸水溶液(A)-2%甲酸乙腈溶液(B),二元梯度洗脱(0min~1min,1.2%B;1min~31min,1.2%~21.2%B;31min~37min,21%~100%B;37min~42min,100%B;42min~44min,100%~1.2%B;44min~52min,1.2%B);流速:0.6mL/min;柱温:35℃;进样量:5μL。
质谱条件:ESI离子源;负离子模式检测;辅助气1、2:60psi;气帘气:25psi;锥孔电压:65V;入口电压:10V;碰撞能量:26V;碰撞室出口电压17V;多反应监测(MRM)采集模式;离子对设定:飞燕草素-3-O-葡萄糖苷(465>303)、矢车菊素-3-O-葡萄糖苷(449>287)、矮牵牛素-3-O-葡萄糖苷(479>317)、芍药素-3-O-葡萄糖苷(463>301)、二甲花翠素-3-O-葡萄糖苷(493>331)。总离子流图见图1。

a.飞燕草素-3-O-葡萄糖苷;b.矢车菊素-3-O-葡萄糖苷;c.矮牵牛素-3-O-葡萄糖苷;d.芍药素-3-O-葡萄糖苷;e.二甲花翠素-3-O-葡萄糖苷
2.2 对照品溶液制备
精密称取飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷各1mg,分别定容至1mL,制成浓度为1mg/mL溶液备用。
2.3 供试品溶液制备
山葡萄采集后,立即剥皮,葡萄皮干燥处理,干燥后粉碎、混匀,备用。取样品0.1g,加入甲醇5mL,避光超声提取5min,重复3次,合并提取液,氮气吹干,定容至1mL,滤过,稀释,备用。
2.4 线性关系考察
制备含飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷的混合对照溶液。分别精密吸取混合对照品溶液2μL、4μL、6μL、8μL、10μL、12μL,稀释成不同浓度梯度,按“2.1”项检测条件测定,由峰面积为纵坐标、对照品量为横坐标,进行线性回归,得回归方程及相关系数(表1)。
表1花色苷的线性回归方程及其相关系数

Table 1Linear regression equation and correlation coefficient of anthocyanins
2.5 精密度实验
精密吸取同一混合对照品溶液5μL,重复进样5次,计算色谱峰峰面积值的RSD。飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷峰面积的RSD分别为1.15%、0.32%、1.51%、1.17%、1.41%,表明仪器精密度良好。
2.6 稳定性实验
分别精密吸取同一供试品溶液5μL,分别于0h、8h、16h、24h进样,测定峰面积。飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷峰面积的RSD分别为 2.52%、2.32%、4.25%、4.73%、3.06%,RSD值均小于5%,说明样品在24h内稳定性良好。
2.7 重现性试验
取同一供试品5份,分别按照“2.3”项下方法制备供试品溶液,并按照上述检测条件测定。飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷RSD分别为2.67%、3.09%、2.98%、2.87%、3.15%,表明该方法重现性良好。
2.8 加样回收率测定
精密称取6份已知含量的同一山葡萄样品0.1g,分别精密加“2.2”项下制备的混合对照溶液0.6mL、0.8mL、1.0mL,加入甲醇定容,按照“2.1”项下检测条件进样分析。飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷的平均回收率分别为97.45%、98.21%、96.06%、97.63%、101.80%,RSD分别为2.21%、2.10%、2.09%、2.17%、2.19%。
3 结果与分析
5个品种山葡萄果皮中均检测到5种花色苷,总离子流图见图2,含量测定结果见表2。

a.飞燕草素-3-O-葡萄糖苷;b.矢车菊素-3-O-葡萄糖苷;c.矮牵牛素-3-O-葡萄糖苷;d.芍药素-3-O-葡萄糖苷;e.二甲花翠素-3-O-葡萄糖苷
由表2可以看出,5个品种山葡萄样品中飞燕草素-3-O-葡萄糖苷、矮牵牛素-3-O-葡萄糖苷和二甲花翠素-3-O-葡萄糖苷含量高于矢车菊素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷。5个品种山葡萄中飞燕草素-3-O-葡萄糖苷含量最高的为长白山九号(5.10mg/g),矢车菊素-3-O-葡萄糖苷含量最高的为双丰(1.44mg/g),矮牵牛素-3-O-葡萄糖苷含量最高的为通化十号(4.07mg/g),芍药素-3-O-葡萄糖苷含量最高的为双丰(1.27mg/g),二甲花翠素-3-O-葡萄糖苷含量最高的为左山一(4.33mg/g)。5个品种山葡萄果皮中5种花色苷单糖苷总含量最高的为长白山九号,其次为左山一,含量最低的为左山二。
表2不同品种山葡萄样品中花色苷含量测定结果
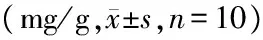

左山一ZuoshanⅠ左山二ZuoshanⅡ双 丰Shuangfeng通化十号ThonghuaⅩ长白山九号ChangbaishanⅨ飞燕草素-3-O-葡萄糖苷 DEL-3-O-glucoside312±016436±019465±010399±010510±013矢车菊素-3-O-葡萄糖苷 CYA-3-O-glucoside165±009123±008144±009098±006129±009矮牵牛素-3-O-葡萄糖苷 PET-3-O-glucoside335±013387±015312±011407±014385±015芍药素-3-O-葡萄糖苷 PEO-3-O-glucoside101±006096±005127±007091±006087±005二甲花翠素-3-O-葡萄糖苷 MAL-3-O-glucoside433±017129±008185±008337±012381±0165种单糖苷总量 TotalContent13461171123313321492
4 讨论
本试验采用超声提取法,通过预实验对料液比例、提取功率和提取时间进行优化,确定最佳提取工艺,结果提取花色苷比较完全,提取时间短、效率高,保证了花色苷的纯度,避免杂质对HPLC-ESI-MSn法测定的干扰,减少杂质峰。并且利用多反应离子监控模式(MRM),对待测5种花色苷分别选用各自定量离子对通道进行分析,既消除了相似杂质的干扰又提高了分析的灵敏度和检测限。
花色苷作为功能性多酚类成分的重要组成部分,对山葡萄的质量有着重要的影响。花色苷含量与山葡萄品种有关,同时也受生长环境中的多种因素影响。因此通过采集大量样本,明确不同品种山葡萄花色苷的种类和含量的差异,经过合理的统计与分析,所得到的结果能够为山葡萄的品质评价提供依据。
[1]刘长姣,袁述,毛北星,等.浆果有效成分和活性研究进展[J].农产品加工(学刊),2013,(8):38-39,43.
[2]李焱,刘仲华.葡萄多酚提取及抗氧化研究进展[J].农产品加工(学刊),2013,(4):52-55.
[3]贾荣.山葡萄籽多酚提取物及抗氧化活性的研究[D].长春:吉林大学,2010.
[4]王新伟,秦红艳,赵滢,等.山葡萄种质资源原花青素分布及其含量动态变化[J].北方园艺,2011,(11):12-16.
[5]王新伟.山葡萄种质资源原花青素动态含量变化及提取、降解研究[D].北京:中国农业科学院,2011.
[6]赵权.六个山葡萄品种葡萄籽中多酚含量比较研究[J].北方园艺,2013,(1):15-17.
[7]Acevedo De la Cruz Alexander,Hilbert Ghislaine,Rivière Céline,et al.Anthocyanin identification and composition of wild Vitis spp[J].accessions by using LC-MS and LC-NMR.Analytica Chimica Acta,2012,732:145-152.
[8]Liang Zhenchang,Yang Yingzhen,Cheng Lailiang,et al.Polyphenolic composition and content in the ripe berries of wild Vitis species[J].Food Chemistry,2012,132(2):730-738.
[9]Ji Mei,Li Qiang,Ji Hua,et al.Investigation of the distribution and season regularity of resveratrol inVitisamurensisvia HPLC-DAD-MS/MS[J].Food Chemistry,2014,142:61-65.
[10]Wang Jiang-Nong,Hano Yoshio,Nomura Taro,et al.Procyanidins from the seeds ofVitisamurensis[J].Phytochemistry,2000,53:1097-1102.
[11]王华,菅蓁,郭耀东.制备高效液相色谱法分离制备葡萄果皮中二甲花翠素3-O-葡萄糖苷单体[J].酿酒科技,2007,(11):19-21,24.
