溶磷细菌和丛枝菌根真菌接种对南方红豆杉生长及根际微生物和土壤酶活性的影响
2016-03-24付晓峰张桂萍张小伟任嘉红
付晓峰,张桂萍*,张小伟,任嘉红
(1 山西师范大学 生命科学学院,山西临汾 041000;2 长治学院 生物科学与技术系,山西长治 046011;3 龙泉市林业局,浙江龙泉 323700)
溶磷细菌和丛枝菌根真菌接种对南方红豆杉生长及根际微生物和土壤酶活性的影响
付晓峰1,2,张桂萍1,2*,张小伟3,任嘉红1,2
(1 山西师范大学 生命科学学院,山西临汾 041000;2 长治学院 生物科学与技术系,山西长治 046011;3 龙泉市林业局,浙江龙泉 323700)
摘要:以南方红豆杉实生苗为材料,采用盆栽实验探讨了高效溶磷细菌草木樨中华根瘤菌(Sinorhizobium meliloti)CHW10B与丛枝菌根真菌缩球囊霉(Glomus constrictum)单独和双接种条件下,其植株生长、根际土壤可培养微生物数量、土壤酶活和土壤微生物功能多样性变化,在微生态水平揭示接种对南方红豆杉生长的影响及其机制。结果表明:(1)各接种处理对南方红豆杉幼苗均有促生长作用,接种处理苗高、地径和生物量均较对照显著增加,并以双接种促进效果最好。(2)各接种处理提高了南方红豆杉根际土壤可培养细菌、真菌和放线菌含量,增加了土壤微生物碳源利用率,改变了土壤中物种的丰富度和均一度,增加了土壤中的生物多样性。(3)各接种处理促进了南方红豆杉根际重要土壤酶(酸性磷酸酶、脱氢酶、转化酶)活力的增加,且双接种的促进作用最为明显。可见,溶磷细菌(草木樨中华根瘤菌CHW10B)和丛枝菌根真菌(缩球囊霉)具有协同作用,两者同时接种可显著提高南方红豆杉根际土壤微生物数量及土壤酶活力,提高土壤微生物碳源利用率和土壤肥力,增加土壤中的生物多样性,从而达到间接促进宿主植物南方红豆杉生长的目的。
关键词:溶磷细菌;丛枝菌根真菌;南方红豆杉;双接种;根际微生物;土壤酶活性
南方红豆杉(Taxuschinensisvar.mairei),属于裸子植物亚门红豆杉科红豆杉属植物,为国家一级重点保护濒危野生植物[1]。红豆杉属植物因其含有抗癌物质——紫杉醇及其前体物巴卡亭Ⅲ、10-去乙酰巴卡亭Ⅲ(10-DAB)而备受关注。虽然不少学者成功通过产紫杉醇真菌培养、悬浮细胞培养、化学合成等方法进行紫杉醇的提取,但因成本太高、含量太少而无法进行商业化生产[2-3]。目前主要是通过大规模的人工栽培红豆杉来解决紫杉醇提取的资源严重短缺问题[4]。
土壤中存在大量对难溶性无机磷酸盐具有溶解能力的溶无机磷细菌(phosphate- solubilizing bacteria,PSB)[5]。不少研究表明PSB能够增加植物磷素吸收量,提高土壤磷素利用率,促进植物的生长[6]。草木樨中华根瘤菌(Sinorhizobiummeliloti)CHW10B是本实验室前期从南方红豆杉根际土壤中分离筛选出的1株高效PSB,该菌株对南方红豆杉生长具有促进作用,可在其根际和根内部长期定殖[7-8]。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类土壤共生真菌,能与绝大多数的陆地植物结成共生体——丛枝菌根(arbuscular mycorrhize,AM)[9]。AM的形成能够促进植物对营养元素的吸收和生长发育,增加植物的抗逆性[10-11]。多年生南方红豆杉AMF的多样性及侵染情况调查发现,南方红豆杉可与AMF形成典型的AM[12-13]。
PSB与AMF均为土壤中重要的植物有益微生物类群,近年来日益成为菌根圈相互关系研究领域的热点。国内外学者将AMF、PSB等植物有益微生物复合接种在作物上,并获得了显著协同促生效果,但该类研究大多集中在农作物上[14-18],尚未见将AMF、PSB共同接种于南方红豆杉的相关报道。植物有益微生物与植物的相互关系对植物根际微生物、土壤特性的促进改善有重要作用[19-22],而关于有益微生物对南方红豆杉根际土壤微生物及酶活性影响的报道也较少。因此,本试验以南方红豆杉为研究对象,开展双接种PSB草木樨中华根瘤菌CHW10B和AMF缩球囊霉(Glomusconstrictum)对南方红豆杉生长、根际可培养微生物量、土壤酶活和土壤微生物功能多样性的影响的相关研究,在微生态水平揭示接种对南方红豆杉生长的影响及其机制,为南方红豆杉人工栽培及其高效复合型微生物肥料的研制提供理论指导。
1材料和方法
1.1供试材料
南方红豆杉(Taxuschinensisvar.mairei)为1年生实生苗,栽培于山西省长治市林业局苗圃。供试菌株为高效溶磷细菌草木樨中华根瘤菌CHW10B和从枝菌根真菌缩球囊霉,两者均分离自南方红豆杉根际,由本研究室保存。培养基包括牛肉膏蛋白胨培养基(细菌分离培养)、高氏1号培养基(放线菌分离培养)和察氏培养基(真菌分离培养)[23]。
1.2试验设计
选择长势一致的南方红豆杉1年生幼苗移栽到花盆中,培养基质为沙、蛭石、土壤(体积比为1∶1∶2)混合物。每盆移栽1株幼苗。其中,土壤采自长治林业局苗圃,pH 6.32,有机质含量4.29%。移苗时进行AMF接种,接种时采用缩球囊霉的白三叶草扩繁固体菌剂(菌根侵染率为79%,孢子密度为每50 g±576个),接种量为每株25 g。溶磷细菌CHW10B采用细菌菌悬液(1×1010CFU/mL)灌根接种,细菌接种量每株25 mL。对照(CK)为不接种任何菌剂。试验共设有4个处理,即单接丛枝菌根真菌缩球囊霉(AMF) 、单接溶磷细菌草木樨中华根瘤菌CHW10B(PSB)、双接种AMF和PSB(AMF+PSB)和不接种对照(CK)。每处理45次重复。接种后的南方红豆杉幼苗置于自然采光的温室中培育,并分别于接种后30、90、360 d采集根际土进行微生物数量、微生物多样性和土壤酶活性测定,于接种后360 d时取样测定南方红豆杉生长指标。
1.3测定指标及方法
1.3.1土壤根际微生物数量称取土样1 g,置盛有9 mL无菌水的试管中,振荡30 min,使土粒分散均匀。依次按10倍法稀释至10-6组成一系列稀释液。采用稀释涂布法进行土样中的细菌、真菌和放线菌的分离,细菌、放线菌和真菌采用稀释度分别为10-4~10-6、10-3~10-5和10-2~10-4。取各稀释度悬浮液0.1 mL,分别用无菌棒涂布于相应的平皿中,每个稀释度接3个平板。将涂布好的细菌、放线菌、真菌平板倒置,于28~30 ℃恒温培养。当培养基中出现菌落时,观察菌落特征并统计相应菌落数。
1.3.2根际微生物多样性微生物群落功能多样性应用BIOLOG ECO微平板测定。称取不同处理根际土样1.0 g,加入盛有9 mL无菌水的10 mL试管中,高速振荡20 min,静置澄清后,将上清液梯度稀释,将10-3梯度液接种到BIOLOG ECO微孔板中,每孔100 μL。于25 ℃下恒温培养7 d,每隔24 h用自动酶标仪在590 nm下读数。微生物整体活性指标采用微平板每孔颜色平均变化率(average well color development,AWCD)来表示。用Simpson指数(D)、Shannon指数(H)、McIntosh指数(U)计算土壤微生物碳源利用情况[24]。计算公式如下:
AWCD=∑(Ci-Ri)/n
H=-∑pi(lnpi)
式中,Ci为各反应孔的吸光值,Ri为对照孔的吸光值,n为培养基孔数,Biolog Eco板n值为31;Pi为第i孔的相对吸光值与所有整个微平板的相对吸光值总和的比值(Ci-Ri)/∑(Ci-Ri);ni为第i孔的相对吸光值(Ci-Ri)。
1.3.3根际土壤酶活各处理根际土酸性磷酸酶活性采用磷酸苯二钠比色法测定,用反应后每分钟每克干土释放的酚(μg)表示;土壤脱氢酶活性采用分光度法测定,用反应后每小时每克烘干土产生的三苯基甲腙的微克数(μg)表示;土壤转化酶活性采用3,5-二硝基水杨酸比色法测定,用反应后每天每克烘干土产生的葡萄糖的毫克(mg)表示。
1.3.4南方红豆杉生长指标接种360 d后,分别测定各处理南方红豆杉的株高、地径及总生物量。
1.4数据处理
用SPSS 13.0和Excel进行统计分析和制图。
2结果与分析
2.1PSB及AMF接种对南方红豆杉土壤根际微生物数量的影响
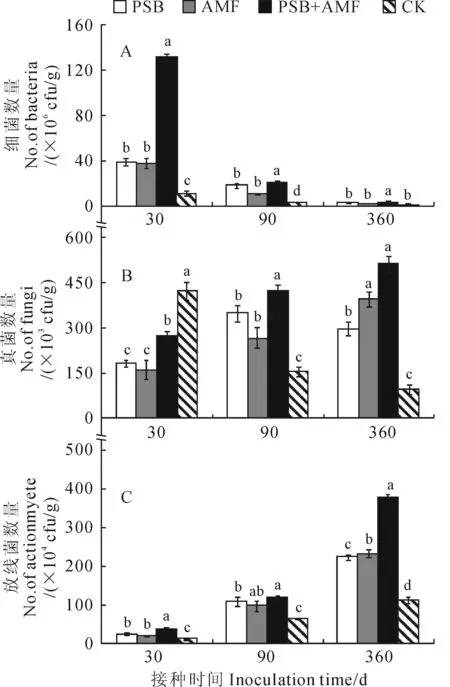
细菌是土壤微生物中数量最多的一个微生物类群,参与有机质的分解、氨化作用等。从图1,A可以看出,各处理南方红豆杉根际土壤中可培养细菌数量随着接种时间延长而整体呈逐渐下降趋势,这可能是随着接种时间的增加土壤有机质含量降低所致;不同处理组细菌数量存在一定差异,各接种时间内基本表现为双接种处理(PSB+AMF)最多,单独接种(PSB、AMF)居中,对照(CK)最少,且接种时间越长处理间差异越小。其中,PSB+AMF、PSB、AMF处理细菌数量在接种30 d时分别是CK的11.87倍、3.51倍和3.41倍,并均达到显著水平(P<0.05),而在接种360 d时则分别是CK的2.16倍、1.35倍和1.21倍,但仅双接种处理达到显著水平。可见,溶磷细菌和丛枝菌根真菌单独或者双接种处理均能有效增加南方红豆杉根际土壤中可培养细菌数量,且双接种处理效果明显由于单独接种效果,但这种促进效应随接种时间的延续而减弱。
同时,真菌参与土壤中有机质的分解和腐殖质的形成、土壤中的氨化作用以及团聚体的形成等。由图1,B可知,不同处理组真菌数量存在显著差异(P<0.05),接种处理(PSB+AMF、PSB、AMF)南方红豆杉根际土壤中可培养真菌数量随接种时间呈上升趋势,对照(CK)随着接种时间延长表现为下降趋势。其中,接种30 d后,PSB+AMF、PSB、AMF处理可培养真菌数量均小于对照CK,分别为CK的64.5%、42.9%、38.0%;接种90 d后,接种处理土壤根际真菌数量显著高于对照,并表现为PSB+AMF>PSB>AMF>CK;接种360 d后,接种处理土壤根际真菌数量远高于对照,并以PSB+AMF处理土壤根际真菌数目最多,其后依次为PSB、AMF,三者分别是CK处理的5.2倍、4.0倍、3.1倍。这表明随着接种时间的增加,接种处理显著增加了根际土壤真菌数量,促进南方红豆杉的生长。
此外,放线菌参与土壤中有机物的分解,并能分泌抗生素,拮抗土壤中的病原菌。由图1,C可知,各处理南方红豆杉根际土壤中可培养放线菌数量随着接种时间延长而整体呈上升趋势;不同处理组放线菌数量存在一定差异,各接种时间内基本表现为双接种处理(PSB+AMF)最多,单独接种(PSB、AMF)居中,对照(CK)最少,且接种时间越长处理间差异越大。其中,PSB+AMF、PSB、AMF处理放线菌数量在接种30 d时分别是CK的1.76倍、1.38倍、2.88倍,而在接种360 d时分别是CK的1.98倍、2.08倍和2.38倍。
以上结果说明,在南方红豆杉根际接种草木樨中华根瘤菌CHW10B或缩球囊霉能显著提高根际土壤可培养微生物(细菌、真菌和放线菌)数量,且双接种优于单接种,从而有助于土壤肥力的显著增加,促进南方红豆杉苗木的良好生长。
2.2PSB与AMF接种对南方红豆杉根际微生物整体功能活性的影响
土壤微生物对BIOLOG ECO微孔中碳源的利用情况用AWCD来表示。AWCD反映了土壤微生物利用碳源的能力和代谢活性的大小,其值越高,土壤中微生物群落代谢活性也就越高,用以评测土壤微生物整体活性的高低[25]。从图2可以看出,施菌30 d时,各接种处理组AWCD值在培养前72 h变化明显,而在培养72 h后变化趋于平缓;施菌90 d、360 d时,各接种组AWCD值随培养时间呈逐渐上升趋势。以培养处于稳定的96 h来看,在施菌30 d、360 d时,各接种处理组AWCD值均不同程度小于CK;在施菌90 d时,PSB+AMF、PSB处理组AWCD值分别比CK提高100%、85%,而AMF处理组与对照相近。由上可知,在南方红豆杉根际接种草木樨中华根瘤菌CHW10B或缩球囊霉后,接种前期PSB、AMF能够提高土壤微生物的总体活性,促进土壤微生物对单一碳源的利用程度,增加微生物的多样性;但到了测试后期(360 d),促进作用逐渐降低和消失。这极有可能是接种后期盆栽苗土壤基质营养有限导致的结果,这也正是温室盆栽苗实验的局限。
PSB.单独溶磷细菌接种;AMF.单独丛枝菌根真菌接种;

A.接菌后30 d;B.接菌后90 d;C.接菌后360 d
2.3PSB与AMF接种对南方红豆杉根际微生物多样性的影响
生物多样性指数描述了生物的类型数和丰富程度,在一定情况下可以反映生物群落物种的丰富程度及分配比例,而Shannon、Simpson、McIntosh指数分别反映土壤微生物物种的丰富度、优势度以及度量群落物种的均匀度。从表1可以看出,Shannon、McIntosh指数在不同的接种时间内存在显著差异(P<0.05);Sinpson指数在接种30 d和90 d时各个处理无明显变化,在接种360 d时各个处理间存在一定差异。其中,Shannon指数在接种30 d时以对照组(CK)最高,PSB+AMF最低;而在接种90 d和360 d时均表现为PSB最高。Sinpson指数在接种30 d时各处理均无明显变化,而在接种90 d和360 d时均表现为PSB+AMF最高。McIntosh指数在接种30 d和360 d时均表现为PSB+AMF最低,而在接种90 d时表现为PSB+AMF最高。从上述分析可以看出,整体上各接种处理对微生物物种的Shannon指数和McIntosh指数影响较大,在一定程度上提高土壤微生物物种的丰富度和均匀度,增加了土壤中的生物多样性。
2.4PSB与AMF接种对南方红豆杉土壤酶活性的影响
磷酸酶是土壤中及植物体内重要的水解酶,在利用有机磷及调节植物磷营养方面具有重要作用。从图3,A可以看出,接种处理使土壤酸性磷酸酶活性整体呈上升趋势,而对照酸性磷酸酶活性基本不变。土壤酸性磷酸酶活性在接种30 d后以PSB+AMF、AMF处理较高,PSB处理最低;而其在接种90 d后以PSB+AMF最高,CK组最低,PSB+AMF、PSB、AMF处理分别是CK的13倍、8倍、5倍;其接种360 d后则表现为:PSB+AMF>PSB>AMF>CK,接种处理分别是CK组的27倍、15倍、18倍。
脱氢酶普遍存在于活体微生物中。在土壤生态中,可以反映处理体系中微生物的量及其对有机物的降解能力。从图3,B可知,不同接种处理脱氢酶活性随接种时间的延续整体趋势为先升后降,并以接种90 d时最高。在接种30 d后,各处理脱氢酶活性以PSB+AMF处理显著较高,CK组次之,AMF 和PSB处理显著较低;接种90 d后,不同处理脱氢酶活性均大幅显著增加,表现为PSB+AMF>AMF>PSB>CK,且接种处理均显著高于对照;接种360 d后,不同处理脱氢酶活性不同程度地下降,表现为PSB+AMF>PSB>AMF>CK,且处理间差异显著。
转化酶又名蔗糖酶,可促进蔗糖水解生成葡萄糖和果糖,对增加土壤的可溶性营养具有重要作用,为土壤生物体提供充分能源物质。转化酶活性高,说明土壤生物活性高,土壤状况良好[26]。从图3,C可以看出,接种处理的转化酶活性随接种时间的延续表现为先降后升趋势,而对照组则表现为下降趋势。各接种处理土壤脱氢酶活性在接种30 d时均显著低于对照;各处理脱氢酶活性在接种90 d和360 d后均显著高于对照,并表现为PSB+AMF>AMF>PSB,它们在接种90 d时分别较对照增加了52.6%、24.3%、23.1%,而在接种360 d后分别较对照增加了75.7%、54.4%、47%。

表1 南方红豆杉根际土壤微生物功能多样性指数
注:同列不同小写字母代表处理间在0.05水平上差异显著;表2同。
Note:Data with different letters are significantly different at 0.05 level in the same column;The same as Table 2.
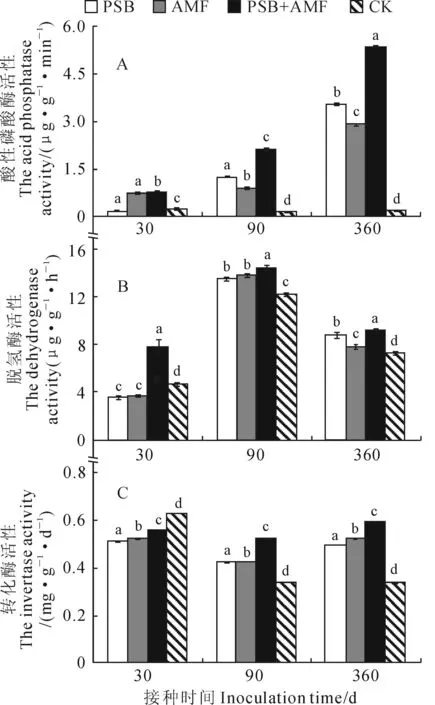
图3 不同处理南方红豆杉根际土壤
处理Treatment生物量Biomass/g苗高Seedingheight/cm地径Diameterofstembase/mmAMF17.659±1.433b41.38±2.35b7.65±0.46bPSB+AMF20.609±1.007a49.09±1.52a8.74±0.64aPSB14.473±1.383c37.35±2.19c6.67±0.42bCK11.536±0.901d31.09±1.43d5.58±0.12c
从整体趋势来看,南方红豆杉根际接种草木樨中华根瘤菌CHW10B或缩球囊霉后显著提高3种土壤酶的活性,尤其对酸性磷酸酶影响最大,且双接种要明显优于单接种处理。
2.5PSB与AMF接种对南方红豆杉生长的影响
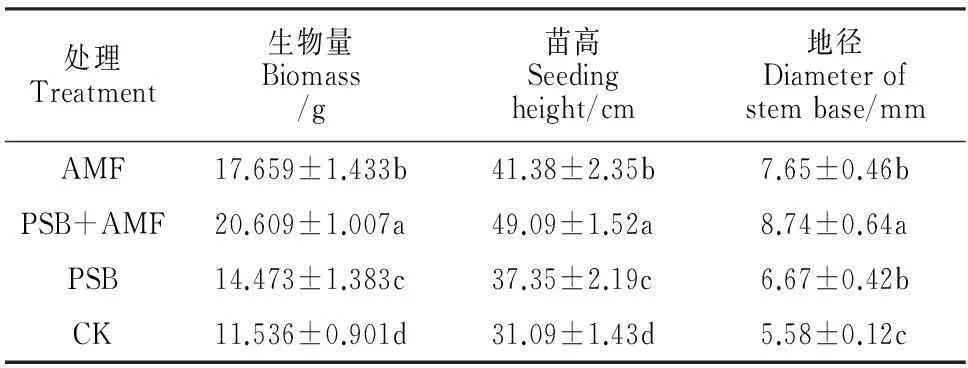
生物量是一定时间、一定空间一种或数种生物有机体的总干物质的重量或者一个群落内所有生物有机体的总重量。苗高和地径是衡量苗木质量最为重要、也是最为直接的形态指标。从表2可知,接种360 d后,各处理组南方红豆杉生物量、苗高、地径均显著高于对照组,且表现为PSB+AMF>AMF>PSB,PSB+AMF接种处理与单接种处理间差异显著。以上结果说明根际接种草木樨中华根瘤菌CHW10B或缩球囊霉均显著促进南方红豆杉苗木的生长,且双接种处处理显著优于单接种处理,接种CHW10B和缩球囊霉存在协同作用。
3结论与讨论
近年来,植物有益微生物的效应研究已从微生物对植物生长、营养、光合和根系的影响等方面逐渐向植物根际微环境等方面扩展,采用的接种剂也由早期的有益微生物单接种转向多种微生物混合接种。一些学者开展了溶磷细菌与菌根真菌的相互作用及其对宿主植物生长和养分吸收影响的研究,指出溶磷细菌与菌根真菌互作在增加磷素吸收和植物的促生作用上优于单一接种时的效果[27-28]。如秦芳玲采用盆栽试验研究AMF(G.mosseae) 和溶磷细菌(Bacillusmegaterium)双接种对红三叶草生长和磷营养的影响,结果表明双接种对植物的氮、磷养分吸收具有明显的协同作用[15]。土壤微生物和土壤酶是土壤微生态系统中的活性物质,参与土壤的生物化学过程,与土壤的肥力状况有紧密关系。本研究首次从微生态角度,通过对南方红豆杉苗木接种高效PSB草木樨中华根瘤菌(CHW10B)、AMF缩球囊霉(G.constrictum),并定期采集样品测定南方红豆杉根际土壤微生物数量、土壤酶活性和土壤微生物功能多样性,获得其动态变化规律;同时结合南方红豆杉生长相关指标测定值,分析接种对苗木的促生长机制。研究结果表明接种能促进土壤根际酶(酸性磷酸酶、脱氢酶、转化酶)活性、可培养微生物(细菌、真菌、放线菌)数量、微生物多样性的增加,而且接种对南方红豆杉有明显的促生长作用,并以双接种效果最好。这暗示CHW10B和缩球囊霉存在协同作用,该结果与前人在其他植物上的研究结论一致[15,29]。
土壤微生物参与土壤的物质循环和能量转化,而土壤酶参与土壤的许多重要的生物化学过程和物质循环[30]。本研究对接种PSB、AMF的南方红豆杉根际的3种土壤酶活性、根际微生物数量、微生物多样性进行测定,结果这些指标大多优于未接种处理。有学者研究表明,蚕豆[30]、大豆[31]等植物根际土壤酸性磷酸酶活性在低磷水平下显著提高,酶活性的增加促进了土壤中磷的利用率。本研究通过对南方红豆杉进行草木樨中华根瘤菌CHW10B和缩球囊霉接种,显著提高了土壤中酸性磷酸酶的活性,有效促进了南方红豆杉对难溶性磷的利用率;另外,接种处理根际脱氢酶和转化酶活性也优于未接种处理。这两种酶是土壤中的重要酶,活性的增强可促进根际土壤的代谢作用,有利于根际土壤生产力水平的提高。这些土壤酶活性的增加有利于南方红豆杉苗木的生长,这一点可以从接种360 d后南方红豆杉的株高、地径及总生物量显著提高的实验结果得到证实。
本研究中,双接种PSB和AMF使南方红豆杉苗木根际土壤中微生物(细菌、真菌、放线菌)数量和多样性明显增加,土壤酶活性显著升高,这大大有利于土壤养分的转化,从而促进宿主植物对土壤养分的吸收,最终达到了促进南方红豆杉生长的效果。这极有可能就是PSB和AMF混合接种促进南方红豆杉生长的生态机制,其具体影响机制还有待于进一步开展。另外,对温室栽培条件下南方红豆杉根际PSB、AMF发生协同作用的分子机制、双接种对南方红豆杉的次生代谢产物紫杉醇的生物合成是否有影响等方面未知,仍需开展深入研究。有研究表明不少生态因子如气候环境、海拔、土壤类型和土壤理化性质对 AMF 的侵染也有着较大影响[32]。而且,盆栽实验仅适于接种效应的短期研究。因此,将南方红豆杉进行接种处理并人工栽培在不同的自然环境中的生长状况也有待于进一步的观察。
定殖是植物有益菌发挥作用的重要因素,有益菌发挥功能的前提条件就是施用后能在环境中存活并有效定殖[33]。基于此,实验中供试的高效溶磷细菌草木樨中华根瘤菌CHW10B分离自南方红豆杉根际,能在其根际和根部有效定殖[7];而AMF(G.constrictum)也分离自南方红豆杉根际土壤[12],这为将两者回接于南方红豆杉苗木发挥有益作用奠定了基础。另外,由于可培养微生物的数量只是土壤微生物数量中的一部分,因此我们在后续研究中将考虑引入非培养生物技术如PLFA(fatty acids in the phospholipid)谱图分析法、分子生物学方法(如DGGE)等方法解决土壤中不可培养微生物的问题,提高科研结果的真实性与可靠性。
参考文献:
[1]ZHOU Y,CHEN G P,SU Y J,etal.Microsatellite loci fromTaxuschinensisvar.mairei(Taxaceae),an endangered and economically important tree species in China[J].FrontiersofBiologyinChina,2009,4(2):214-216.
[2]赵凯,平文祥,周东坡.内生真菌发酵生产紫杉醇的研究现状与展望微生物学报[J].微生物学报,2008,48(3):403-407.
ZHAO K,PING W X,ZHOU D P.Recent advance and prospect on taxol production by endophyticfungus fermentation-a review[J].ActaMicrobiologicaSinica,2008,48(3):403-407.
[3]邱德有,张彬,杨艳芳,等.紫杉醇生物合成研究历史、现状及展望[J].生物技术通报,2015,31(4):56-64.
QIU D Y,ZHANG B,YANG Y F,etal.History,current status and the prospects of taxol biosynthesis research[J].BiotechnologyBulletin,2015,31(4):56-64.
[4]GUO B H,KAI G Y,JIN H B,etal.Review-Taxolsynthesis[J].AfricanJournalofBiotechnology,2006,5(1):15-20.
[5]CHUNG H.PARK M,MADHAIYAN M,etal.Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea[J].SoilBiology&Biochemistry,2005,37:1 970-1 974.
[6]HAMEEDA B,HARINI O P,RUPELA O P,etal.Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna[J].MicrobiologicalResearch,2008,163(2):234-242.
[7]任嘉红,刘辉,姜楠,等.GFP标记溶磷草木樨中华根瘤菌CHW10B及其定殖[J].林业科学,2015,51(1):74-79.
REN J H,LIU H,JIANG N,etal.Sinorhizobium meliloti CHW10B strain GFP-labelling and its colonization associated withTaxuschinensisvar.mairei[J].ScienticSilvaeSinicae,2015,51(1):74-79.
[8]任嘉红,刘辉,吴晓蕙,等.南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J].微生物学报,2012,52(3):295-303.
REN J H,LIU H,WU X H,etal.Screening,identification,and promoting effect of phosphate-solubilizing bacteria in rhizosphere ofTaxuschinensisvar.mairei[J].ActaMicrobiologicaSinica,2012,52(3):295-303.
[9]SMITH S E,READ D J.Mycorrhizal symbiosis[M].Academic Press,1996.
[10]MORTIMER P E,PÉREZ-FERNNDEZ M A,etal.The role of arbuscular mycorrhizal colonization in the carbon and nutrient economy of the tripartite symbiosis with nodulatedPhaseolusvulgaris[J].SoilBiologyandBiochemistry,2008,40(5):1 019-1 027.
[11]DEMIR S.Influence of arbuscular mycorrhiza on some physiological growth parameters of pepper[J].TurkishJournalofBiology,2004,28(2-4):85-90.
[12]任嘉红,张静飞,刘瑞祥,等.南方红豆杉丛枝菌根(AM)的研究[J].西北植物学报,2008,28(7):1 468-1 473.
REN J H,ZHANG J F,LIU R X,etal.Study on arbuscular mycorhizae inTaxuschinensisvar.mairei[J].ActaBot.Boreal.-Occident.Sin.,2008,28(7):1 468-1 473.
[13]王森,唐明,牛振川,等.山西历山珍稀药用植物AM真菌资源与土壤因子的关系[J].西北植物学报,2008,28(2):355-361.
WANG S,TANG M,etal.Relationship between AM fungi resources of rare medicinal plants and soil factors in Lishan Mountain[J].ActaBot.Boreal.-Occident.Sin.,2008,28(2):355-361.
[14]CASTAGNO L N,GARCA I V,etal.Growth,nutrient uptake and symbiosis with rhizobia and arbuscular mycorrhizal fungi inLotustenuisplants fertilized with different phosphate sources and inoculated with the phosphate-solubilizing bacteriumPantoeaeucalyptiM91[J].PlantandSoil,2014,385(1-2):357-371.
[15]秦芳玲,田中民.同时接种解磷细菌与丛枝菌根真菌对低磷土壤红三叶草养分利用的影响[J].西北农林科技大学学报·自然科学版,2009,37(6):151-156.
QIN F L,TIAN Z M.Effect of co-inoculation with arbuscular mycorrhizal fungi and four different phosphate-solubilizing bacteria on nutrients uptake of red clover in a low phosphorus soil[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.),2009,37(6):151-156.
[16]ZAIDI A,KHAN M S.Stimulatory effects of dual inoculation with phosphate-solubilizing microorganisms and arbuscular mycorrhizal fungus on chickpea[J].AustralianJournalofExperimentalAgriculture,2007,47(8):1 016-1 022.
[17]VAFADAR F,AMOOAGHAIE R,etal.Effects of plant-growth-promoting rhizobacteria and arbuscular mycorrhizal fungus on plant growth,stevioside,NPK,and chlorophyll content ofSteviarebaudiana[J].JournalofPlantInteractions,2014,9(1):128-136.
[18]BOUHRAOUA D,AARAB S,LAGLAOUI A,etal.Phosphate solubilizing bacteria efficiency on mycorrhization and growth of peanut in the Northwest of Morocco[J].AmericanJournalofMicrobiologicalResearch,2015,3(5):176-180.
[19]KIM K Y,JORDAN D,MCDONALD G A.Effect of phosphate-solubilizing bacteria and vesicular-arbuscular mycorrhizae on tomato growth and soil microbial activity [J].BiolFertilSoils,1998,26:79-87.
[20]NAYYAR A.Impact of mineral N and P and manure on arbuscular mycorrhizal fungi,other soil microorganisms and on soil functionality in different agroecosystems[D].UniversityofSaskatchewanSaskatoon,Canada,2009.
[21]AMBROSINI A,DE SOUZA R,PASSAGLIA L M P.Ecological role of bacterial inoculants and their potential impact on soil microbial diversity[J].PlantandSoil,2015:1-15.
[22]KHAN K,PANKAJ U,VERMA S K,etal.Bio-inoculants and vermicompost influence on yield,quality of Andrographis paniculata,and soil properties[J].IndustrialCropsandProducts,2015,70:404-409.
[23]程丽娟.微生物学实验技术[M].西安:天则出版社,1993:293-294.
[24]徐万里,唐光木,葛春辉,等.长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响[J].生态学报,2015,35(2):468-477.
XU W L,TANG G M,GE C H,etal.Effects of long-term fertilization on diversities of soil microbial community structure and function in grey desert soil of Xinjiang[J].ActaEcologicaSinica,2015,35(2):468-477.
[25]KONOPKA A,OLIVER L,TURCO R F.The use of carbon substrate utilization patterns in environmental and ecological microbiology[J].MicrobialEcology,1998,35(2):103-115.
[26]李雪峤,吴凤芝.盐胁迫下苯丙烯酸对黄瓜幼苗生长及根际土壤酶活性的影响[J].中国蔬菜,2010,(18):15-22.
LI X Q,WU F Z.Effects of cinnamic acid on cucumber seeding growth and rhizosphere soil enzyme activities under salt stress[J].ChinaVegetables,2010,(18):15-22.
[27]BAREA J M,AZCON R,HAYMAN D S.Possible synergistic interactions between Endogone and phosphate-solubilizing bacteria in low-phosphate soils[M]//SANDERS F E,MOSSE B,TINKER P B.Endomycorrhizas.Proc Symp Univ Leeds.Academic Press,New York,1975:409-417.
[28]MIRANSARI M.Interactions between arbuscular mycorrhizal fungi and soil bacteria[J].AppliedMicrobiologyandBiotechnology,2011,89(4):917-930.
[29]SANDHYA A,VIJAYA T,SRIDEVI A.Co-inoculation studies of vesicular arbuscular mycorrhizal fungi (VAM) and phosphate solubilizing bacteria (PSB) on nutrient uptake ofMarsdeniavolubilis(T.Cooke)[J].AnnalsofPlantSciences,2014,3(7):765-769.
[30]张恩和,张新慧,王惠珍.不同基因型春蚕豆对磷胁迫的适应性反应[J].生态学报,2004,24(8):1 589-1 593.
ZHANG E H,ZHANG X H,WANG H Z.Adaptable effects of phosphorus stress on different genotypes of faba-bean[J].ActaEcologicaSinica,2004,24(8):1 589-1 593.
[31]梁翠月,廖红,严小龙等.酸性磷酸酶参与大豆子叶磷转运和利用[J].植物生理学报,2011,47(1):69-74.
LIANG C Y,LIAO H,YAN X L,etal.Involvement of acid phosphatase in phosphorus mobilization and utilization in cotyledons of Soybean (GlycinemaxL.) [J].PlantPhysiologyJournal,2011,47(1):69-74.
[32]BEVER J D,SCHU LTZ P A,PRING LE A,etal.Arbuscular mycorrhizal fungi:more diverse than meets the eye,and the eco-logical tale of why[J].Bioscience,2002,51:923-931.
[33]姬兴杰,熊淑萍,李春明,等.不同肥料类型对土壤酶活性与微生物数量时空变化的影响[J].水土保持学报,2008,22(1):123-127,133.
JI X J,XIONG S P,LI C M,etal.Studies on spatial-temporal variations of soil enzyme activities and microorganism’s number under different fertilizer types[J].JournalofSoilandWaterConservation,2008,22(1):123-127,133.
(编辑:裴阿卫)
Effects of PSB and AMF on Growth,Microorganisms and Soil Enzyme Activities in the Rhizosphere ofTaxuschinensisvar.maireiSeedlings
FU Xiaofeng1,2,ZHANG Guiping1,2*,ZHANG Xiaowei3,REN Jiahong1,2
(1 College of Biological Sciences,Shanxi Normal University,Linfen,Shanxi 041000,China;2 Department of Biological Sciences and Technology,Changzhi University,Changzhi,Shanxi 046011,China;3 Longquan Forestry Bureau,Longquan,Zhejiang 323700,China)
Abstract:In order to make certain the effects of inoculations in the seedlings of Taxus chinensis var.mairei at the micro-ecological level,we studied the number of culturable microorganisms,the enzyme activity and the soil microbial functional diversity of rhizosphere soil,after inoculated with Sinorhizobium meliloti CHW10B (phosphate solubilizing bacteria,PSB) and/or Glomus constrictum (arbuscular mycorrhizal fungi,AMF).The results showed that:(1)inoculation had significant growth-promoting effects in Taxus chinensis var.mairei.The height,ground diameter and biomass of the inoculated groups had significantly increased when compared with the control group.(2)The number of culturable bacteria,fungi and actinomycetes contents in the rhizosphere soil of Taxus chinensis var.mairei were higher obviously compared with those of the control with the extension of time.Inoculation can improved the soil microbial carbon utilization,changed the species richness of soil and increased the soil biodiversity.(3)Inoculation increased the activities of enzymes in the soil,included acid phosphatase,dehydrogease and invertase.All these benefits are especially for co-inoculation treatment.These results indicated there were synergistic benefits between PSB (Sinorhizobium meliloti CHW10B) and AMF (Glomus constrictum).Moreover,the growth-promoting effect of co-inoculation depend on the increase of the number of culturable microorganisms in rhizosphere soil of Taxus chinensis var.mairei,soil enzyme activity and soil biodiversity which lead to soil enhancement of microbial carbon utilization and soil fertility.
Key words:phosphate-solubilizing bacteria;Arbuscular mycorrhizal fungi (AMF);Taxus chinensis var.mairei;double-inoculation;rhizosphere microorganisms;soil enzyme activity
中图分类号:Q945.79
文献标志码:A
作者简介:付晓峰(1991-),女,硕士研究生,主要从事生态学研究。E-mail:342954759@qq.com*通信作者:张桂萍,博士,教授,硕士生导师,主要从事生态学研究。E-mail:zgp0355@126.com
基金项目:国家自然科学基金(31100471);山西省高校重点学科建设专项资金项目(20111051,20131008,20111050)
收稿日期:2015-10-12;修改稿收到日期:2016-01-11
文章编号:1000-4025(2016)02-0353-08
doi:10.7606/j.issn.1000-4025.2016.02.0353
