丛枝菌根真菌侵染根系的过程与机理研究进展
2015-10-28岳辉刘英
岳辉 刘英

摘要:丛枝菌根是土壤中的菌根真菌与植物形成的一种真菌-植物联合共生体,目前研究较为成熟的是在种群和群落水平上,主要应用在园艺、土地复垦、森林及环境修复等方面。近年来,在细胞水平和分子水平上对菌根真菌-植物共生体的研究取得了较大进展。综述了国内外在菌根真菌侵染根系过程和相关机理的研究进展,并指出今后仍需在分子水平上继续对丛枝菌根真菌侵染根系的机理进行深入研究。
关键词: 丛枝菌根真菌;侵染根系;机理
中图分类号:Q949.32;S154.34 文献标识码:A 文章编号:0439-8114(2015)19-4657-04
DOI:10.14088/j.cnki.issn0439-8114.2015.19.001
Abstract: Arbuscular mycorrhizal fungi is a kind of mycorrhizal plants which formed combined symbionts by mycorrhizal fungi in the soil fungi and plant. Present study was limited in the population and community level, mainly in horticulture, land reclamation, forest and environmental restoration. Research progress was also made at the cellular level and molecular level. Process and related mechanism of mycorrhizal fungi infecting root were reviewed. Future study on the mechanism of arbuscular mycorrhizal fungi infecting root should be continued.
Key words: arbuscular mycorrhiza fungi;colonizing root;mechanism
丛枝菌根是自然界中一种普遍存在的共生现象,它是土壤中的丛枝菌根真菌与植物形成的一种真菌-植物联合共生体。这种共生现象在世界各地土壤中广泛分布,能与菌根形成共生关系的植物包括70%~90%的高等植物和少量蕨类植物以及极少的苔藓植物。丛枝菌根真菌通过地下菌丝网络和植物紧密地联系在一起,菌根真菌通过菌丝网络从植物体内获取必要的碳水化合物等有机营养物质来供给自身的生长和发育,而植物则可以从中获取由菌根真菌吸收的矿质营养元素和水分等无机营养物质来提高自身的营养水平,这种共生关系有时会发展到双方难分难舍的程度,植物缺乏菌根真菌无法生存下去,而菌根真菌缺乏必需的植物根系共生则无法完成生活史,不能继续繁殖。一般认为,真菌-植物这种互惠互利的营养关系使得双方能够达到互利互助、互通有无的高度统一。
丛枝菌根真菌在生态学和生理学上均具有其独特的特点(图1)。丛枝菌根真菌生态学特点主要体现在其孢子在土壤中形成并且大小比菌根真菌大很多(50~500 μm),且菌根真菌菌丝是无隔膜和多核体结构,即数百个细胞核生长在同一细胞质中。丛枝菌根真菌生理学特点主要为菌根真菌是无性繁殖的,孢子会在合适的条件下萌发并且侵染根系,菌丝穿透根系的皮层进入根细胞内,形成菌根真菌独有的菌丝器官:丛枝和泡囊。后来研究发现部分菌根真菌并不在根内产生泡囊,但一般都形成丛枝结构,故简称丛枝菌根(Arbuscular mycorrhiza,AM)。植物根系被丛枝菌根真菌感染形成菌根后, 根系主要是根毛部分的外部形态很少或几乎没有发生变化,用肉眼一般很难区别出有无丛枝菌根形成。丛枝菌根真菌的根外菌丝进入植物根系皮层细胞后,在适当条件下菌丝可发育成泡囊、丛枝、根内菌丝或者根内孢子等结构,只有经染色等技术处理后, 在显微镜下才能观察到。
1 菌根真菌侵染根系的过程
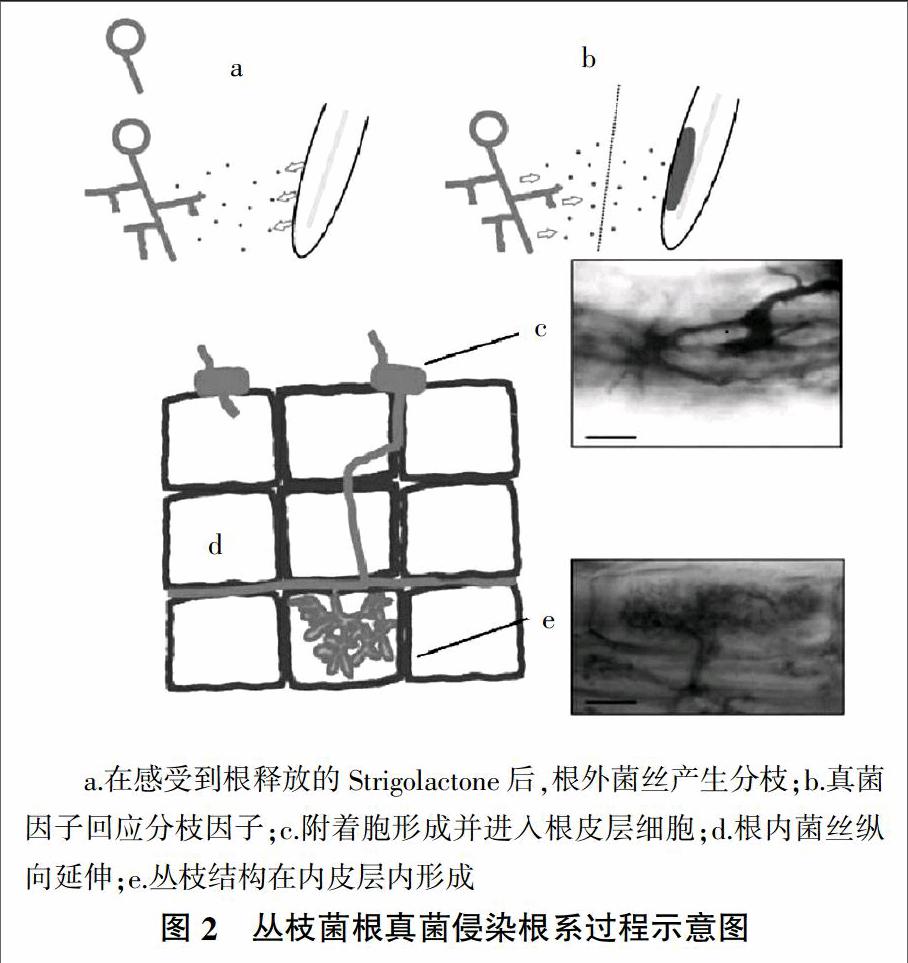
丛枝菌根真菌属于球囊菌门(Glomeromycota),它是专性活体共生真菌,即只有在共生植物存活的条件下才能完成其生命史。研究表明,丛枝菌根真菌的生命史开始于孢子萌发,之后根外菌丝在宿主植物根皮层形成侵入点,然后菌根真菌菌丝进入根皮层细胞后形成泡囊和丛枝[1]。正是由于泡囊和丛枝这两大典型结构,丛枝菌根在最初被命名为泡囊-丛枝菌根(Vesicular - arbuscular mycorrhiza, VAM),由于部分菌根真菌不在根内产生泡囊,且都形成丛枝结构,故简称丛枝菌根(Arbuscular mycorrhiza, AMF),如图2所示。
根外菌丝侵入根皮层细胞后形成附着胞(Appressoria),然而对于真菌-植物共生体来说,附着胞形成之前涉及到一系列的信号识别和物质互相吸引的过程。Siciliano等[2]将其描述为根外菌丝会产生一种叫做真菌因子(Myc factor)的物质,并通过诱导钙振动(Calcium oscillation)在根表皮细胞中激活与共生体有关的基因。Genre等[3]则认为菌根真菌成熟的菌丝会形成特殊的一种附着枝(Hyphopodia),经过随后化学和机械刺激,菌丝在植物根系细胞内产生了一种侵入前期器官(Prepennetration apparatus,PPA),之后延伸的菌丝进入PPA,将会引导真菌通过根细胞进入根皮层细胞,并在质外体中发生分枝,沿着根轴线生长,菌丝会诱导类似PPA的结构发育,并随后进入皮层细胞形成丛枝结构。以往的研究已证实,泡囊作为菌根真菌的储藏器官,并不一直在菌根真菌中形成,而新的孢子将会在根外菌丝顶端形成,从而进行下一个生命史,周而复始[4]。
2 菌根真菌侵染根系的机理
2.1 菌根-植物共生体信号机制
Mosse[5]认为菌根真菌的孢子在土壤中休眠和自主萌发活动是由植物主导信号决定的。即菌根真菌-植物共生体由植物占主导地位。研究已证实,根系的分泌物和挥发物会抑制或者促进孢子的萌发,孢子会对环境中化学成分的变化产生相应的感受反应[6]。有研究表明,孢子萌发后菌根真菌的芽管在穿过土壤过程中,在遇到潜在的宿主植物根系之前,菌丝的延伸和发育受到孢子内储存的碳的限制[7]。而目前研究最多的是主导信号,Gomez等[8]认为菌根真菌-植物共生体的形成始于彼此之间的信号交换,植物主导分枝因子(Branching factor)产生的信号会诱导孢子萌发,之后引起根外菌丝强烈分枝,根外菌丝的大量增殖增加了其接触到宿主植物根系的机会,同时菌根真菌也释放真菌因子以诱导植物根细胞中的基因表达发生变化,从而为菌根真菌的侵入并与根细胞相结合做好准备(图2)。目前还不清楚菌根真菌主导的真菌因子的具体化学成分,研究现已证实,植物主导的分枝因子是由根系分泌物中的独角金内酯来表达的。独角金内酯(Strigolactones)是一种新的植物激素,其作用与生长素和细胞分裂素类似,它们能够协同作用调节和控制植物的侧枝生长,以维持植物的株型。Umehara 等[9]认为,独脚金内酯的双重生物学功能表明其在协调植物地上部分和地下部分的生长过程中起着关键作用。独角金内酯是一种倍半萜烯化合物,其分子骨架结构由4个环组成,主要在植物的根中由类胡萝卜素代谢合成[10]。目前已经从很多植物的根中分离出这种物质,与独角金内酯合成相关的基因发现于所有的高等植物中,其天然产物中主要有5种:5-脱氧独角金醇(5-deoxystrigol)、独脚金醇(Strigol)、高粱内酯(Sorgolactone)、黑蒴醇(Alectrol)和列当醇(Orobanchol);人工合成的类似物有GR24、GR6和GR7等[11]。虽然在植物根细胞中独角金内酯合成的具体途径还不很清楚,但对几种植物的遗传分析表明,独角金内酯的产生源于胡萝卜素的裂解产物。目前已知有3个酶参与这一过程,胡萝卜素裂解双加氧酶7(CCD7,MAX3/RMS5/HTD1/D17)、胡萝卜素裂解双加氧酶8(CCD8,MAX4/RMS1/DAD1/D10)和细胞色素P450单加氧酶(Cyt P450,MAX1)[12]。独角金内酯的生理作用体现在它能够诱导菌根真菌根外菌丝的分枝和激活真菌的线粒体,研究发现真菌细胞呼吸作用在受到诱导后明显增加,这可能与根外菌丝不断分裂所需能量有关。独角金内酯可在皮克或纳克水平(pg/ng)上发挥作用,每个培养皿中含30 pg的5-脱氧独角金醇的化学提取物质就能诱导珍珠巨孢囊霉(Gigaspora margarita)的菌丝发生强烈的分枝[13]。
2.2 菌根真菌-植物共生体的共生关系
菌根真菌-植物共生关系是研究菌根真菌的基础,化石资料表明,起源于大约4亿年前的这种共生关系在植物从水生演变到陆生的进化过程中起着重要作用[14]。这种共生关系也是地球陆地生态系统中最重要的共生关系之一,它对植物的生物多样性和生态系统的稳定性都具有重大影响。菌根真菌被认为是专性活体共生真菌,植物与菌根真菌的共生关系建立在营养物质互相交换的基础之上[15]。丛枝菌根真菌并不是宿主专一型的菌类,一种菌根真菌可以同时侵染大量的某一类植物,也可以侵染大量的不同类植物[16]。草本植物等小型植物和木本植物等大型植物能够被同一菌根真菌个体侵染,因此不同种植物之间可以通过菌根真菌网络互相联系[17]。这种菌根真菌网络的存在揭示了菌根真菌在不同种类植物之间分配营养物质和水分等资源与植物在植物种群中植株个体大小、在植物群落中相对的优势地位及在生态系统中的身份无关。
研究表明,在植物根中独角金内酯的合成受到植物营养状况的支配。即寄主植物主导独角金内酯的合成和分泌,当土壤中磷元素缺乏时,独角金内酯的合成会增加,当土壤中磷元素饱和时,独角金内酯的分泌会减少。与此类似的是,植物的分枝也受其自身营养条件的制约,植物在缺乏营养的条件下其自身的分枝会受到抑制。同时,植物与丛枝菌根真菌的共生关系也受到植物营养状况的调控,植物处于营养元素匮乏状态下时会促进与丛枝菌根真菌形成共生关系,反之,菌根真菌与植物之间的关系有可能演变为寄生关系。陈彩艳等[18]认为独角金内酯调控植物分枝和真菌共生属于开源节流的调控模式,当土壤中营养元素缺乏时,植物根系会加速合成独角金内酯并释放到土壤中,加速菌根真菌与自身的根系建立共生关系,从而利用菌根真菌来改善自身的营养状况;同时,独角金内酯向叶冠部分输送以限制植物的分枝来节约使用有限的营养物质用以供给地下菌丝的增殖和扩繁。当植物与真菌的共生关系形成后,植物的营养状况会因为植物菌根共生关系的建立而得到改善,植物也会随之减少独角金内酯的合成,促进植物的分枝形成并减少与真菌的共生,这时菌根真菌与植物共生也会因独角金内酯分泌减少而得以控制。试验证明,西红柿的独角金内酯在缺磷状态下受到磷元素缺乏的诱导,西红柿根的提取物比磷饱和状态下的根提取物更能诱导丛枝菌根外菌丝分枝[19]。
3 小结与展望
丛枝菌根真菌是一种普遍存在于陆生植物根际的有益共生微生物,作为陆地生态系统中的“关键共生物”,菌根真菌在土壤贫瘠的条件下,可通过其复杂的地下菌丝网络来提高植物对矿质元素和水分的吸收[20];促进土壤团聚体的形成;在极端环境下,通过改善寄主自身的营养来增强植物抗逆性的能力;在此基础上使土壤微生态环境得到明显改善[21]。菌根植物根际分泌大量的化学物质,在数量上和质量上都直接或间接影响根际中的微生物群体。丛枝菌根真菌优良的生理生态特点引起了国内外学者极大关注,对菌根真菌-植物共生体开始了广泛的研究。目前在种群和群落水平上,丛枝菌根真菌主要应用在农业、园艺、森林以及环境修复,用来增加农作物产量和限制农药的使用[22]。在细胞水平上,Paszkowski等[23]描述了菌根真菌侵染植物根系的过程,Genre等[3]描述了菌根发育的过程,Zocco等[24]分析了菌根真菌新陈代谢和营养物质运输的过程。而未来菌根真菌的发展方向则在分子水平上,目前已有相关研究,比如Kistner[25]找到了豆科植物中决定丛枝菌根和根瘤菌共生关系的7种基因,Sally等[26]分析了丛枝菌根和根瘤菌共生关系基因控制信号传导的过程等,但在分子水平上的研究则是解决丛枝菌根真菌发育并侵染根系机理的本质所在。
参考文献:
[1] GENRE A, CHABAUD M, TIMMERS T, et al. Arbuscular mycorrhizal fungi elicit a novel intracellular apparatus in Medicago truncatula root epidermal cells before infection[J]. Plant Cell,2005,17:3489-3499.
[2] SICILIANO V, GENRE A, BALESTRINI R, et al. Transcriptome analysis of arbuscular mycorrhizal roots during development of the prepenetration apparatus[J]. Plant Physiol,2007, 144:1455-1466.
[3] GENRE A, CHABAUD M, FACCIO A, et al. Prepenetration apparatus assembly precedes and predicts the colonization patterns of arbuscular mycorrhizal fungi within the root cortex of both Medicago truncatula and Daucus carota[J]. Plant Cell,2008,20:1407-1420.
[4] GUS MAYER S, NATON B, HAHLLBROCK K, et al. Local mechanical stimulation induces components of the pathogen defense response in parsle[J]. Proc Natl Acad Sci USA,1998,95:8398-8403.
[5] MOSSE B. The regular germination of resting spores and some observations on the growth requirements of an Endogone sp. causing vesicular-arbuscular mycorrhiza[J]. Transactions of the British Mycological Society,1959, 42:273-286.
[6] BESSERER A, BECARD G, JAUNEAU A. GR24, a synthetic analog of strigolactones, stimulates the mitosis and Growth of the arbuscular mycorrhizal fungus gigaspora rosea by boosting its energy metabolism[J]. Plant Physiology-Plant Physiol,2008, 148(1):402-413.
[7] BAGO B, PFEFFER P, SHACHAR Y. Carbon metabolism and transport in arbuscular mycorrhizas[J]. Plant Physiology,2000, 124:949-958.
[8] GOMEZ R V, FERMAS S, BREWER P B, et al. Strigolactone inhibition of shoot branching [J].Nature,2008,455(7210):189-194.
[9] UMEHARA M, HANADA A, YOSHIDA S, et al. Inhibition of shoot branching by new terpenoid plant hormones[J]. Nature,2008,455(7210):195-200.
[10] CATHERINE R. Strigolactones, a novel class of plant hormone controlling shoot branching[J]. Comptes Rendus Biologies,2010,333(4):344-349.
[11] AKIYAMA K, HAYASHI H. Strigolactones: Chemical signals for fungal symbionts and parasitic weeds in plant roots[J]. Ann Bot (Lond),2006,97(6):925-931.
[12] DAVID R. Plant cytochrome P450s from moss to poplar[J]. Phytochemistry Reviews - Phytochem Rev, 2006,5(2):193-204.
[13] SOREFAN K, BOOKER J, HAUROGNE K, et al. MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching in Arabidopsis and pea[J]. Genes Dev,2003,17(12):1469-1474.
[14] VAN DER HEIJDEN, KLIRONOMOS J, URSIC M, et al. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity[J]. Nature,1998,396:69-72.
[15] HORTON T R, VAN DER HEIJDEN. The Role of Symbiosis in Seedling Establishment and Survival. Seedling Ecology and Evolution [M]. London: Cambridge University Press,2008.
[16] SIMARD S W, PERRY D A, SMITH J E, et al. Effects of soil trenching on occurrence of ectomycorrhizas on Pseudotsuga menziesii seedlings grown in mature forests of Betula papyrifera and Pseudotsuga menziesii[J]. New Phytologist,1997,136:327-340.
[17] JAMES D B, BEVER I A, DICHIE E F, et al. Rooting theories of plant community ecology in microbial interactions[J]. Trends in Ecology and Evolution,2010,25(8):468-478.
[18] 陈彩艳,邹军煌,张淑英,等.独角金内酯能抑制植物的分枝并介导植物与枞枝真菌及寄生植物间的相互作用[J].中国科学C辑:生命科学,2009,39(6):525-533.
[19] ELIAS K S, SAFIR G R. Hyphal elongation of glomus fasciculatus in response to root exudates[J]. Appl Environ Microbiol,1987,53(8):1928-1933.
[20] FROST S M, STAH D D, WILLIAMS S E. Long-term reestablishment of arbuscular mycorrhizal fungi in a drastical disturbed semiarid surface mine soil[J]. Arid Land Research and Management,2001,15(1):3-12.
[21] 冯 固,杨茂秋,白灯莎. 盐胁迫对菌根形成的影响及接种VA菌根真菌对植物生长的效应[J]. 应用生态学报,1999,10(1):77-82.
[22] GIANINAZZI S, SCHUEPP H, BAREA H, et al. Mycorrhizal technology in agriculture: From genes to bioproducts[M]. Basel: Birkhauser Press,2002.
[23] PASZKOWSKI U, JAKOLEVA L, BOLLER T. Maize mutantsaffected at distinct stages of the arbuscular mycorrhizal symbiosis[J]. Plant J,2006,47:165-173.
[24] ZOCCO D, INGRID M, VAN A, et al. Fenpropimorph and fenhexamid impact phosphorus translocation by arbuscular mycorrhizal fungi[J]. Mycorrhiza,2011,21(5):363-374.
[25] KISTNER C. Seven Lotus japonicus genes required for transcriptional reprogramming of the root during fungal and bacterial symbiosis[J]. Plant Cell,2005,17:2217-2229.
[26] SALLY E, SMITH F, FACELLI E, et al. Plant performance in stressful environments: Interpreting new and established knowledge of the roles of arbuscular mycorrhizas[J]. Plant and Soil-Plant Soil,2010,326(1):3-20.
