党参、甘草糖提取物对小肠上皮细胞迁移多胺信号通路的影响
2016-03-24李茹柳陶玉珠赵世清林传权陈蔚文
李茹柳,陶玉珠,曾 丹,赵世清,林传权,陈蔚文
(1.广州中医药大学脾胃研究所,广东 广州 510405;2.广州中医药大学中药学院,广东 广州 510006)
党参、甘草糖提取物对小肠上皮细胞迁移多胺信号通路的影响
李茹柳1,陶玉珠1,曾丹1,赵世清2,林传权1,陈蔚文1
(1.广州中医药大学脾胃研究所,广东 广州510405;2.广州中医药大学中药学院,广东 广州510006)
中国图书分类号:R-332;R284.1;R322.45;R329.24;R916.4
摘要:目的观察益气健脾中药党参、甘草的糖提取物对小肠上皮细胞(IEC-6)迁移过程多胺介导钾通道激活信号通路的影响,探讨党参、甘草促进胃肠黏膜损伤修复的作用机制。方法在IEC-6细胞迁移模型上,于正常或抑制多胺(加入DFMO)时,观察党参、甘草糖提取物对该信号通路的作用:(1)Western blot检测钾通道蛋白Kv1.1蛋白表达;(2)流式细胞仪检测细胞膜电位;(3)激光共聚焦显微镜检测细胞内Ca2+水平;(4)Western blot检测Ca2+下游指标RhoA蛋白表达。结果党参、甘草糖提取物在细胞迁移过程可以: (1)提高Kv1.1蛋白表达水平,改善DFMO所致Kv1.1蛋白表达下降;(2)提高细胞膜电位超极化水平,逆转DFMO所致细胞膜电位去极化;(3)提高细胞内Ca2+水平,党参糖提取物可逆转DFMO所致Ca2+水平降低;(4)提高RhoA蛋白表达水平,改善DFMO所致RhoA蛋白表达降低。结论党参、甘草糖提取物促进IEC-6细胞迁移的作用机制与其影响多胺介导钾通道激活信号通路有关。
关键词:党参;甘草;糖提取物;小肠上皮细胞;迁移;作用机制
胃肠黏膜损伤修复包括细胞迁移、分化、增殖等过程,其中细胞迁移是其重要步骤,尤其在早期整复阶段[1]。益气健脾中药能促进胃肠黏膜损伤修复[2],但其作用机制尚不清楚。本课题组近年在小肠上皮(IEC-6)细胞的研究发现,益气健脾中药黄芪、白术、党参、甘草的提取物能促进细胞迁移,作用机制与其影响多胺介导钾通道激活信号通路有关[3-11],其中对党参糖提取物(下文图表中简称CSE)、甘草糖提取物(下文图表中简称GSE)的研究表明,二者均可促进IEC-6细胞迁移,逆转DFMO(多胺合成抑制剂)所致的细胞迁移抑制,提高细胞迁移过程细胞内多胺(精脒)含量,逆转DFMO所致的精脒含量降低[5-6];提示其促进细胞迁移的作用与增加细胞内多胺含量有关,为进一步探讨党参、甘草糖提取物促进细胞迁移的作用机制,本文观察其对多胺介导钾通道激活信号通路相关指标的影响,为党参、甘草胃肠黏膜损伤修复作用机制研究提供参考。
1材料
1.1药材党参药材为桔梗科植物党参Codonopsispilosula(Franch.)Nannf的干燥根;甘草药材为豆科植物甘草(GlycyrrhizauralensisFisch.)的干燥根及根茎,由广州中医药大学中药鉴定教研室童家赟讲师鉴定。
1.2试剂高糖DMEM(Cat.No.12800-017)、胎牛血清(Cat.No.10099-141)、青-链霉素(Cat.No.15140-122),均为Gibco公司产品。精脒(spermidine,SPD,Cas.No.124-20-9,Cat.No.85558,分子质量145.25)、二氟甲基鸟氨酸(α-difluoromethylornithine,DFMO,Cas.No.96020-91-6,Cat.No.288500-25MG,分子量236.7),美国Calbiochem公司产品;胰酶(1 ∶250,Cas.No.9002-07-7,Cat.No.0458-250G),美国Amresco公司产品;蛋白提取试剂盒(Cat.No.269-500),美国Biovion公司产品;BCA蛋白浓度测定试剂盒(Cat.No.BP312),南京碧波生物科技有限公司产品;Kv1.1一抗为多克隆兔抗(Cat.No.ab32433),RhoA一抗为多克隆兔抗(Cat.No.ab68826),均为英国Abcam公司产品;GAPDH一抗为多克隆兔抗(Cat. No.10494-1-AP),美国Proteintech公司产品;HRP标记羊抗兔二抗(Cat.No.EO30120-01),美国EarthOx公司产品;ECL高灵敏度化学发光检测试剂盒(Cat.No.CW0049),北京康为世纪生物科技有限公司产品;牛血清白蛋白(Cat. No.738323),Roche公司产品;脱脂奶粉(Cat.No.Q/NYLB 0039S),伊利公司产品;膜电位荧光探针DiBAC4(3)(Cat.No.61011,Lot.No.10D0819),美国Biotium公司产品。
1.3仪器Smart specphus核酸蛋白测定仪,iMark酶标仪,ChemiDoc XRS化学发光成像系统,均为美国Bio-Rad公司产品;FACSCalibur型流式细胞仪,美国BD公司产品;SP2型激光共聚焦显微镜,德国Leica公司产品;激光共聚焦显微镜专用玻底培养皿(35 mm×12 mm),丹麦NUNC公司产品;3111型CO2培养箱,美国Thermo Scientific公司产品;AUW120D型分析天平,日本岛津公司产品。
1.4细胞IEC-6细胞(大鼠小肠隐窝上皮细胞),购自ATCC(American Type Culture Collection),Catalog No.CRL-1592,Lot.4988325。
2方法
2.1党参和甘草糖提取物制备党参、甘草糖提取物制备:称取党参或甘草饮片200 g,石油醚回流提取1 h。药渣挥干溶剂后,用体积分数为0.80的乙醇回流提取2次,每次1 h;药渣再用蒸馏水回流提取2次,每次1 h,合并2次水提液,减压浓缩至浓度为含药材0.5 kg·L-1;浓缩液加无水乙醇至乙醇体积分数为0.80,4℃静置过夜,以布氏漏斗加滤纸抽滤,去上清液,沉淀物加水溶解,再加无水乙醇使乙醇体积分数为0.80后,沉淀过夜,重复3次;所得沉淀物加纯水溶解成水溶液,以Sevage试剂(氯仿 ∶正丁醇=5 ∶1)萃取,取上层水相过大孔树脂,以蒸馏水洗脱,直至收集的洗脱液与5倍量体积分数为0.95的乙醇混合不产生浑浊,洗脱液加无水乙醇至乙醇体积分数为0.80,所得沉淀物分别用体积分数为0.95的乙醇、无水乙醇、丙酮、乙醚洗涤,真空干燥,4℃保存。使用时加PBS配制成5 g·L-1党参或甘草糖提取物溶液,0.22 μm滤膜过滤。苯酚-硫酸法以分光光度计测得党参、甘草糖提取物平均含量(以葡萄糖计)分别为41.0%和49.3%。
2.2Western blot法检测Kv1.1、RhoA蛋白表达细胞培养及给药方法:细胞以4×108·L-1,每孔2 mL接种于6孔板,DMEM培养液含10%胎牛血清(FBS)、10 mg·L-1胰岛素、100 kU·L-1青霉素-链霉素,5%CO2,95%空气,饱和湿度下37℃培养24 h,用刻刀沿6孔板底部中央轻轻划一直线划痕,迅速加入受试药(党参、甘草糖提取物终浓度为50、100 mg·L-1)及完全培养基每孔2.5 mL;DFMO负荷实验则在加受试药(党参、甘草糖提取物终浓度为100、200 mg·L-1)同时加入DFMO 2.5 mmol·L-1,在5%CO2,95%空气,饱和湿度下37℃培养24 h。
总蛋白提取及测定:细胞培养24 h后,吸弃培养液,PBS冲洗细胞表面2次,加适量PBS,细胞刮刀轻轻将细胞从壁上完全刮下,将含有细胞的PBS液收集到5mL离心管,离心后收集细胞,提取总蛋白。总蛋白少量用于蛋白浓度测定,其余予5×蛋白上样缓冲液以4 ∶1比例混匀,100℃水浴煮沸5 min使蛋白变性,置冰上5 min,然后10 000 r·min-1离心1 min,-20℃分装保存。蛋白浓度测定按BCA试剂盒说明书操作。
Western blot法操作:蛋白上样量为每孔20 μg,SDS-PAGE凝胶电泳(起始电压60 V,条带到达分离胶后调至120 V),蛋白转移至PVDF膜(转膜电流300 mA,时间1 h)。PVDF膜用5%脱脂奶粉封闭,分别用一抗Kv1.1、RhoA(均1 ∶1 000稀释)孵育过夜,洗膜,二抗(1 ∶10 000稀释)孵育2 h,洗膜,ECL法显色;X线片曝光条带并显影定影,化学发光成像仪Image J图像处理软件画图工具圈起条带,所得mean值即各条带的平均灰度值。比较各组Kv1.1/GAPDH或RhoA/GAPDH平均灰度比值。
2.3流式细胞仪检测细胞膜电位(Em)[12]细胞培养及给药方法:细胞生长至80%~90%,消化细胞制作单细胞悬液;以4×108·L-1,每孔2 mL接种于6孔板,37℃、5%CO2,饱和湿度培养24 h,用1 mL移液器吸头在6孔板底部中央轻轻划一个“十”字划痕,PBS冲洗细胞表面3次,迅速加入受试药(党参、甘草糖提取物终浓度为50、100 mg·L-1)及完全培养基每孔2.5 mL;DFMO负荷实验则在加受试药(党参、甘草糖提取物终浓度为100、200 mg·L-1)同时加入DFMO 2.5 mmol·L-1,每组3个复孔,37℃、5%CO2,饱和湿度下培养。
细胞悬液制备及荧光标记:加入受试药后培养12 h,HBSS(D-Hanks缓冲液)冲洗细胞2次,加入胰酶消化,细胞回缩变圆后,加等量DMEM终止消化;3 000 r·min-1离心5 min,弃上清液,加入HBSS重悬;再离心,弃上清液,每个离心管(6孔板每孔细胞收集于1个离心管)加入含1 μmol·L-1DiBAC4(3)溶液的HBSS 1 mL。CO2培养箱中避光孵育8 min,此过程每2 min摇晃混匀1次,使染料与细胞充分结合。孵育完毕,3 000 r·min-1离心5 min;弃上清液,加入适量HBSS重悬,离心,转入流式管,上流式细胞仪检测;激发波长488 nm,发射波长520 nm,每管检测10 000个细胞,同时设不标记的空白细胞管用于调零。比较各组的平均荧光强度(mean值)进行统计。
DiBAC4(3)是细胞膜电位敏感的亲脂性阴离子荧光染料,根据其在细胞内外的重新分布,可无损伤地测定细胞膜电位的变化。DiBAC4(3)本身无荧光,当进入细胞与胞质内的蛋白质结合后发出荧光。DiBAC4(3)进入细胞内增多,荧光增强时,表明膜电位负值减小,膜去极化;反之,细胞内荧光强度降低则表示细胞膜超极化。
2.4激光共聚焦显微镜检测细胞Ca2+水平[13]细胞培养及给药方法:细胞生长至80%~90%,消化细胞制作单细胞悬液;以4×108·L-1,每孔2 mL接种于激光共聚焦培养皿中,37℃、5%CO2,饱和湿度下培养24 h,用1 mL移液器吸头沿底部中央轻轻划一直线划痕,PBS冲洗细胞表面3次,迅速加入受试药(党参、甘草糖提取物终浓度为50、100 mg·L-1)及完全培养基每孔2.5 mL;DFMO负荷实验则在加受试药(党参、甘草糖提取物终浓度为100、200 mg·L-1)同时加入DFMO 2.5 mmol·L-1;每组2个复孔,37℃、5%CO2,饱和湿度下培养。
荧光物质孵育:各组加入受试药培养12 h,HBSS冲洗2次,每个培养皿加入终浓度为5 μmol·L-1的Fluo-3/AM探针装载液1 mL,CO2培养箱中避光孵育30 min,吸弃探针装载液,HBSS冲洗细胞3次,加入适量HBSS,CO2培养箱中避光孵育20 min。激光共聚焦显微镜下放大200倍进行荧光图片采集,每个培养皿选择划痕附近迁移细胞6个视野采集荧光图片。
平均荧光强度计算:IPP软件将图片转成灰度图片,测量累积光密度值(IOD)与area。每张图片的IOD即为其总荧光强度,再以显微镜数出每张图片的细胞个数;IOD除以细胞总数,即为单张图片每个细胞的平均荧光强度值。
3结果
3.1党参、甘草糖提取物对Kv1.1蛋白表达的影响
3.1.1对Kv1.1蛋白表达的影响(无DFMO负荷)Fig 1蛋白条带灰度值比较,党参糖提取物(50 mg·L-1和100 mg·L-1)与空白组比较均P<0.01;甘草糖提取物50 mg·L-1组与空白组比较P<0.01,甘草糖提取物100 mg·L-1组与空白组比较P<0.05;表明党参、甘草糖提取物能提高细胞迁移过程钾通道蛋白Kv1.1蛋白表达。
3.1.2DFMO负荷时对Kv1.1蛋白表达的影响Fig 2蛋白条带结果可见,DFMO能抑制Kv1.1蛋白表达,党参、甘草糖提取物(100 mg·L-1或200 mg·L-1)能改善DFMO所致Kv1.1蛋白表达抑制。
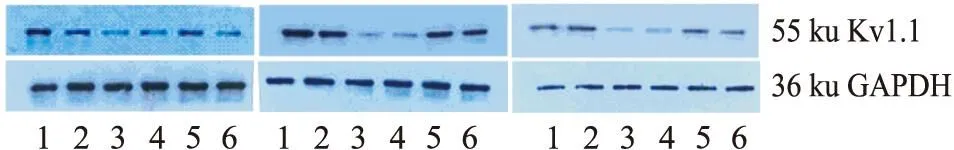
Fig 1 Effect of Codonopsis and Glycyrrhizae saccharide
1:CSE100 mg·L-1;2: CSE 50 mg·L-1;3:Control;4:spermindine 5 μmol·L-1;5: GSE 50 mg·L-1;6: GSE 100 mg·L-1
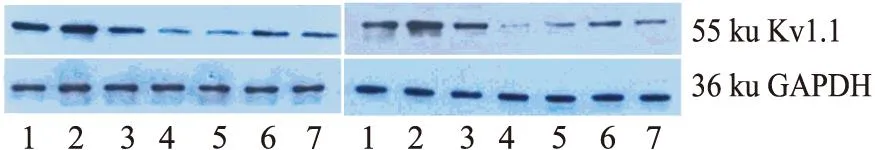
Fig 2 Effect of Codonopsis and Glycyrrhizae saccharide
1:DFMO+CSE 200 mg·L-1;2: DFMO+ CSE 100 mg·L-1;3:Control;4:DFMO 2.5 mmol·L-1;5:DFMO+spermidine 5 μmol·L-1;6: DFMO+GSE 100 mg·L-1;7: DFMO+GSE 200 mg·L-1
3.2党参、甘草糖提取物对细胞膜电位的影响
3.2.1对细胞膜电位的影响(无DFMO负荷)Fig 3和Tab 1结果显示,党参、甘草糖提取物组(50 mg·L-1)细胞的平均荧光强度低于空白组(P<0.01),表明其细胞膜超极化水平高于空白组,Em增加。表明党参、甘草糖提取物可增加细胞膜超极化水平,提高细胞膜电位。
Tab 1 Effect of Codonopsis and Glycyrrhizae
***P<0.01vscontrol
3.2.2DFMO负荷时对细胞膜电位的影响Tab 2结果显示,DFMO模型组细胞平均荧光强度高于空白组(P<0.05),表明DFMO组细胞膜去极化水平高于空白组,Em降低;党参、甘草糖提取物(100 mg·L-1或200 mg·L-1)能逆转DFMO所致细胞膜去极化(与模型组比较P<0.05或P<0.01)。
3.3党参、甘草糖提取物对细胞Ca2+水平的影响
3.3.1对细胞Ca2+水平的影响(无DFMO负荷)Fig 4和Tab 3结果显示,党参、甘草糖提取物(50 mg·L-1或100 mg·L-1)能提高细胞迁移过程细胞Ca2+水平(与空白组比较P<0.01)。
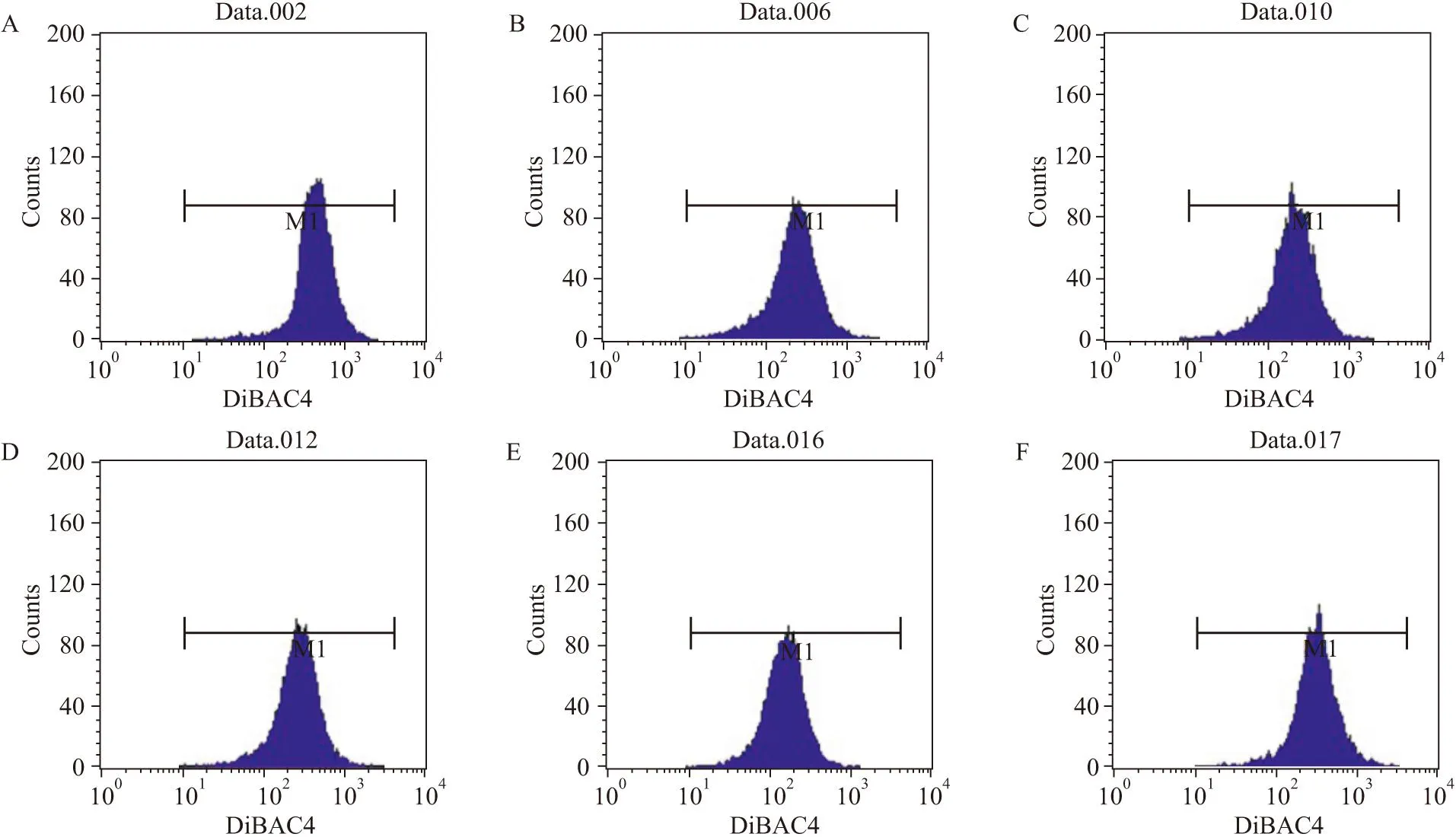
Fig 3 Effect of Codonopsis and Glycyrrhizae saccharide extracts on Em
A:Control; B:Spermidine 5 μmol·L-1;C:CSE 50 mg·L-1;D:CSE 100 mg·L-1;E:GSE 50 mg·L-1;F:GSE 100 mg·L-1
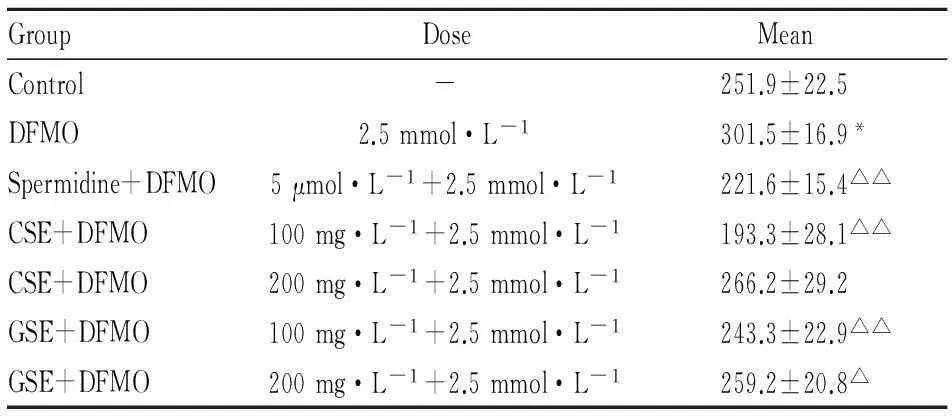
Tab 2 Effect of Codonopsis and Glycyrrhizae
**P<0.05vscontrol;ΔP<0.05,ΔΔP<0.01vsDFMO

Tab 3 Effect of Codonopsis and Glycyrrhizae saccharide
***P<0.01vscontrol
3.3.2DFMO负荷时对细胞Ca2+水平的影响Tab 4结果显示,DFMO负荷时,细胞Ca2+水平降低(模型组与空白组比较P<0.01);党参糖提取物(100 mg·L-1或200 mg·L-1)能逆转DFMO所致Ca2+水平降低(与模型组比较P<0.01)。
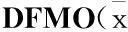
Tab 4 Effect of Codonopsis and Glycyrrhizae saccharide
***P<0.01vscontrol;△△P<0.01vsDFMO
3.4党参、甘草糖提取物对RhoA蛋白表达的影响
3.4.1对RhoA蛋白表达的影响(无DFMO负荷)Fig 5蛋白条带灰度值比较,党参、甘草糖提取物(50 mg·L-1和100 mg·L-1)与空白组比较均P<0.01;表明党参、甘草糖提取物能提高细胞迁移过程RhoA蛋白表达。
3.4.2党参和甘草糖提取物对DFMO负荷下RhoA蛋白表达的影响Fig 6蛋白条带结果可见,DFMO能抑制RhoA蛋白表达,党参、甘草糖提取物(100 mg·L-1或200 mg·L-1)能改善DFMO所致RhoA蛋白表达降低。
4讨论
党参性味甘平,归脾、肺经;功能健脾益肺,养血生津;用于脾肺气虚,食少倦怠,咳嗽虚喘,气血不足,足,面色萎黄,心悸气短,津伤口渴,内热消渴。甘草性味甘平,归心、肺、脾、胃经,功能补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药;用于脾胃虚弱,倦怠乏力,心悸气短,咳嗽痰多,脘腹、四肢痉急疼痛,痈肿疮毒,缓解药物毒性、烈性[14]。党参、甘草是益气健脾著名方剂四君子汤的组成药物,临床和实验研究表明,四君子汤有促进胃肠黏膜损伤修复的作用[15]。
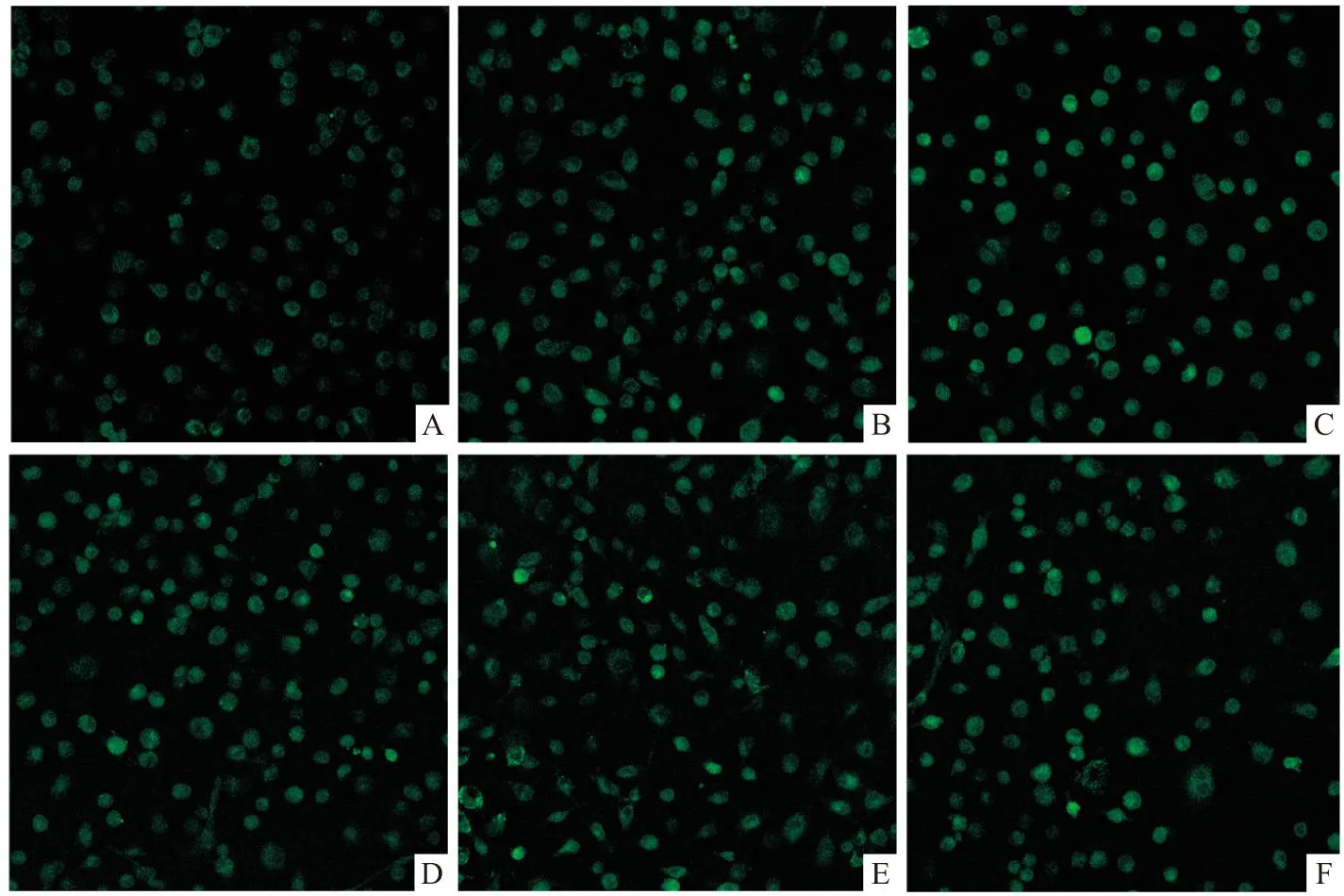
Fig 4 Effect of Codonopsis and Glycyrrhizae saccharide extracts on [Ca2+]cyt(200×)
A:Control; B:Spermidine 5 μmol·L-1;C:CSE 50 mg·L-1;D:CSE 100 mg·L-1;E:GSE 50 mg·L-1;F:GSE 100 mg·L-1
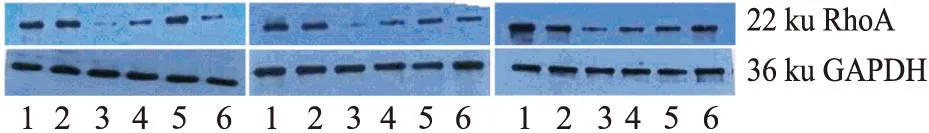
Fig 5 Effect of Codonopsis and Glycyrrhizae
1: CSE 100 mg·L-1;2: CSE 50 mg·L-1;3:Control;4: Spermindine 5 μmol·L-1;5: GSE 50 mg·L-1;6: GSE 100 mg·L-1

Fig 6 Effect of Codonopsis and Glycyrrhizae saccharide extracts
1:DFMO+CSE 200 mg·L-1;2: DFMO+CSE 100 mg·L-1;3: Control;4:DFMO 2.5 mmol·L-1;5: DFMO+spermidine 5 μmol·L-1;6:DFMO+GSE 100 mg·L-1;7: DFMO+GSE 200 mg·L-1
小肠上皮损伤后整复阶段,多胺增加则增强了钾通道蛋白的表达,K+外流,导致细胞膜超极化,增强了Ca2+内流驱动力而提高了细胞内Ca2+水平,后者增加了RhoA活性,使Rho-kinase激活,增加了肌球蛋白轻链磷酸化,从而刺激了应力纤维形成和细胞迁移;相反,消除了细胞内多胺(加入DFMO),则下调了钾通道活性,减少了细胞内Ca2+,使RhoA/Rho-kinse信号通路不激活,减少了肌球蛋白轻链磷酸化,从而抑制了细胞迁移[1]。二氟甲基鸟氨酸(DFMO)是多胺合成的限速酶——鸟氨酸脱羧酶的特异性抑制剂,本课题组前期研究表明,党参、甘草糖提取物可促进小肠上皮(IEC-6)细胞迁移,逆转DFMO所致的细胞迁移抑制,提高细胞迁移过程多胺(精脒)含量,逆转DFMO所致的精脒含量降低[5-6]。本文在此基础上,观察党参糖提取物、甘草糖提取物对IEC-6细胞迁移多胺介导钾通道激活信号通路的影响。结果显示二者在细胞迁移过程可以:提高钾通道蛋白Kv1.1蛋白表达水平,改善DFMO所致Kv1.1蛋白表达下降;提高细胞膜电位超极化水平,逆转DFMO所致细胞膜电位去极化;提高细胞内Ca2+水平,其中党参糖提取物能逆转DFMO所致Ca2+水平降低;提高Ca2+下游指标RhoA蛋白表达水平,改善DFMO所致RhoA蛋白表达降低。本课题组的另一研究表明,党参、甘草糖提取物可逆转钾通道抑制剂4-氨基吡啶(4-AP)所致的细胞迁移抑制及细胞膜去极化[16-17]。结合前期党参、甘草糖提取物在IEC-6细胞的实验结果[5-6],表明其促进IEC-6细胞迁移的作用机制,与其影响多胺介导钾通道激活信号通路有关;此研究结果也与本课题组在益气健脾中药黄芪、白术、党参、甘草提取物的作用类似[3-11]。提示对细胞迁移多胺介导钾通道激活信号通路的影响,可能是益气健脾中药促进胃肠黏膜损伤修复的作用机制之一。
参考文献:
[1]Wang J Y. Cellular signaling in rapid intestinal epithelial restitution: implication of polyamines and K+channels [J].ActaPhysiolSin, 2003, 55(4): 365-72.
[2]危北海主编. 中医脾胃学说应用研究[M]. 北京:北京出版社,1993:79-99.
[2]Wei B H. Application research of spleen-stomach docrines[M]. Beijing:Beijing Press, 1993: 79-99.
[3]胡灿,李茹柳,王静,等. 黄芪和白术提取物对IEC-6细胞迁移的影响 [J]. 中药新药与临床药理,2011,22(1):60-5.
[3]Hu C, Li R L, Wang J, et al. Effects of Astragalus and Atractylodes extracts on IEC-6 cell migration [J].TraditChinDrugResClinPharmacol, 2011, 22 (1): 60-5.
[4]赵世清,温鹏,李茹柳,等. 党参、甘草皂苷和黄酮部位对IEC-6细胞迁移的影响 [J]. 中药药理与临床,2012,28(2):78-81.
[4]Zhao S Q, Wen P, Li R L, et al. Effects of flavonoids and saponins of Radix Codonopsis and Glycyrrhizae on IEC-6 cell migration [J].TraditChinDrugResClinPharmacol,2012, 28(2): 78-81.
[5]温鹏,随晶晶,李茹柳,等. 甘草糖提取物对小肠上皮细胞迁移及多胺含量影响的研究 [J]. 中药材,2012,35(7):1112-6.
[5]Wen P, Sui J J, Li R L, et al. Effect of polysaccharides from Radix Glycyrrhizae on migration and polyamines contents of IEC-6 cell [J].JChinMedMat, 2012, 35(7): 1112-6.
[6]李茹柳,年立全,赵世清,等. 党参对应激性溃疡和细胞迁移及多胺的影响 [J]. 广州中医药大学学报,2013,30(4):519-24,604.
[6]Li R L, Nian L Q, Zhao S Q, et al. Effect of Radix Codonopsis on stress ilcer cell migration and polyamine content in rats[J].JGuangzhouUnivTraditChinMed, 2013, 30(4): 519-24, 604.
[7]李茹柳,陶玉珠,温鹏,等. 甘草黄酮提取物对小肠上皮IEC-6细胞迁移及多胺的影响[J]. 中草药,2013,44(19):2722-6.
[7]Li R L, Tao Y Z, Wen P, et al. Effect of flavonoid from Glycyrrhizae Radix on small intestine epithelium IEC-6 cell migration and intracellular polyamine content[J].ChinTraditHerbalDrugs, 2013, 44(19): 2722-6.
[8]李茹柳,曾丹,温鹏,等. 党参黄酮提取部位对小肠上皮细胞迁移及多胺的影响 [J]. 中药新药与临床药理,2014,25(5):523-6.
[8]Li R L, Zeng D,Wen P, et al. Effect of radix Codonopsis Flavonoids on intestinal endothelial cells 6 migration and polyamines content [J].TraditChinDrugResClinPharmacol, 2014, 25(5): 523-6.
[9]Li R L, Hu C, Sui J J, et al. Effects of polysaccharides from rhizoma atractylodis macrocephalae and from radix astragali on polyamine-mediated K+channels in the IEC-6 migration [J].CellBiolInternat, 2010, 34(8): S2.
[10] Song H P, Li R L, Chen X, et al. Atractylodes macrocephala Koidz promotes intestinal epithelial restitution via the polyamine-Voltage-gated K+channel pathway [J].JEthnopharmacol, 2014, 152 (1): 163-72.
[11] 宋厚盼,李茹柳,王一寓,等. 白术提取物对IEC-6细胞迁移过程多胺信号通路钙离子调控的影响 [J]. 中华中医药杂志,2014,29(5):1361-7.
[11] Song H P, Li R L, Wang Y Y, et al. Effects of atractylodes macrocephala koidz extract on polyamine mediated calcium signaling pathway during intestinal epithelial cell migration[J].ChinaJTraditChinMedPharm, 2014, 29(5): 1361-7.
[12] 宋厚盼,李茹柳,王一寓,等. 小肠上皮细胞迁移过程中膜电位检测方法的建立及应用[J]. 中国药理学通报,2013,29(12):1758-61.
[12] Song H P, Li R L, Wang Y Y, et al. Establishment and application of membrane potential detection method for intestinal epithelial cell migration[J].ChinPharmacolBull, 2013, 29(12): 1758-61.
[13] 王海燕,何韶衡,林珏龙. 激光扫描共聚焦显微镜观察胰蛋白酶对肺上皮细胞游离钙离子的影响[J]. 激光生物学报,2005,14(5):377-9.
[13] Wang H Y, He S H, Lin J L. Effects of free calcium in H292 cells through protease-activated receptor-2 [J].ActaLaserBiolSin, 2005, 14(5): 377-9.
[14] 国家药典委员会. 中华人民共和国药典(2010版一部)[S]. 北京:中国医药科技出版社. 2010:264,80.
[14] The State Pharmacopoeia Commission of P.R. China. Pharmacopoeia of the People’s Republic of China. Volumn I [S]. China Medical Science Press. 2010: 264, 80.
[15] 叶富强,陈蔚文. 四君子汤对胃肠道作用的药理研究[J]. 时珍国医国药,2005,16(1):73-4.
[15] Ye F Q, Chen W W. Pharmacologic effect of SiJunZi decoction on gastrointestinal tract [J].LishizhenMedMatMedRes, 2005, 16(1): 73-4.
[16] 温鹏. 甘草和党参提取物对IEC-6细胞迁移及多胺影响的研究 [D]. 广州中医药大学,2012.
[16] Wen P. The study of the effect of Licorice and Codonopsis extracts on IEC-6 cell migration and polyamines [D].Guangzhou University of Chinese Medicine.2012.
[17] 陶玉珠. 党参和甘草提取物对IEC-6细胞迁移多胺调控信号通路作用的研究 [D]. 广州中医药大学,2013
[17] Tao Y Z. Studies on the effects of codonopsis and licorice on polyamine-mediated signaling pathway in the intestinal epithelial cell migration[D].Guangzhou University of Chinese Medicine,2013.
Effect of Codonopsis and Glycyrrhizae saccharide extracts on polyamine-dependent signaling pathway during cell migration in IEC-6
LI Ru-liu1, TAO Yu-zhu1, ZENG Dan1, ZHAO Shi-qing2, LIN Chuan-quan1, CHEN Wei-wen1
(1.PiweiInstituteofGuangzhouUniversityofChineseMedicine,Guangzhou510405,China;2.SchoolofChineseHerbalMedicine,GuangzhouUniversityofChineseMedicine,Guangzhou510006,China)
Abstract:AimsTo observe the effect of saccharide extracts of Yiqijianpi herb Codonopsis and Glycyrrhizae on polyamine-dependent activation of K+channels signal pathway during cell migration and to investigate their mechanism of promoting restoration in gastrointestinal mucosal injuries. MethodThe study was based on IEC-6 cell migration model. While in a normal polyamine level or polyamine was inhibited by DFMO, the effect of Codonopsis saccharide extracts and Glycyrrhizae saccharide extracts on polyamine-dependent activation of K+channels signal pathway during cell migration was observed. (1) K+channel protein Kv1.1 was determined by Western blot. (2)Membrane potential was measured by Flow Cytometer. (3) Laser scanning confocal microscope was used for measuring [Ca2+]cyt. (4) The expression of RhoA, which is Ca2+downstream protein, was determined by Western blot. ResultsDuring cell migration, Codonopsis and Glycyrrhizae saccharide extracts could: (1) improve the expression of Kv1.1 protein and ameliorate the decrease of kv1.1 protein expression by DFMO; (2) increase membrane hyperpolarization and reverse membrane depolarization resulted by DFMO; (3) improve intracellular [Ca2+]cyt, while Codonopsis could reverse the decrease of [Ca2+]cyt caused by DFMO; (4) improve the expression of RhoA protein, reversing its decline caused by DFMO. ConclusionCodonopsis and Glycyrrhizae saccharide extracts can promote cell migration in IEC-6 cell, which is correlated with their effect on polyamine-dependent activation of K+channels signal pathway.
Key words:Codonopsis; Glycyrrhizae; saccharide extracts; intestinal epithelial cell; migration, mechanism of action
文献标志码:A
文章编号:1001-1978(2016)02-0245-07
doi:10.3969/j.issn.1001-1978.2016.02.019
作者简介:李茹柳(1962-),女,博士,教授,研究方向:益气健脾中药作用机制,通讯作者,Tel:020-36585444;E-mail:lrl@gzucm.edu.cn
基金项目:国家自然科学基金资助项目(No 30772753,81173254);中央财政支持地方高校发展专项资金项目“重大难治性脾胃病防治协同创新平台”[财教(2013)338号];华南中医药协同创新中心—中医药防治脾胃病、脑病创新研究团队项目(No E1-KFD015141K03)
收稿日期:2015-10-20,修回日期:2015-11-09
网络出版时间:http://www.cnki.net/kcms/detail/34.1086.R.20160125.1557.038.html网络出版地址:2016-1-25 15:57
