濒危植物光叶蕨孢子离体培养与萌发研究
2016-03-23余凌帆文智猷杨洪忠赵昌平
蔡 煜,余凌帆,文智猷,龚 伟*,杨洪忠,赵昌平
(1.四川农业大学林学院,四川成都 611130;2.四川省林业科学研究院,四川成都 610081;3.天全县林业局,四川天全 625500)
濒危植物光叶蕨孢子离体培养与萌发研究
蔡 煜1,余凌帆2,文智猷2,龚 伟1*,杨洪忠3,赵昌平1
(1.四川农业大学林学院,四川成都 611130;2.四川省林业科学研究院,四川成都 610081;3.天全县林业局,四川天全 625500)
近年来由于人类活动的干扰和地质灾害的破坏,使国家Ⅰ级重点野生保护植物光叶蕨(Cystoathyrium chinensis Ching)的生长环境受到了严重影响,导致其数量稀少,濒临灭绝。为了保护和扩繁光叶蕨,运用组织培养快繁技术,以光叶蕨成熟孢子为外植体,研究不同灭菌方式、培养基和蔗糖浓度对光叶蕨孢子萌发的影响。结果表明:不同灭菌方式、培养基和蔗糖浓度对光叶蕨孢子萌发有明显影响;最佳灭菌处理为孢子经4 000 r·min-1离心制成孢子悬浮液,加入0.1%升汞溶液离心5 min,无菌水冲洗4~5次;最佳萌发培养基为1/2MS+20 g·L-1蔗糖,经过90 d,萌发率可达57.8%。
光叶蕨;孢子;萌发
植物生物多样性是人类社会赖以生存和发展的基础,人类的衣、食、住、行等生活的许多方面都与生物多样性密切相关。由于人类过度利用自然资源和物种资源,加剧也加速了自然生态系统退化和物种的退化,生物多样性受到严重威胁[1],形成的生态问题不但影响了人类的基本生活,而且严重威胁着人类的生存与发展[2],保护植物的生物多样性具有重要意义。2015年,余凌帆等在天全县通过全县普查,发现光叶蕨分布数量为58株,分布于我国四川省天全县二郎山附近[3],仅极少数存于溪沟边的灌丛下[4],属国家Ⅰ级重点野生保护植物、濒危物种,保护与扩繁光叶蕨具有重要性与迫切性。植物组织培养可以应用于快速繁殖优良苗木、获得脱毒苗、种质保存等,具有生产周期短、繁殖系数高、管理方便等特点,可选用植物的各种器官、组织、细胞和原生质体等作为外植体,如根、茎、叶、芽、花药、花粉、孢子等。茎尖不仅生长速度快,繁殖率高,不容易发生变异,是较好的选择。此外因所需材料少,繁殖系数大,利用孢子进行组织培养具有较高的可行性。考虑到光叶蕨稀少的现存数量,采集植株作组培材料将对被采植株造成毁灭性破坏,具有不可操作性;取嫩叶和成熟孢子是最可能的,其中孢子对植株的影响最小,且孢子数量大,更切合实际。目前有关光叶蕨的研究主要集中在其资源、生境及保护对策等方面,而有关光叶蕨孢子无菌繁殖的研究尚未见报道。本文以光叶蕨成熟孢子为外植体,筛选了适合孢子萌发的灭菌方式和最佳培养基,探索其组织培养过程中的关键技术,为光叶蕨种质资源保护和人工繁育体系构建提供参考。
1 材料与方法
1.1 孢子的采集
光叶蕨(Cystoathyrium chinensis Ching)孢子采自四川省天全县二郎山。从带有成熟孢子的叶片上拨下孢子囊,装入干燥的5 ml离心管,用棉花封口,放置于28℃~30℃的人工气候箱中培养。每天轻微摇动离心管2次,待孢子粉散出,便可进行孢子消毒。
1.2 孢子的消毒
在离心管中加少许蒸馏水浸泡1 h后4 000 r· min-1离心5 min,去除清液。用以下6种方式消毒:(1)加3%NaClO溶液4 000 r·min-1离心3 min后去除清液;(2)加3%NaClO溶液4 000 r·min-1离心5 min后去除清液;(3)加3%NaClO溶液4 000 r ·min-1离心7min后去除清液;(4)加0.1%升汞溶液4000 r·min-1离心3 min后去除清液;(5)加0. 1%升汞溶液4 000 r·min-1离心5 min后去除清液;(6)加0.1%升汞溶液4 000 r·min-1离心7 min后去除清液。以上方式灭菌后,均使用无菌水冲洗4~5次,每次4 000 r·min-1离心5 min后去除清液。最后加无菌水稀释,充分振荡得到无菌孢子悬浊液[5,6]。
6种灭菌处理,每处理3次重复,每个重复接种90瓶。每瓶接种1滴(约0.1 ml)。播种90 d后统计孢子污染率和萌发率。
1.3 孢子的萌发培养
基本培养基包括MS、1/2MS和1/4MS共3种,蔗糖浓度水平包括10 g·L-1、20 g·L-1和30 g· L-1共3个水平,采用两因素3水平试验设计共9个处理,每个处理3次重复,每个重复接种60瓶,每瓶接种1滴(约0.1 ml),播种90 d后统计萌发率。
1.4 培养条件
培养基琼脂浓度均为7 g·L-1,pH 5.8。培养基经121℃高温、高压灭菌20 min左右。培养箱温度为(22~25)℃,光照强度为2 000 lx~2 300 lx,光照时间12 h·d-1。
2 结果与分析
2.1 不同灭菌处理对污染率和萌发率的影响
接种2 d~3 d后各处理污染试管数逐渐增加,一周左右污染试管数开始稳定,60 d后孢子开始逐渐萌发,90 d后统计污染率和萌发率,统计结果见表1。由表1可以看出,在相同灭菌剂条件下,污染率和萌发率均随灭菌时间的延长而降低;在相同处理时间条件下,3%NaClO的污染率(平均为33.5%)均高于0.1%HgCl2的(平均为28.0%),相反,3%NaClO的(平均为40.9%)萌发率均低于0.1%HgCl2的(平均为47.3%)。污染率处理1最高为44.1%,处理6最低为15.6%,其它各处理呈现出处理4(40.4%)>处理2(34.1%)>处理5(28.1%)>处理3(22.2%)的变化规律。萌发率处理5最高为51.1%,处理3最低为34.8%,其它各处理呈现出处理2(46.7%)=处理4(46.7%)>处理6(44.1%)>处理1(41.1%)的变化规律。以上结果表明,与3%NaClO相比,0.1%HgCl2处理的污染率相对较低,而萌发率相对较高。综合污染率和萌发率两个指标,采用处理5(即0.1%升汞溶液4 000 r·min-1离心5 min)的效果最好,能获得较低的污染率和较高的萌发率(表1)。
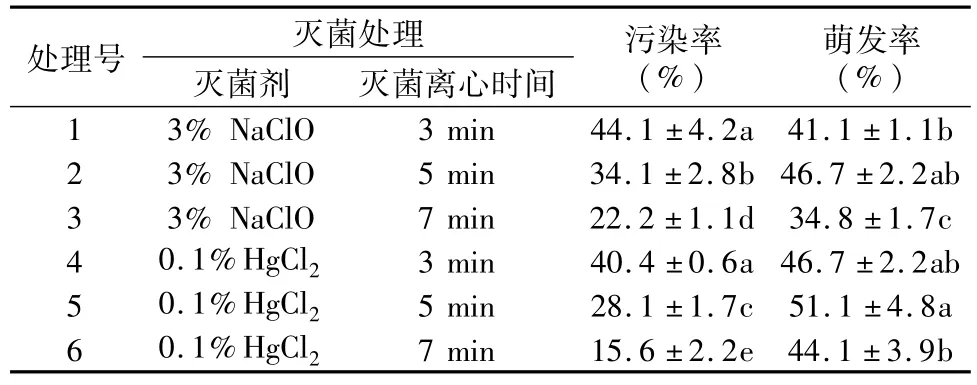
表1 不同灭菌处理对孢子萌发的影响
2.2 不同培养基对孢子萌发的影响
由表2可知,接种90 d后,不同培养基对光叶蕨孢子萌发的影响比较明显,萌发率随着培养基中无机盐浓度的降低呈现先升后降的趋势。全量MS培养基中,孢子萌发率为43.7%,原叶体长势一般;1/2MS最适宜孢子萌发,萌发率为52.4%,高于同一蔗糖浓度的其他水平,原叶体色泽鲜绿,质地较厚;1/4MS培养基对孢子萌发有一定的影响,萌发率最低为36.1%,原叶体长势较MS中的差,且质地偏薄。不同蔗糖浓度的培养基对光叶蕨孢子萌发的影响比较明显,萌发率随着浓度的升高呈现先升后降的趋势。萌发率最高的蔗糖浓度为20 g·L-1,原叶体生长较快,个头大,色泽亮丽。蔗糖浓度为30 g· L-1的萌发率比10 g·L-1的萌发率低,且原叶体色泽较10 g·L-1枯黄。同一蔗糖浓度下,萌发率1/2MS>MS>1/4MS。同一无机盐浓度水平,不同蔗糖浓度条件下孢子萌发率20 g·L-1(48.1%)>10 g·L-1(43.7%)>30 g·L-1(40.4%)。因此萌发率高且原叶体长势佳的培养基为1/2MS+20 g· L-1蔗糖,萌发率最高为57.8%。
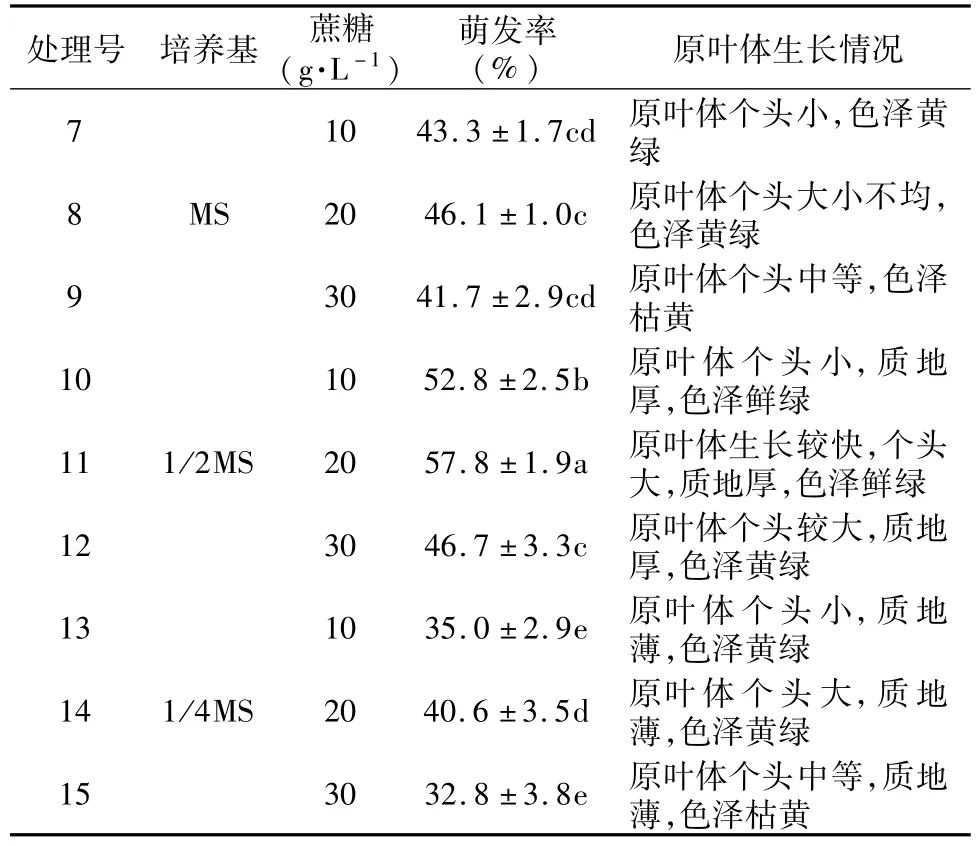
表2 不同培养基和蔗糖浓度对孢子萌发的影响
3 讨论
本实验得出,最佳灭菌处理为0.1%升汞离心5 min,可获得较高的孢子萌发率,这与王洋[7]在对扇叶铁线蕨(Adiantum flabellulatum)孢子离体培养时发现升汞处理4 min的孢子萌发率远高于升汞处理8 min的孢子萌发率的结果相似。升汞处理时间导致孢子萌发率高的原因与升汞灭菌效果好有关,减少了因污染导致的孢子萌发率降低问题[8]。本实验升汞灭菌处理的效果比次氯酸钠的效果好,升汞具有较强的消毒灭菌能力,这与吴菲菲[9]的研究结果一致,但与吴长辉[10]对里白(Diplopterygium glaucum(Thunb.ex Houtt)Nakai)孢子灭菌的研究结果相反。出现差异的原因可能与不同蕨类所处环境菌类不同及孢子对特定浓度的灭菌剂的耐受能力不同有关。
蔗糖和无机盐在组织培养中既可调节渗透压又可作为营养物质,一般在孢子萌发前期以调节渗透压为主,因而低浓度的无机盐和蔗糖浓度,有利于孢子从外界吸收水分而萌发[11]。本研究发现,孢子萌发与无机盐浓度有关,1/2MS培养基接种的孢子萌发率最高。无机盐浓度适中的培养基有利于孢子的萌发,无机盐浓度过低或过高均会影响孢子的萌发率。关于无机盐浓度对蕨类植物孢子萌发的研究,付伟等[12]的研究结果发现,河北峨眉蕨(Lunathyrium vegetius(Kitag.)Ching)孢子萌发的最佳培养基为1/2MS,其次为MS,最差为1/4MS;吴长辉[10]的研究发现,里白孢子的萌发率1/2MS(83.2%)显著高于MS(66.4%)与1/4MS(66.7%);江金兰[13]研究结果发现,铁线蕨(Adiantum capillus-veneris L.)孢子在培养基1/2MS的萌发率较MS的高。相反,王蕾等[14]的研究结果表明,MS全培养基对东北对开蕨(Phyllitis japonica Kom.)孢子萌发效果优于1/2MS;孙锐等[15]的研究结果发现,粗梗水蕨(Ceratopteris pteridoides(Hook.)Hieron.)孢子接种在MS完全培养基中孢子萌发率最高,可达60.5%,显著高于1/2MS(43.8%)和1/5MS(43.2%)。本研究结果与付伟等[13]、吴长辉[10]和江金兰[14]等结果相似,而与王蕾等[14]和孙锐等[15]的研究结果相反。出现结果差异的原因,可能与植物不同有关,从而导致特定植物孢子萌发所需无机盐浓度有高有低有所不同。
本研究结果发现,蔗糖浓度的变化对光叶蕨孢子萌发的影响也较大。2%蔗糖浓度较适合于光叶蕨孢子的萌发,在同一无机盐浓度水平条件下孢子萌发率呈现出20 g·L-1>10 g·L-1>30 g·L-1的变化规律,即蔗糖浓度在1%~3%范围内,随着蔗糖浓度的增加孢子萌发率呈先增后减的趋势,30 g ·L-1最小。关于蔗糖浓度对蕨类植物孢子萌发的研究,刘公梅[16]对团叶鳞始蕨(Lindsaea orbiculata(Lam.))孢子萌发的研究结果表明,培养基中不添加或添加低浓度(低于2%)的蔗糖利于团叶鳞始蕨孢子萌发,当蔗糖浓度高于3%时,团叶鳞始蕨孢子的萌发率下降;吴芹[17]对黑足鳞毛蕨(Dryopteris fuscipes C.Chr.)孢子无菌萌发的研究发现,以2%的蔗糖浓度最佳,孢子萌发较早,且原叶体长势最好;相反,吴长辉[10]的研究结果发现,较高蔗糖浓度能促进萌发,在0~40 g·L-1范围内最适合里白孢子萌发的蔗糖浓度为30 g·L-1,诱导率可达91.48%。本研究结果与刘公梅[16]和吴芹[17]等结果相似,而与吴长辉[10]的研究结果相反。出现以上不同结果差异的原因在于,一般而言随着浓度的增加,蔗糖对孢子萌发的抑制作用加重[18],但由于孢子种类不同,萌发时需要的营养物质与渗透压不同,有些植物孢子萌发需要较高浓度的蔗糖与无机盐[19]。在本研究中,孢子萌发只设置了3个无机盐浓度水平和3个蔗糖浓度水平,其他的培养基及蔗糖浓度水平的培养效果有待进一步研究,生长素与细胞分裂素对孢子萌发的影响程度及原叶体增殖和生根诱导等有待于进一步研究,以完善光叶蕨组培快繁技术体系。
4 结论
灭菌处理对光叶蕨孢子污染率和萌发率有显著的影响,孢子灭菌和萌发的最佳灭菌方式是0.1%升汞溶液4 000 r·min-1离心5 min后去除清液,无菌水冲洗4~5次,其次是3%NaClO溶液4 000 r· min-1离心5 min后去除清液,无菌水冲洗4~5次。不同无机盐浓度培养基的孢子萌发率的大小为:1/2MS>MS>1/4MS;不同蔗糖浓度培养基的孢子萌发率的大小为:20 g·L-1>10 g·L-1>30 g·L-1。孢子萌发的最佳培养基为1/2MS+20 g·L-1蔗糖,萌发率可达57.8%,该培养基培养的原叶体生长较快,个头大,质地厚,色泽鲜绿。
[1] 蒋高明,李勇.保护生物多样性就是保护我们自己[J].自然杂志,2010,32(5):267~271,298.
[2] 魏强,佟连军,杨丽花,等.三江平原湿地生态系统生物多样性保护价值[J].生态学报,2015,35(4):935~943.
[3] 余凌帆,高健,何让,等.天全县光叶蕨资源现状调查与保护对策研讨[J].四川林业科技,2015,36(3):120~124,17.
[4] 余凌帆,何让,杨梅,等.天全县光叶蕨人工种群适宜生境地选择[J].四川林业科技,2015,36(6):18~22.
[5] 刘公梅.团叶鳞始蕨繁殖技术研究[D].北京:中国农业科学院,2009.
[6] 张开梅,石雷,李东,等.西南凤尾蕨(Pteris wallichiana Agardh.)发育过程及其孢子的无菌繁殖[J].园艺学报,2008,35(1):94~98.
[7] 王洋.扇叶铁线蕨孢子离体培养及其快繁体系的建立[D].湖北:华中农业大学,2008.
[8] 尤丽莉,杨逢春,邹积鑫.鱼尾星蕨组织培养与快速繁殖的研究[J].广东农业科学,2013(18):28~29,68.
[9] 吴菲菲.麻阳河国家级自然保护区蕨类植物研究[D].贵州:贵州大学,2015.
[10] 吴长辉.里白孢子体快繁关键技术研究[D].浙江:浙江农林大学,2012.
[11] 吴华,袁丽萍,王洋,等.扇叶铁线蕨孢子无菌繁殖技术研究[J].园艺学报,2010,37(3):457~464.
[12] 付伟,叶嘉,焦云红,等.河北峨眉蕨孢子组织培养与繁殖技术研究[J].北方园艺,2010(10):178~180.
[13] 江金兰.铁线蕨的组织培养与快速繁殖[J].江苏农业科学,2012,40(7):61~62.
[14] 王蕾,顾德峰,王海峰.东北对开蕨两种繁殖技术的研究[J].中国园艺文摘,2009,25(6):16~19.
[15] 孙锐,邓子厚,刘胜祥,等.粗梗水蕨孢子无菌繁殖的研究[J].华中师范大学学报(自然科学版),2008,42(4):620~623.
[16] 刘公梅.团叶鳞始蕨繁殖技术研究[D].北京:中国农业科学院,2009.
[17] 吴芹.几种观赏蕨类植物的繁殖技术研究[D].南京:南京林业大学,2007.
[18] 王晓倩,张婷婷,孟卓,等.阔鳞鳞毛蕨孢子的无菌繁殖[J].植物生理学报,2014,50(2):159~163.
[19] 张婷婷,王晓倩,高凤,等.球子蕨孢子的无菌繁殖[J].植物生理学报,2012,48(11):1079~1083.
A Study of the M ethod of Spore Vitro Culture of Cystoathyrium chinensis Spores
CAIYu1YU Ling-fan2WEN Zhi-you2GONGWei1*YANG Hong-zhong3ZHAO Chang-ping1
(1.College of Forestry,Sichuan Agricultural University,Chengdu 611134;2.Sichuan Academy of Forestry,Chengdu 610066;3.Forestry Bureau of Tianquan,Tianquan 205500)
In recent years,the growth environment of Cystoathyrium chinensis Ching has been seriously affected because of the destruction of human interference and geological disaster activities.The species is on the verge of extinction.For the protection and propagation of it,tissue culture propagation techniqueswere used to turnmature spores as explants.Researcheswere conducted on influences of different sterilization,themedium and sucrose concentration on spore germination.The results showed that the best sterilization was spores through 4 000 r·min-1centrifugal prepared spore suspension,0.1%mercuric chloride solution was centrifuged for 5 min,rinsed with sterilewater for 4~5 times;the best germinationmedium was 1/2MS+20 g·L-1sucrose.After 90 d,the germination rate could reach 57.8%.
Cystoathyrium chinensis Ching,Spore,Germination
S723
A
1003-5508(2016)06-00-0
10.16779/j.cnki.1003-5508.2016.06.016
2016-08-08
天全县光叶蕨极小种群拯救保护生境营造及技术培训部分项目(天政采招[2014]27号)。
蔡煜(1993-),硕士生,四川温江人,从事森林培育及生物技术方面研究。E-mail:627200302@qq.com。通讯作者:余凌帆(1977-),男,四川渠县人,副研究员,现从事小种群研究与保护方面工作。
