高压氧与神经生长因子联合应用对HIBD新生大鼠学习记忆能力和感觉运动功能的影响
2016-03-23魏丽夏任青王金慎赵丽丽张勇军聊城市人民医院山东聊城252000
魏丽夏,任青,王金慎,赵丽丽,张勇军(聊城市人民医院,山东聊城 252000)
高压氧与神经生长因子联合应用对HIBD新生大鼠学习记忆能力和感觉运动功能的影响
魏丽夏,任青,王金慎,赵丽丽,张勇军(聊城市人民医院,山东聊城 252000)
摘要:目的观察高压氧(HBO)与神经生长因子(NGF)联合应用对缺氧缺血性脑损伤(HIBD)新生大鼠学习记忆能力和感觉运动功能的影响。方法 40只SD大鼠随机分为5组各8只,A、B、C、D组大鼠均制备HIBD模型,制模后A组采用HBO联合NGF治疗,B组采用HBO治疗,C组采用NGF治疗,D组不干预;E组大鼠右侧颈总动脉只分离而不结扎,术后不给予缺氧,不干预治疗。各组大鼠生后30 d进行Morris水迷宫测试,比较两组连续5 d逃避潜伏期及穿环指数;生后42 d进行感觉运动功能测试,比较两组足错误次数左右差值、肢体放置左右差值。结果与E组比较,A组和C组第1、3、4、5天逃避潜伏期长,B组第1、5天逃避潜伏期长,D组第1~5天逃避潜伏期长;与D组比较,A、B、C、E组穿环次数多;与E组比较,A、B、C、D组肢体放置左右差值大;与D组比较,A、B、C、E组足错误次数左右差值小,肢体放置左右差值小;P均<0.05。结论 HBO与NGF联合应用可改善HIBD新生大鼠学习记忆力和感觉运动功能。
关键词:高压氧;神经生长因子;缺氧缺血性脑损伤;学习记忆能力;感觉运动功能
新生儿缺氧缺血性脑损伤(HIBD)远期可引起智力障碍、癫痫、运动缺陷和认知、学习障碍,而新生儿缺氧缺血性脑病(HIE)是指由于围生期缺氧窒息所导致的HIB,是新生儿期死亡和致残的主要原因。高压氧(HBO)疗法是指机体处于高气压环境中,呼吸与环境等压的高压纯氧或高压混合氧,从而达到治疗疾病的目的。神经生长因子(NGF)是一种神经营养因子,不仅对正常神经细胞有营养保护作用,还能促进损伤神经元再生和功能恢复,改善神经元的病理状态。本研究观察了HBO与NGF联合应用对HIBD新生大鼠学习记忆能力和感觉运动功能的影响,旨在为两者的临床应用提供理论依据。
1材料与方法
1.1实验动物、主要仪器及试剂健康7日龄SD大鼠40只,体质量(14.5±3.2)g,雌雄不限。RSS-5100便携式数字测氧仪(上海隆拓仪器设备有限公司),YLC0.5/1A婴儿高压氧舱(中国船舶工业总公司第701研究所),Morris水迷宫(MT-200,成都泰盟科技有限公司),Recombinant Rat β-NGF(R&D公司),氮氧混合气(贵阳申建气体有限公司)。
1.2实验动物分组、HIBD模型制备及HBO、NGF干预40只SD大鼠随机分为5组各8只。A、B、C、D组大鼠均制备HIBD模型[1],即首先将大鼠以仰卧位固定于手术板上,颈部常规消毒,正中切口,长约0.3 cm,血管钳轻柔分离右侧颈总动脉,用0号无菌线双线结扎,无菌手术刀剪断下中,然后用无菌一次性缝线缝合切口。缺血术后将大鼠置于8%低氧环境(自制的新生大鼠缺氧装置),将8%O2+92%N2以1~2 L/min的速度输入缺氧装置,2 h后大鼠从缺氧装置中取出,缺血缺氧后返回母鼠身边继续哺乳喂养。A组大鼠脑缺氧缺血术后30 min内先腹腔注射0.5 μg的NGF,连续3 d;后采用HBO治疗,1次/d,共7 d。B组大鼠脑缺氧缺血术后15~30 min采用HBO治疗,1次/d,共7 d。C组大鼠脑缺氧缺血术后30 min内腹腔注射0.5 μg的NGF,连续3 d。D组脑缺氧缺血后,正常饲养,不干预。E组大鼠右侧颈总动脉只分离而不结扎,术后不给予缺氧,不干预治疗。
1.3大鼠学习记忆能力测试各组大鼠于出生后第30天进行Morris水迷宫实验,包括定位航行实验和空间搜索实验。①定位航行实验:主要通过测试逃避潜伏期(大鼠寻找并爬上平台的路线图和所需时间)来判断大鼠水迷宫学习和记忆能力。实验开始前1 d先将大鼠放入水池中(不放平台)自由游泳2 min,使其熟悉迷宫环境。正式实验共进行5 d,每天分上午和下午两个时间段,每段时间训练4次,分别从4个不同的入水点入水。实验记录其大鼠逃避潜伏期,如果实验大鼠在120 s内未找到平台,则需将其拿上平台,记录逃避潜伏期为120 s,每次训练时间间隔60 s。②空间搜索实验:用于检测大鼠学会寻找平台后,对平台空间位置记忆的保持能力。第6天撤除原平台,将大鼠任选1个入水点放入水中,所有大鼠必须为同一入水点,记录大鼠在2 min内跨越原平台的次数,称为穿环指数。
1.4大鼠感觉运动功能测试各组大鼠于出生后第42天进行感觉运动功能测试,包括足错误实验和肢体放置实验。①足错误实验:将大鼠放在水平的金属网格上(50 cm×40 cm,每格3 cm×3 cm,金属丝直径0.4 cm),记录2 min内大鼠前、后爪掉下来的次数。因不同大鼠活动度有个体差异,只记录左右侧错误次数的差值。②肢体放置实验:记录大鼠在不同的感觉刺激下左右侧前后爪的放置情况,计分标准:爪子放置正确、迅速计0分,迟缓或不完全正确计1分,未放置计2分,记录每只大鼠两侧得分的差值。
2结果
2.1各组逃避潜伏期、穿环指数比较连续5 d逃避潜伏期、穿环指数比较见表1。
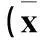
表1 各组连续5 d逃避潜伏期、穿环指数比较±s)
注:与E组比较,*P<0.05,△P<0.01;与D组比较,﹟P<0.01。2.2各组足错误次数左右差值、肢体放置左右差值比较足错误次数左右差值、肢体放置左右差值比较见表2。
3讨论
新生儿HIBD是由于围产期窒息而导致的缺氧缺血性脑损害,目前治疗以对症支持治疗为主,但迄今仍无有效治疗措施来减轻HIBD后遗症[2]。中重度HIBD患儿有很高的病死率,存活者可能遗留严重神经系统后遗症,如脑瘫、认知障碍、学习障碍、癫痫等[3~6]。
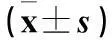
表2 各组足错误次数左右差值、肢体放置左右差值比较
注:与E组比较,*P<0.05,△P<0.01;与D组比较,﹟P<0.01。
HBO疗法是指机体处于高气压环境中,呼吸与环境等压的高压纯氧或高压混合氧,从而达到治疗疾病的目的。研究[7,8]认为,HBO对HIBD脑组织有保护。然而,HBO在脑损伤中的应用及应用效果一直存在争议。有研究[9]证明,新生大鼠HIBD缺氧缺血后6 h内进行HBO治疗为最佳时间窗,缺氧缺血后12 h进行HBO治疗反而会加重病情[10]。刘丽旭等[11]利用新生大鼠制备HIBD模型,发现选择2ATA压力、稳压时间为30~60 min的HBO治疗大鼠脑损伤效果最佳,过高的HBO压力反而加重脑组织损伤。
NGF是发现最早的一种神经营养因子,是由118个氨基酸组成的蛋白质。NGF不仅对正常神经细胞有营养保护作用,还能促进损伤神经元再生和功能恢复,改善神经元的病理状态[12],保护和修复缺氧缺血后受损神经[13]。在胚胎时期,NGF分布广、含量多,为效应神经元生存所必须。出生后,NGF分布区域逐渐减少、含量下降。NGF在神经损伤后可应激性上调表达,但这种表达时间短、NGF含量较低,不足以全面而持久保护受损神经[14]。因此,外源性NGF的供给是十分必要的。国内外研究证明,在新生动物发生HIBD时,NGF是可以通过血脑屏障的,此为外源性NGF治疗新生儿HIBD提供了可能理论。
学习记忆是大脑最重要的高级神经活动之一,是中枢神经功能的整合,学习和记忆是两个不同又相关联的神经生物过程。水迷宫行为测定实验是判定动物空间学习记忆的传统经典方法。30日龄大鼠的脑发育水平与人类幼儿期脑发育水平相当,是智能发育的关键期,故选用此时间点研究学习记忆能力。感觉运动功能结果受个体差异因素影响,本实验采用足错误和肢体放置实验两项测试提高研究的准确性。本研究显示,A组和C组第1天、第3天、第4天、第5天逃避潜伏期较E组长,B组第1天、第5天逃避潜伏期较E组长,D组第1~5天逃避潜伏期较E组长;A、B、C、E组穿环次数较D组多;A、B、C、D组肢体放置左右差值较E组大;A、B、C、E组足错误次数左右差值较D组小,肢体放置左右差值较D组小。提示HBO与NGF联合应用能够改善HIBD新生大鼠学习记忆能力和感觉运动功能。
参考文献:
[1] 陈惠金,周建德,周泽汉,等.新生大鼠脑缺氧缺血损伤模型的制备[J].上海实验动物科学,1999,19(3):159-160.
[2] Pietrini D, Piastra M, Luca E, et al. Neuroprotection and hypothermia in infants and children[J]. Curr Drug Targets, 2012,13(7):925-935.
[3] Gulczyńska E, Gadzinowski J. Therapeutic hypothermia for neonatal hypoxic-ischemic encephalopathy[J]. Ginekol Pol, 2012,83(3):214-218.
[4] Tagin MA, Woolcott CG, Vincer MJ, et al. Hypothermia for neonatal hypoxic ischemic encephalopathy: an updated systematic review and meta-analysis[J]. Arch Pediatr Adolesc Med, 2012,166(6):558-566.
[5] Sant′Anna G, Laptook AR, Shankaran S, et al. Phenobarbital and temperature profile during hypothermia for hypoxic-ischemic encephalopathy[J]. J Child Neurol, 2012,27(4):451-457.
[6] Martinez-Biarge M, Diez-Sebastian J, Kapellou O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy[J]. Neurology, 2011,76(24):2055-2061.
[7] Lyu J, Costantini F, Jho EH, et al. Ectopic expression of Axin blocks neuronal differentiation of embryonic carcinoma P19 cells [J]. J Biol Chem, 2003,278(15):13487-13495.
[8] Calvert JW, Yin W, Patel M, et al. Hyperbaric oxygenation prevented brain injury induced by hypoxia-ischemia in a neonatal rat model[J]. Brain Res, 2002,951(1):1-8.
[9] 刘小红,赵永利,马巧梅,等.高压氧干预新生大鼠缺氧缺血性脑损伤的时间窗研究[J].中华儿科杂志,2006,44(3):177-181.
[10] Lou M, Eschenfelder CC, Herdegen T, et al. Therapeutic window for use of hyperbaric oxygenation in focal transient ischemia in rats[J]. Stroke, 2004,35(2):578-583.
[11] 刘丽旭,杨于嘉.高压氧治疗新生大鼠缺氧缺血性脑损伤量效及时效关系[J].中国当代儿科杂志,2001,3(4):355-358.
[12] Tang XQ, Cai J, Nelson KD, et al. Functional repair after dorsal root rhizotomy using nerve conduits and neurotrophic molecules[J]. Eur J Neurosci, 2004,20(5):1211-1218.
[13] Tuszynski MH, U HS, Alksne J, et al. Growth factor gene therapy for Alzheimer disease[J]. Neurosurg Focus, 2002,13(5):e5.
[14] Lobos E, Gebhardt C, Kluge A, et al. Expression of nerve growth factor(NGF) isoforms in the rat uterus during pregnancy: accumulation of precursor proNGF[J]. Endocrinology, 2005,146(4):1922-1929.
(收稿日期:2015-09-07)
中图分类号:R722.1
文献标志码:A
文章编号:1002-266X(2016)03-0025-03
doi:10.3969/j.issn.1002-266X.2016.03.009
