熄风汤对帕金森病模型小鼠多巴胺能神经元的影响
2016-03-23朱会杰曹林唐波郭凯
朱会杰,曹林,唐波,郭凯
(1.南京农业大学 食品科技学院,江苏 南京 210095; 2.南京诺唯赞生物科技有限公司,江苏 南京 210000;
3.中国中医科学院 望京医院,北京 100102)
熄风汤对帕金森病模型小鼠多巴胺能神经元的影响
朱会杰1,曹林1,唐波2,郭凯3
(1.南京农业大学 食品科技学院,江苏 南京210095; 2.南京诺唯赞生物科技有限公司,江苏 南京210000;
3.中国中医科学院 望京医院,北京100102)
[摘要]目的:观察10ml·kg-1的给予剂量、限时2周的熄风汤灌胃对帕金森病模型小鼠多巴胺能神经元的影响。方法:30只小鼠随机分为3组,分别为正常对照组、模型组、熄风汤治疗组,每组10只。前两组小鼠进行10 ml·kg-1生理盐水灌胃,熄风汤治疗组同时间等剂量进行熄风汤复方灌胃,连续2周后模型组和熄风汤治疗组小鼠腹腔注射30mg·kg-11- 甲基- 4- 苯基- 1,2,3,6- 四氢吡啶(1- methy- 4- phenyl- 1,2,3,6- tetrahy- dropyridine, MPTP),1次·d-1,连续7d,对照组予同等体积的生理盐水注射。3d后进行行为学检测,免疫印迹和免疫组化检测酪氨酸羟化酶蛋白水平及其阳性神经元数目。结果:行为学检测结果显示,熄风汤治疗组小鼠悬尾和强迫游泳静止率较模型组明显降低(P<0.05),酪氨酸轻化酶蛋白水平及其阳性神经元细胞数显著增加(P<0.05)。结论:在上述条件下,熄风汤有助于改善MPTP致帕金森病模型小鼠的症状,对小鼠脑内多巴胺能神经元具有一定的保护的作用。
[关键词]熄风汤; 1- 甲基- 4- 苯基- 1,2,3,6- 四氢吡啶; 酪氨酸羟化酶; 多巴胺能神经元; 帕金森病; 小鼠
帕金森病(Parkinson’s disease, PD)是人类常见的神经退行性疾病之一,以静止性震颤、肌强直、运动障碍为突出症状。一项涉及全球20多个国家PD患者流行性病学的研究数据分析表明,我国发病率为1.9/10万,欧美国家为9.4/10万[1]。随着社会进入老龄化阶段,PD的发病率无疑逐步增加。尽管人类认识PD已经200多年了,但至今PD的发病机制仍是谜团,研究表明,多个因素参与了PD的发病机制,包括环境因素、线粒体功能障碍与氧化应激、自噬、神经炎症反应等[2]。PD的发病基础为黑质致密部(substantia nigra compacta, SNC)内的多巴胺能(dopaminergic, DA)神经元丢失,残存神经元出现α- 突触核蛋白(α- synuclein,α- SYN)和路易小体(Lewy Bodys, LBs),DA释放减少[3]。α- SYN的调控作用主要表现在通过作用于酪氨酸羟化酶(tyrosine hydroxylase, TH)调节多巴胺合成[4]。DA神经元通过摄取血液中的酪氨酸,经胞质内TH催化形成多巴,多巴由多巴脱氢酶催化生成多巴胺,因此TH的活性和表达的变化会直接影响多巴胺的生物合成,其数量的多寡直接反映DA神经元凋亡的严重程度。多年来,对PD的治疗主要基于药物治疗和外科手术治疗[5],如左旋多巴胺、抗胆碱药、单胺氧化酶抑制剂、神经保护剂、脑深部刺激等,但无论哪种药物都只能减轻临床症状而不能阻止疾病的发展,长期使用还会出现不良反应[6]。
熄风汤是一种治疗PD疗效较为理想的经验处方,由柴胡、怀牛膝、白芍、钩藤、党参、山药、知母、桔梗、生甘草组成,临床观察到该方剂能够有效改善PD患者患侧肢体的静止性震颤、肢体痉挛疼痛、睡眠障碍等症状,并延缓或有效逆转PD的疾病进程。本研究以1- 甲基- 4- 苯基- 1,2,3,6- 四氢吡啶(1- methy- 4- phenyl- 1,2,3,6- tetrahy- dropyridine, MPTP)构建PD模型小鼠为平台,观察熄风汤治疗2周后其行为学特征、黑质DA神经元的变化,为进一步探讨熄风汤防治PD打下基础。
1材料与方法
1.1动物及试剂
8周龄雄性SPF级C57BL/6小鼠30只,体重20~25g,购自北京华阜康生物科技有限公司,自由进食饮水,室温20~25℃,湿度45%~65%,光照和黑暗交替各12h的环境下适应性饲养1周。试剂:MPTP (Sigma 公司),TH一抗 (Mlillipore 公司),BCA蛋白定量试剂盒(南京诺唯赞生物科技有限公司),熄风汤复方(中国中医科学院望京医院)。
1.2熄风汤复方制备
取一定比例的柴胡、怀牛膝、白芍、钩藤、党参、山药、知母、桔梗、生甘草,水煎煮,得浸膏,浸膏浓缩到60℃时比重为1.10~1.20,存于4℃冰箱备用,使用时采用蒸馏水溶解,混悬至生药2.0g·ml-1,待灌胃用。
1.3PD模型的制备与分组
实验动物在动物房安静环境下饲养1周后随机分为3组,每组10只,分别为正常对照组、模型组、熄风汤治疗组。前两组小鼠10 ml·kg-1生理盐水灌胃,熄风汤治疗组同时间等剂量熄风汤复方灌胃,连续2周后,模型组和熄风汤治疗组小鼠分别腹腔注射MPTP 30mg·kg-1(生理盐水溶解),1次·d-1,连续7d,正常对照组予同等体积的生理盐水注射,之后进行行为学测定。
1.4行为学检测
模型制备完成第3天进行行为学检测。悬尾实验:基于Steru等[7]建立的方法,用医用胶带绑住小鼠尾末端部,使其头部向下悬挂于水平横杆上,其表现为不动状态反映其行为绝望,利用安徽正华公司的悬尾实验视频分析系统记录6min内2~6min静止不动时间占总时间的比率,比率越高,绝望程度越强。强迫游泳实验与悬尾类似:将小鼠放入一个直径25cm、高度40cm、水深20cm、水温25℃的透明树脂玻璃水缸内,利用安徽正华公司的强迫游泳实验视频分析系统记录6min内2~6min漂浮不动的时间占总时间的比率,比率越高,体能越差,反映其绝望程度越高。
1.5Western Blotting检测
小鼠进行快速断头取脑,取小鼠中脑黑质部位,匀浆,提取总蛋白,BCA蛋白定量,取一半样品加入上样缓冲液水浴煮沸5min备用。取20μg蛋白样品进行12% SDS- PAGE凝胶电泳后,转膜仪转至硝酸纤维素(PVDF)膜,5%脱脂奶粉封闭液封闭1h,加入小鼠抗 TH 单克隆抗体(1∶1000)(β- Actin为内参),4℃过夜,经PBST漂洗后与辣根过氧化物酶标记的二抗结合,ECL显影液化学发光显色,使用光密度分析软件进行目的条带检测及分析。
1.6免疫组化检测
实验小鼠用乙醚麻醉后开胸暴露心脏,剪开右心叶放血,从心尖插入灌注针到左心室,生理盐水灌注直至肝脏发白、体内流出液体为无色,换用4℃ 4%多聚甲醛(paraformaldehyde, PFA)固定至小鼠尾巴弯曲、四肢僵硬,停止灌注。完整取脑,4% PFA后固定1h,15%、20%、30%蔗糖梯度脱水,OCT包埋剂包埋及连续脑组织冠状切片,37℃烘箱烘片,5% BSA加0.5% Triton X- 100 0.01mol·L-1PBS封闭,室温1h,滴加小鼠抗 TH 单克隆抗体(1∶500),4℃过夜,PBS冲洗,加入荧光二抗(1∶500),PBS冲洗,DAPI复染,封片,荧光显微镜观察,每组每只动物取2张黑质部脑片,随机取6个高倍视野,进行黑质TH阳性神经元计数。
2结果
2.1行为学检测结果
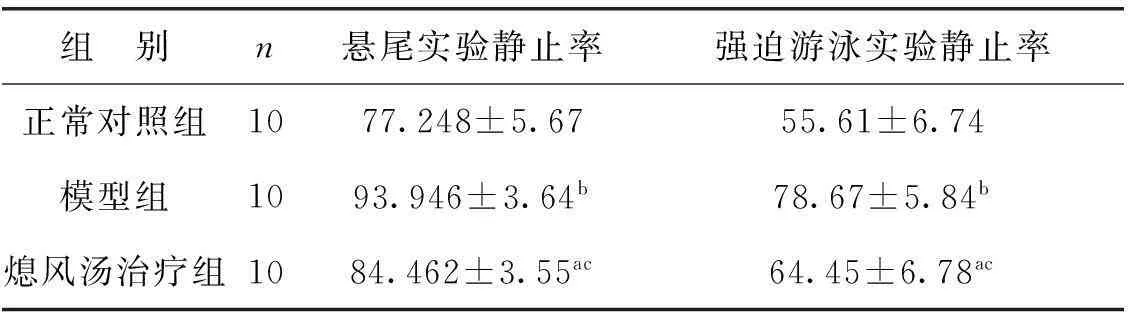
模型组小鼠于第1 次注射 MPTP 后0.5~1 h 均出现不同程度的震颤、竖毛、翘尾等表现;最后1次注射后,小鼠出现动作减少、倦卧、尾僵直、细小震颤等症状。熄风汤治疗组小鼠第1次注射 MPTP 后出现轻微的震颤、竖毛表现;最后1次注射后,小鼠尾僵直的频率、时间较模型组有所改善。悬尾实验和强迫游泳实验是将小鼠置于无逃避的应激状态下,其表现为不动状态反映了其行为绝望,可模拟人类的PD症状,与正常小鼠相比,模型组悬尾、强迫游泳的静止率均显著高于正常对照组(P<0.01),反映了其激惹程度小于正常组,说明造模成功。熄风汤治疗组悬尾、强迫游泳静止率均显著低于模型组(P<0.05)(表1),说明熄风汤治疗在一定程度上改善了PD小鼠的乏力程度。
表1各组行为学评分比较
Tab 1Behavioral scores in each group
%
与正常对照组相比,aP<0.05, bP<0.01;与模型组相比, cP<0.05
2.2Western blotting检测结果
我们利用Western blotting的方法在PD小鼠模型中检测了TH蛋白的表达变化。结果显示,与正常对照组相比,模型组小鼠中脑黑质内TH蛋白水平明显下降,熄风汤治疗后MPTP 诱发的TH蛋白表达水平的下降得到明显抑制(图1A)。再对蛋白表达量进行检测,并对TH蛋白与内参蛋白β- Actin的灰度比值进行统计分析,模型组TH蛋白表达较正常组显著降低(0.389±0.0356vs0.8096±0.0172,P<0.01),熄风汤治疗组TH蛋白水平较模型组显著上升(0.5511±0.0484vs0.389±0.0356,P<0.05),说明熄风汤对PD小鼠黑质TH蛋白具有保护作用(图1B)。

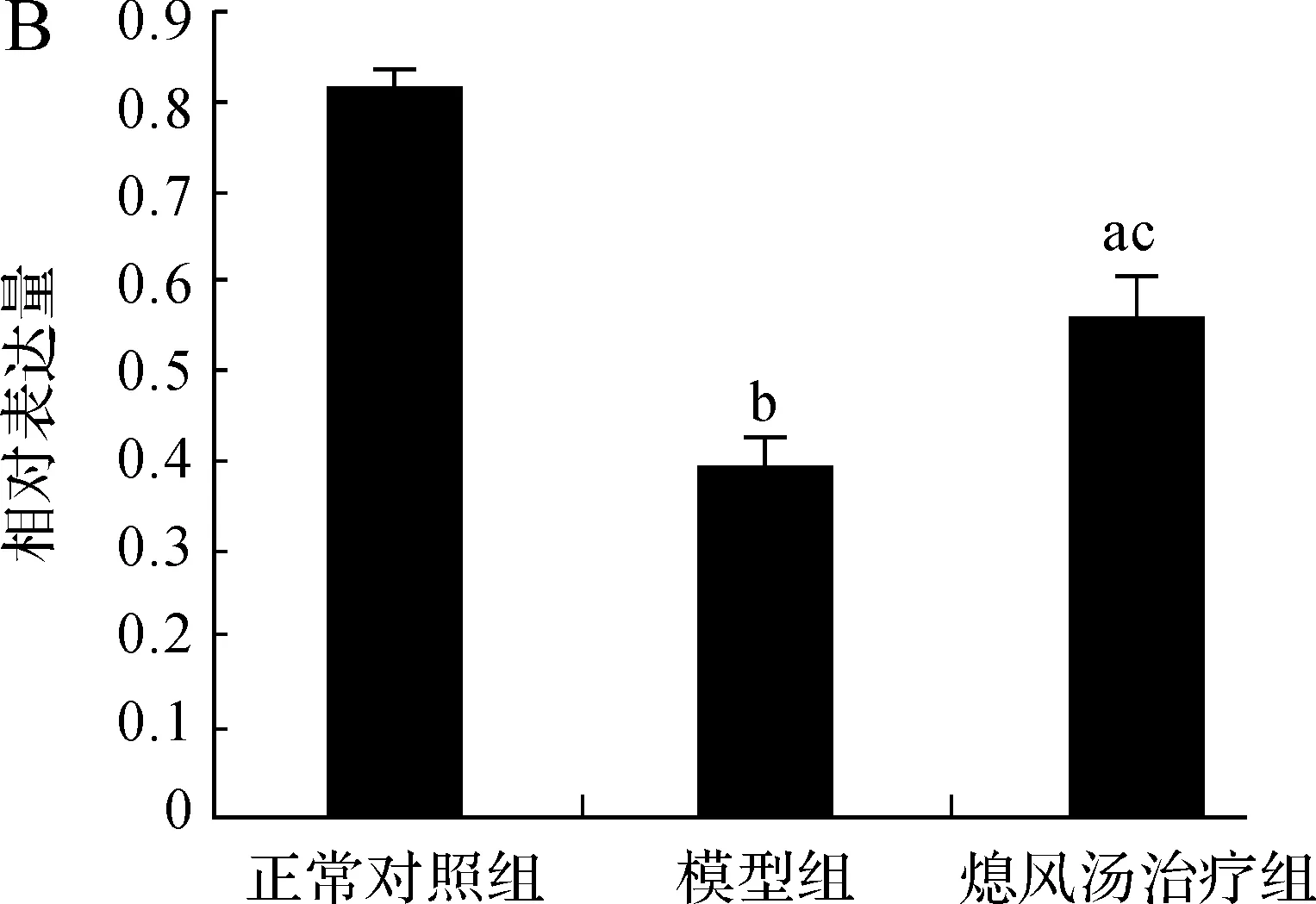
A.Western Blotting检测TH 表达的变化; B.TH的相对灰度值统计分析;与正常对照组相比, aP<0.05, bP<0.01;与模型组相比, cP<0.05
图1不同处理组中小鼠黑质TH的表达变化(n=3)
Fig 1The expression of mice substatia nigra TH in different treatment groups (n=3)
2.3免疫组化检测结果
为了进一步验证熄风汤对MPTP 诱导的黑质DA神经元丢失具有保护作用,我们应用免疫荧光组织化学方法分别检测了不同组小鼠黑质 TH阳性神经元的数目。与正常对照组相比,模型组TH阳性神经元呈带状分布仅存轮廓,阳性纤维、细胞稀疏,排列紊乱,胞体面积变小,胞浆染色变淡,突起细短、稀疏。熄风汤治疗后,TH阳性神经元表达密集,细胞浓密,排列整齐。见图2。
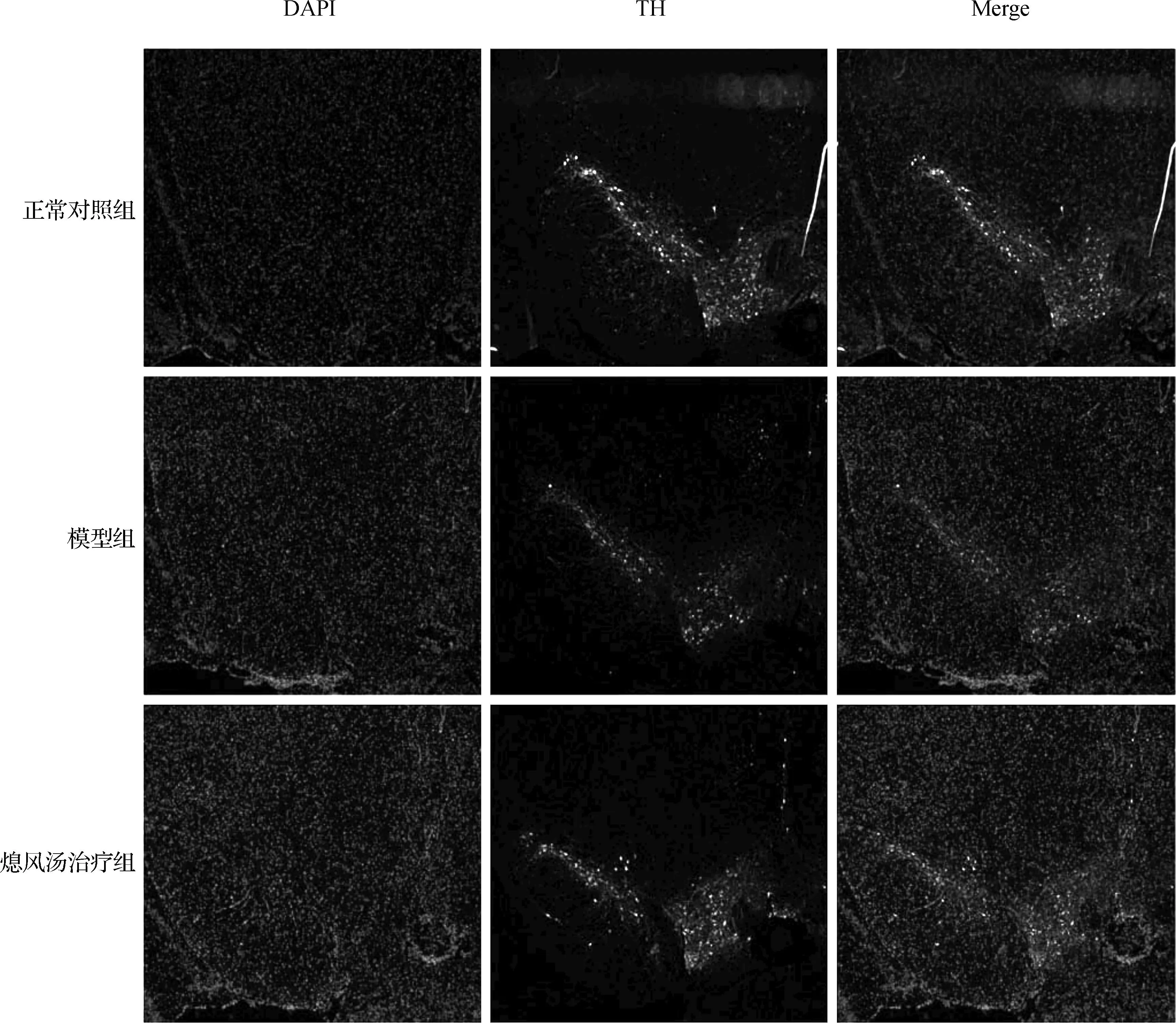
图2不同处理组小鼠TH神经元存活状态(n=6,×50)
Fig 2TH neurons suevival status in different treatment groups(n=6,×50)
进一步在200倍荧光显微镜视野下,神经元排列更清楚地呈现在我们面前,与正常对照组小鼠相比,模型组中小鼠黑质DA神经元显著减少,熄风汤治疗组小鼠黑质的TH 阳性神经元数量明显增加,见图3。经统计分析,模型组与正常对照组相比,TH阳性神经元数目显著下降(66.4±8.5vs33±6.12,P<0.01),熄风汤治疗后TH阳性神经元数目增加了近40%(45.6±5.59vs33±6.12,P<0.05),见图4。
3讨论
PD是一种以中脑黑质DA神经元变性坏死为特征性病理变化的神经系统退行性疾病,其主要病理表现为大脑黑质神经递质多巴胺含量大幅度下降,导致另一神经递质乙酰胆碱相对增加,从而引发一系列的静止性震颤、肌强直、运动减少等症状[8]。DA神经细胞的变性是 PD 发病的中心环节,PD 病因、发病机制复杂,目前尚不完全明确。到目前为止国内外已建立了众多的动物模型来研究PD,其中应用最为广泛的是MPTP小鼠模型[9]。MPTP具有亲脂性,很容易进入脑内,MPTP穿过血脑屏障后被单胺氧化酶B(monoamine oxidase- B, MAO- B)转化为相应的二氢吡啶,随之氧化为1- 甲基- 4- 苯基吡啶(1- methyl- 4- phenylpyridinium, MPP+), MPP+通过DA运转体进入纹状体DA神经元内,可抑制TH的活性从而减少多巴胺的合成[9]。正是基于MPTP选择性作用于SN DA神经元并引起多巴胺大幅度减少这一特性,用MPTP制备PD动物模型可模仿人类PD的临床和病理性特征,从而用于该病的发病机制和治疗方案的研究[11]。由于MPTP在小鼠体内具有级联放大作用,故一般在模型制备完成第3天检测造模是否成功。
PD的典型症状就是运动机能受损和大脑多巴胺水平的下降[12],因此本实验采用熄风汤灌胃干预MPTP致PD小鼠模型,检测行为学及TH含量变化,研究表明,模型组小鼠行为学明显减少,TH蛋白及阳性神经元显著降低,证实了小鼠 PD 模型行为学变化与TH神经元前后形态学改变、表达含量的变化密切相关,具有一致性[13]。本研究证实:(1) 行为学结果提示熄风汤治疗组小鼠的行为学症状较模型组有显著改善;(2) 免疫印迹和免疫组化结果提示熄风汤治疗组小鼠黑质TH蛋白及阳性神经元均较模型组有显著改善,说明熄风汤能保护由MPTP所诱导的DA神经元的降低。
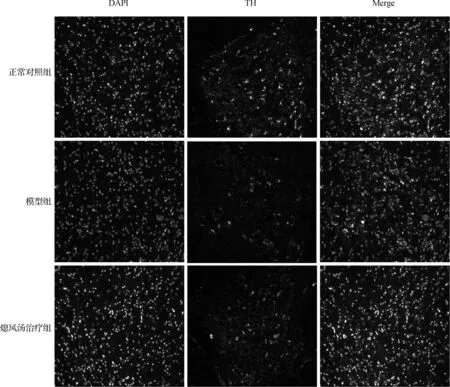
图3不同处理组小鼠TH神经元存活状态(n=6,×200)
Fig 3TH neurons survival status in different treatment groups(n=6,×200)
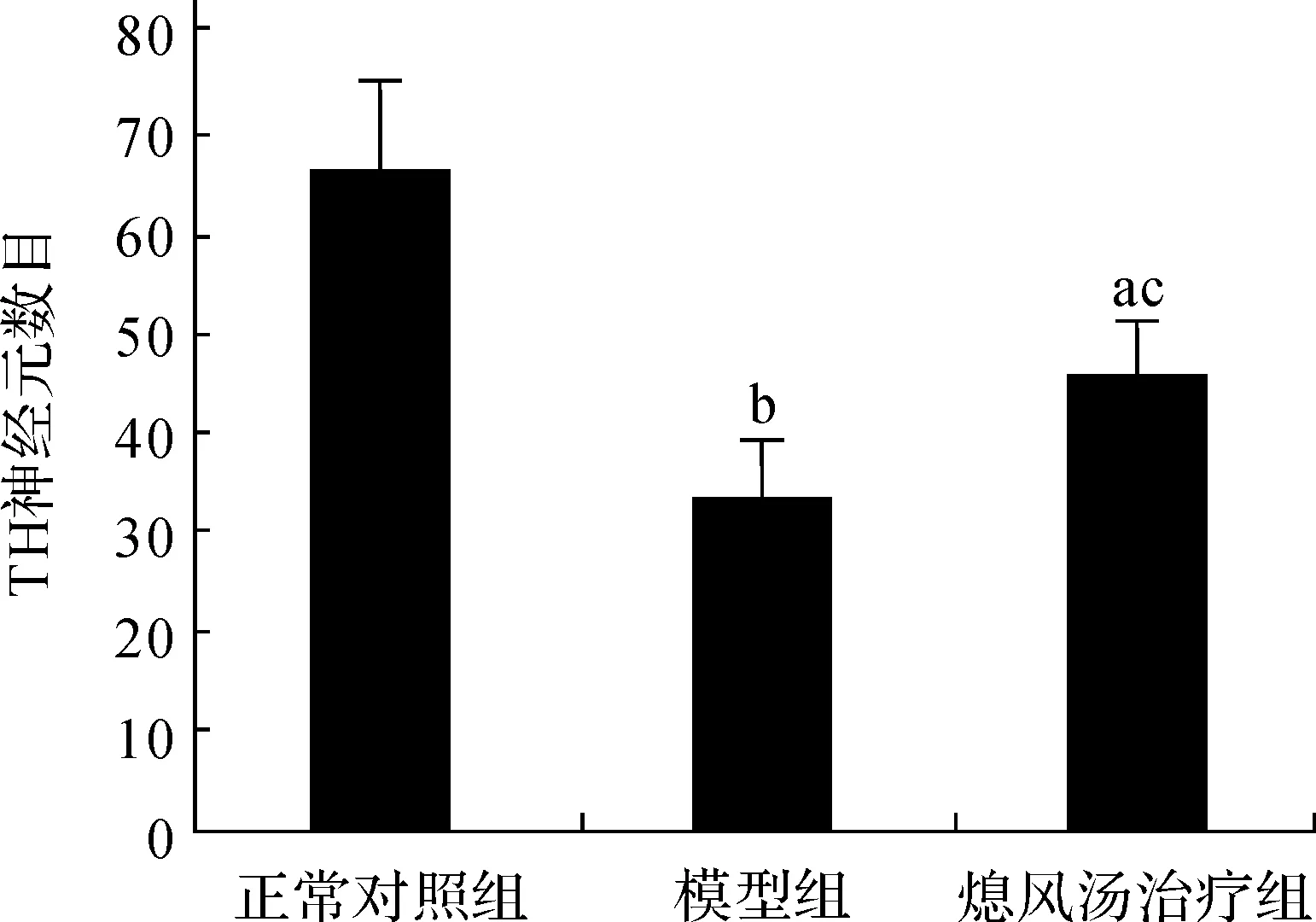
与正常对照组相比, aP<0.05, bP<0.01; 与模型组相比, cP<0.05
图4不同处理组TH神经元数目变化(n=6,×200)
Fig 4TH neurons number changes in different treatment groups(n=6,×200)
熄风汤的保护机制目前还不清楚,可能与下列因素有关:在熄风汤复方中,柴胡归肝胆经,具有疏肝解郁的作用;怀牛膝引血下行,折其阳亢,并能滋养肝肾;白芍具有柔肝养血和平肝敛阴的作用;钩藤具有清热平肝、熄风镇痉的作用。现代药理证明白芍、钩藤均具有抗惊厥、镇静、解痉的作用,党参、山药具有补脾益气的作用,知母具有清虚热生津作用,能有效改善PD患者阴虚潮热的症状;桔梗宣肺利气,通调水道,又能载药上行;甘草调和诸药。全方共奏滋补肝肾、平肝熄风之功,有效改善了PD小鼠的症状。
尽管熄风汤神经保护效应的具体机制尚未阐明,但本研究结果可以提示:10ml·kg-1的熄风汤限时两周的灌胃,对PD模型小鼠黑质DA神经元具有保护作用,为今后深入探讨熄风汤治疗PD提供了新的思路及实验依据。
[参考文献]
[1] 张振馨.神经系统疾病流行病学调查方法和问题[J].中华神经科杂志,2005,38(2):65- 66.
[2] HIRSH E C,JENNER P,PRZEDBORSKI S.Pathogenesis of Parkinson’s disease[J].Mov Disord,2013,28:24- 30.
[3] HAOBAM R,SINDHU K M,CHANDRA G,et al.Swim- test as a function ofmoto impairment in MPTP model of Parkinson’s disease:A comparative study in two mouse strains[J].Behav Brain Res,2005,163:159- 162.
[4] DEV K K,HOFELE K,BARBIERI S,et al.Part II:alpha- synuclein and its molecular pathophysiological role in neurodegenerative disease[J].Neuropharmacology,2003,45(1):14- 44.
[5] 王晶,梁维邦.肝细胞移植治疗帕金森病的研究进展[J].东南大学学报:医学版,2013,32(6):781- 785.
[6] TALENE A,YACOUBIAN M D,DAVID G,et al.Targets for neuroprotec- tion in Parkinson’s disease[J].Biochem Biophys Acta,2009,1792(7):676- 687.
[7] STERU L,CHERMAT R,THIERRY B,et al.The tail suspension test:a new method for screening antidepressants in mice[J].Psychopharmacology(Berlin),1985,85:367- 371.
[8] 张治国.黄芪甲肝对帕金森病神经元的保护作用及其机制研究[D].西安:中国人民解放军第四军医大学,2012.
[9] 姜宏,谢俊霞,钱忠明.MPTP诱导小鼠黑质区铁摄取和DMT1表达增加[J].生理学报,2003,55(5):571- 576.
[10] SMEYNE R J,JACKSON- LEWIS V.The MPTP model of Par- kinson’s disease[J].Molecular Brain Research,2005,134:57- 61.
[11] 接贵祥.乌鸡白凤丸有效成分对MPTP制备的帕金森病模型小鼠的神经保护作用研究[D].青岛:青岛大学,2006.
[12] 杨流海,陈江宁,张峻峰.新型荧光探针应用于帕金森病模型中NO的检测[J].东南大学学报:医学版,2014,33(5):555- 560.
[13] GOLDBERG N R,HAACK A K,LIM N S,et al.Dopaminergic and behavioral correlates of progressive lesioning of the nigrostriatal pathway with MPTP[J].Neuroscience,2011,28(180):256- 271.
Influence of Xifengtang on the dopaminergic neurons of Parkinson model mice
ZHU Hui- jie1,CAO Lin1,TANG Bo2,GUO Kai3
(1.CollegeofFoodScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China;2.NanjingVazymeBiologicalTechnologyCo.LTD,Nanjing210000,China; 3.WangjingHospitalofChinaAcademyofChineseMedicalSciences,Beijing100102,China)
[Abstract]Objective: To investigate the influence of Xifengtang on the dopaminergic neurons of Parkinson model mice under the conditions of oral administered 10 ml·kg-1body weight dose in two weeks time limit. Methods: 30 mice were randomly assigned into three groups: normal control group, model group and Xifengtang- treated group. The first two groups received 10 ml·kg-1saline and Xifengtang- treated group received the same vomule Xifengtang once a day for 2 weeks. Then the model group and the Xifengtang- treated group were intraperitoneally injected with 30 mg·kg-1MPTP once a day for continuously 7 days, and the same volume saline in normal control group. Three days later, behavioral parameters were recorded and tyrosine hydroxylase level was examined by Western blotting and immunohistochemistry. Results: Xifengtang-treated group showed significantly better performance than the other two groups in the tail suspension and forced swimming tests (P<0.05). Also, the TH levels and the number of TH- positive dopaminergic neurons were significantly higher in Xifengtang- treated group(P<0.05). Conclusions: Under the above conditions, Xifengtang can improve the symptoms of mouse with MPTP- induced Parkinson’s disease. Dopaminergic neurons is also being protected from this degenerative process.
[Key words]Xifengtang; 1- methy- 4- phenyl- 1,2,3,6- tetrahy- dropyridine; tyrosine hydroxylase; dopaminergic neurons; Parkinson’s disease; mice
doi:10.3969/j.issn.1671- 6264.2016.01.003
[中图分类号]R742.5; R285.5
[文献标识码]A
[文章编号]1671- 6264(2016)01- 0011- 06
[通信作者]曹林E- mail:caolin@njau.edu.cn
[作者简介]朱会杰(1988-),女,河南周口人,在读硕士研究生。E- mail:zhuhuijie123@163.com
[基金项目]国家自然科学基金资助项目(31101223)
[收稿日期]2015- 07- 20[修回日期] 2015- 09- 12
[引文格式] 朱会杰,曹林,唐波,等.熄风汤对帕金森病模型小鼠多巴胺能神经元的影响[J].东南大学学报:医学版,2016,35(1):11- 16.
·论著·
